一、CAR-T细胞治疗实体瘤的挑战与优化方向
第一代(传统)CAR-T细胞在治疗B细胞白血病及淋巴瘤中已证实具有显著抗肿瘤活性,但其在实体瘤治疗中的应用仍面临多重挑战,包括CAR-T细胞向肿瘤组织浸润不足、在肿瘤微环境中持久性较差以及肿瘤抗原异质性等限制性因素。
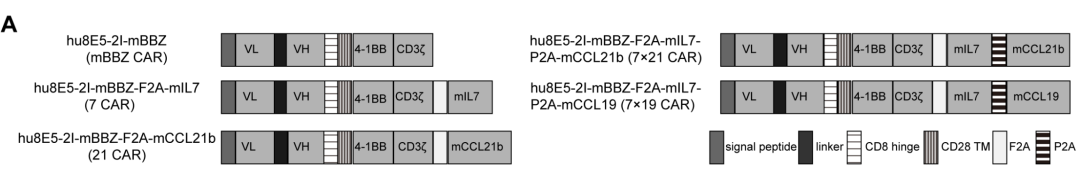
2018年3月发表于《Nature Biotechnology》的一项研究报道,通过在CAR-T细胞中共表达白细胞介素-7(IL-7)与趋化因子CCL19,构建了“7×19 CAR-T细胞”。该修饰型CAR-T细胞在多种实体瘤小鼠模型中表现出显著疗效,对常规CAR-T难以控制的实体瘤可实现完全清除并有效预防复发。其中,CCL19能够募集外周T细胞及树突状细胞向肿瘤组织聚集,增强免疫细胞浸润;而IL-7则可促进T细胞增殖并维持其稳态与长期存活。趋化因子作为关键的免疫信号分子,具有引导白细胞从血管逸出、调控其在组织内定向迁移与微环境归巢的功能。上述研究提示,细胞因子与趋化因子的协同应用可能成为克服实体瘤治疗障碍的有效策略,但不同组合的疗效差异仍需系统探索。
二、趋化因子CCL21在抗肿瘤免疫中的作用机制
作为趋化因子受体7(CCR7)的另一重要配体,CCL21与CCL19在结构及功能上既有关联又有区别。CCL21主要在高内皮微静脉内皮细胞及次级淋巴器官T细胞区的基质细胞中组成性表达,能高效趋化初始T细胞与树突状细胞等抗原提呈细胞。结构上,CCL21在C端延伸出32个氨基酸,该结构域可能赋予其独特的分子互作能力。此外,CCL21还可通过结合CXCR3受体,独立于白细胞招募功能而直接抑制肿瘤生长。
在免疫调控层面,CCL21/CCR7信号轴对协调成熟树突状细胞与初始T细胞的相互作用至关重要,在启动针对肿瘤抗原的特异性T细胞免疫中具有核心地位。近年研究表明,肿瘤局部表达CCL21可显著促进树突状细胞与CD8⁺ T细胞的浸润,并在黑色素瘤、肺癌及结肠癌等多种动物模型中诱导免疫介导的肿瘤抑制效应。基于其化学趋化特性,CCL21已被纳入树突状细胞疫苗的设计策略中。
值得注意的是,在前期7×19 CAR-T细胞研究中,环磷酰胺预处理虽可增强其抗肿瘤效果,但部分患者难以耐受此类强化疗方案。研究表明,在不进行清淋预处理的情况下,宿主T细胞浸润及瘤内T细胞-树突状细胞互作可增强CAR-T细胞的疗效。进一步实验证据显示,CCL21介导的抗肿瘤作用具有淋巴细胞依赖性:在免疫功能健全的小鼠中,瘤内注射CCL21可诱导肿瘤消退,而在免疫缺陷模型中则无此效应。CCL21或CCR7缺失的小鼠均存在淋巴细胞归巢及淋巴结结构异常,进一步印证了该趋化因子在系统免疫调控中的关键作用。
因此,CCL21不仅可促进免疫细胞向肿瘤部位的趋化浸润,还能在与内源性免疫系统协同的基础上增强抗肿瘤应答,这为发展新型装甲化CAR-T细胞提供了理论依据。
三、靶向CLDN18.2的7×21 CAR-T细胞构建与研发进展
为提升CAR-T细胞在实体瘤治疗中的增殖能力与肿瘤归巢效率,研究团队构建了共表达IL-7与CCL21、并以CLDN18.2为靶点的装甲化CAR-T细胞,即7×21 CAR-T细胞。
Claudin18.2(CLDN18.2)是一种胃特异性膜蛋白,在部分胃癌、胰腺癌等实体瘤中异常高表达,被认为是重要的治疗靶点。科济生物此前开发的人源化单链可变区片段(scFv)hu8E5-2I可特异性识别人与小鼠的CLDN18.2。基于该靶点,该公司研发了人源化抗CLDN18.2自体CAR-T细胞注射液(CT041),并于2020年5月获得美国FDA的临床试验许可,用于治疗CLDN18.2阳性晚期胃腺癌/食管胃结合部腺癌及胰腺癌,成为该靶点领域全球首个进入临床研究的CAR-T疗法。该产品也已向中国国家药监局提交临床试验申请,标志着其转化研究进入新阶段。
四、IL-7与CCL21共表达CAR-T细胞在实体瘤模型中的疗效优势
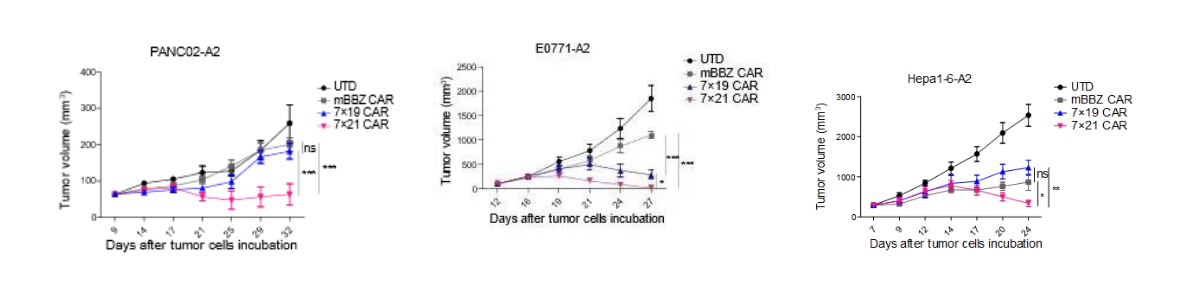
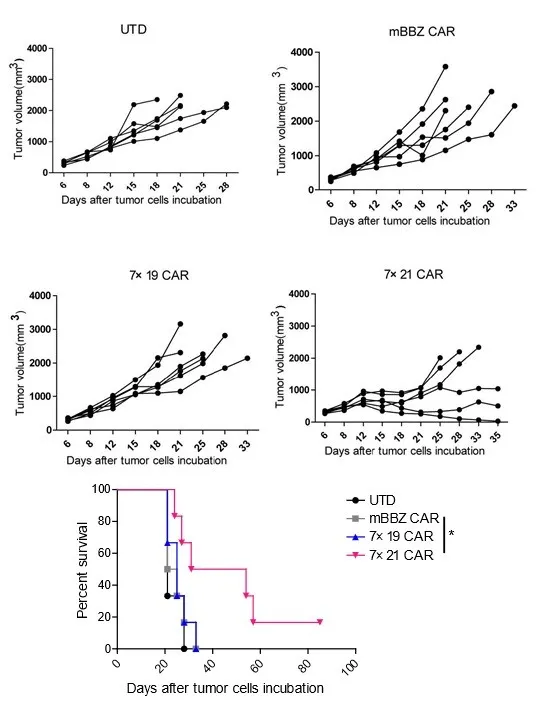
根据《Clinical Cancer Research》发表的研究结果,共表达IL-7与CCL21的CAR-T细胞(7×21 CAR-T)在多种实体瘤模型中展现出显著的治疗优势。其中,IL-7能够有效促进CAR-T细胞的增殖并延长其存活时间,而CCL21则介导淋巴细胞及树突状细胞(DC)向肿瘤部位的定向聚集。相较于传统第二代CAR-T细胞,7×21 CAR-T细胞表现出更强的体外增殖能力与趋化活性,并在小鼠实体瘤模型中实现了更优的治疗效果,且该疗效不依赖于清淋化疗预处理的支持。
研究进一步在三种免疫健全小鼠的肿瘤模型中验证了7×21 CAR-T细胞的抗肿瘤效能。结果显示,在不联合清淋化疗预处理的条件下,7×21 CAR-T细胞仍能高效抑制肿瘤生长,其疗效不仅显著优于常规二代CAR-T细胞,亦明显优于共表达IL-7与CCL19的7×19 CAR-T细胞。这些数据表明,7×21 CAR-T细胞通过协同增强CAR-T细胞自身功能与重塑肿瘤免疫微环境,为实体瘤的免疫治疗提供了具有潜力的新策略。
六、结论与展望
综上所述,共表达IL-7与CCL21的CAR-T细胞通过协同增强CAR-T细胞自身增殖存活、促进免疫细胞肿瘤浸润、抑制血管新生以及克服抗原异质性等多重机制,展现出显著的抗实体瘤潜力。该策略不仅减少了对清淋化疗预处理的依赖,也为应对实体瘤微环境抑制及抗原丢失提供了新思路。7×21 CAR-T细胞代表一种具有良好转化前景的实体瘤免疫治疗新方向,其临床疗效与安全性值得进一步通过临床试验予以验证。未来研究可继续探索不同细胞因子与趋化因子的组合效应,以不断优化CAR-T细胞在实体瘤治疗中的应用策略。
七、CCL21趋化因子检测服务哪个品牌提供?
LabEx为您提供专业、灵敏的CCL21趋化因子检测服务。CCL21是介导淋巴细胞和树突状细胞归巢至次级淋巴器官的关键趋化因子,在调控适应性免疫应答的启动、淋巴结发育以及自身免疫和肿瘤免疫中发挥核心作用。
| 货号 | Panel名称 | 种属 | 检测指标 |
| LXLBH40-1 | 人趋化因子/细胞因子-40因子Panel | Human | 6Ckine/CCL21,BCA-1/CXCL13,CTACK/CCL27,ENA-78/CXCL5,Eotaxin/CCL11,Eotaxin-2/CCL24,Eotaxin-3/CCL26,Fractalkine/CX3CL1,GCP-2/CXCL6,GM-CSF,GRO-α (Gro-a/KC/CXCL1),Gro-β/CXCL2,I-309/CCL1,IFN-γ,IL-1β,IL-2,IL-4,IL-6,IL-8/CXCL8,IL-10,IL-16,IP-10/CXCL10,I-TAC/CXCL11,MCP-1/CCL2,MCP-2/CCL8,MCP-3/CCL7,MCP-4/CCL13,MDC/CCL22,MIF,MIG/CXCL9,MIP-1α/CCL3,MIP-1δ/CCL15,MIP-3α/CCL20,MIP-3β/CCL19,MPIF-1/CCL23,SCYB16/CXCL16,SDF-1α+β/CXCL12,TARC/CCL17,TECK/CCL25,TNF-α |
| LXAH031-1 | 人趋化因子抗体芯片Panel(31因子) | Human | IL-16,CXCL11/I-TAC,CCL22/MDC,CX3CL1/Fractalkine,CCL17/TARC,CCL5/RANTES,CXCL5/ENA-78,CCL26/Eotaxin-3,XCL1/Lymphotactin,CXCL4/PF4,CCL18/PARC,CXCL16,CCL28,CCL14/HCC-1/HCC-3,CXCL7/NAP-2,Chemerin,CCL21/6Ckine,Midkine,CXCL9/MIG,CCL1/I-309,CXCL8/IL-8,CCL2/MCP-1,CCL3/CCL4 (MIP-1 alpha/MIP-1 beta),CXCL10/IP-10,CCL7/MCP-3,CXCL12/SDF-1,CCL15/MIP-1 delta/LKN-1,CXCL1/GRO alpha,CXCL17/VCC-1,CCL19/MIP-3 beta,CCL20/MIP-3 alpha |
| LXRLBH40-1 | 人趋化因子/细胞因子-40因子Panel | Human | GM-CSF,IFN-γ,IL-10,IL-16,IL-2,IL-4,IL-6,IL-8/CXCL8,MIF,SCYB16/CXCL16,TNF-α,MIP-1δ/CCL15,6Ckine/CCL21,BCA-1/CXCL13,CTACK/CCL27,ENA-78/CXCL5,Eotaxin/CCL11,Eotaxin-2/CCL24,Eotaxin-3/CCL26,Fractalkine/CX3CL1,GCP-2/CXCL6,GRO-α (Gro-a/KC/CXCL1),Gro-β/CXCL2,I-309/CCL1,IL-1β,IP-10/CXCL10,I-TAC/CXCL11,MCP-1/CCL2,MCP-2/CCL8,MCP-3/CCL7,MCP-4/CCL13,MDC/CCL22,MIG/CXCL9,MIP-1α/CCL3,MIP-3α/CCL20,MIP-3β/CCL19,MPIF-1/CCL23,SDF-1α+β/CXCL12,TARC/CCL17,TECK/CCL25 |












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


