巨噬细胞作为先天免疫系统的核心组成部分,具有显著的表型可塑性,在不同微环境信号刺激下可极化为促炎性M1型和抗炎性M2型巨噬细胞。这两种表型通过分泌不同的细胞因子网络调控炎症反应进程,其动态平衡对维持体内稳态至关重要。
一、 巨噬细胞极化的生物学基础与调控机制
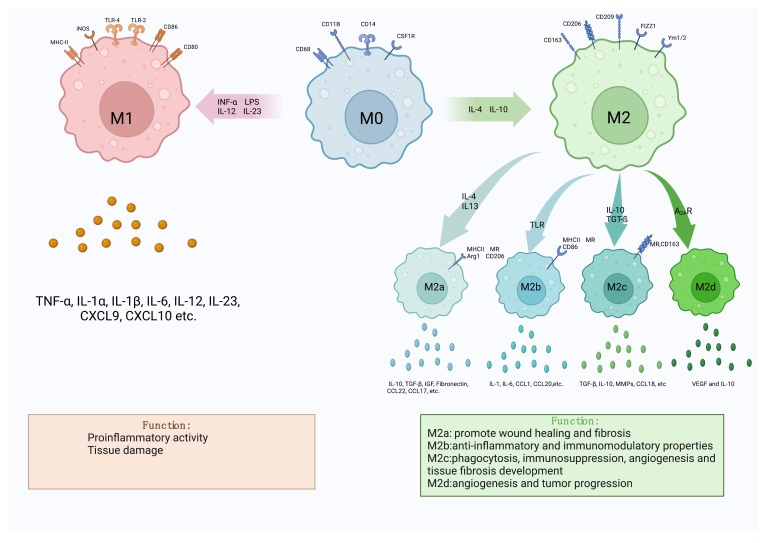
图1. 巨噬细胞极化图
Luo M, Zhao Fy et al. Macrophage polarization: an important role in inflammatory diseases. Front Immunol. 2024 Apr 10;15:1352946.
巨噬细胞起源于骨髓造血干细胞,静息状态下为未极化的M0型,其极化方向由微环境中的细胞因子信号决定。当受到脂多糖(LPS)、干扰素-α(INF-α)、IL-12、IL-23等促炎信号刺激时,M0型巨噬细胞会极化为M1型巨噬细胞;而在IL-4、IL-10、转化生长因子-β(TGF-β)等抗炎因子或腺苷2A受体(A2AR)激活的作用下,则向M2型巨噬细胞分化。 M1型巨噬细胞高表达CD80、CD86、TLR-4、MHC-II等表面标志物,通过激活烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶系统产生活性氧(ROS),并分泌肿瘤坏死因子-α(TNF-α)、IL-1α、IL-6、IL-12等促炎因子,发挥抗菌、抗癌作用,但过度激活会导致组织损伤。M2型巨噬细胞进一步分为M2a、M2b、M2c、M2d四个亚型,共同高表达CD163、CD206、CD209等标志物,各亚型功能存在差异:M2a参与伤口愈合与纤维化,M2b具有抗炎和免疫调节功能,M2c参与吞噬作用和免疫抑制,M2d与血管生成相关。 巨噬细胞极化的调控涉及复杂的信号通路网络。核因子κB(NF-κB)、应激激活蛋白激酶/丝裂原活化蛋白激酶(SAPK/MAPK)、Janus激酶/信号转导及转录激活因子(JAK/STAT)通路是促进M1极化的核心通路,主要由促炎细胞因子激活,增强巨噬细胞存活与促炎功能;PI3K/Akt信号通路则偏向调控M2极化,影响巨噬细胞的代谢重编程与抗炎功能。此外,非编码RNA在极化调控中扮演重要角色,如circRNA_0000518通过CaMKKβ/AMPK-PGC-1α通路促进M1极化,lncRNA-MIR222HG通过靶向miR146a-5p调节M2极化,为极化机制研究提供了新的分子靶点。 正常生理状态下,M1与M2型巨噬细胞保持动态平衡,且表型可逆转转换,这种可塑性使其能够灵活应对体内炎症变化,是机体调节免疫反应的关键机制。
二、巨噬细胞极化在炎症性疾病中的病理作用规律
(一)自身免疫性疾病
自身免疫性疾病的核心病理特征是免疫系统异常识别自身抗原,引发持续炎症反应,M1/M2极化失衡是其共同致病因素。
类风湿关节炎(RA):滑膜组织和外周血中M1型巨噬细胞大量浸润,高表达MHC-II、CD80等标志物,分泌TNF-α、IL-6等促炎因子加重关节炎症,导致软骨破坏;M2型巨噬细胞分泌的IL-10可缓解炎症,其数量增加是病情缓解的重要指标,NF-κB、JAK/STAT等通路异常激活放大M1极化效应。
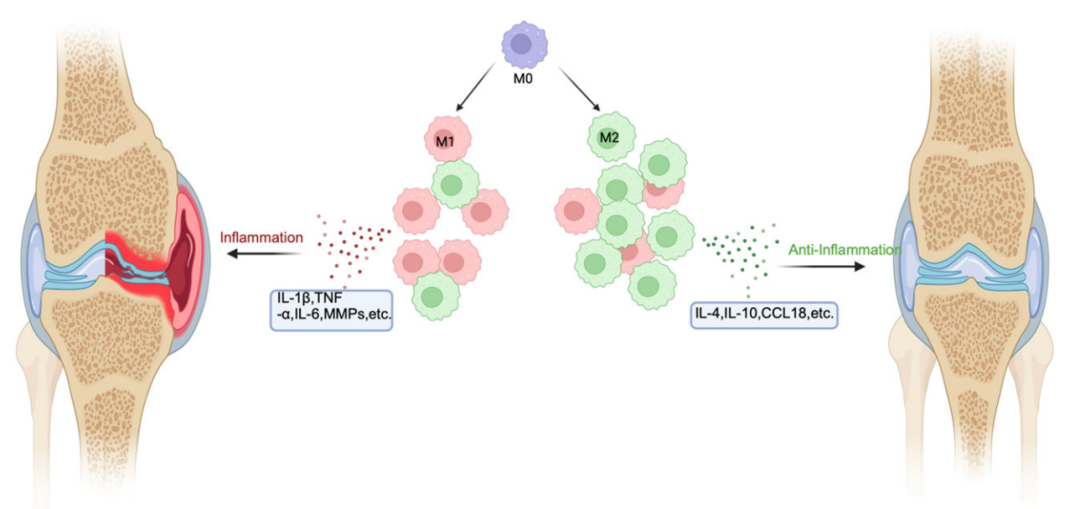
图2. RA 中巨噬细胞极化的机制
Luo M, Zhao Fy et al. Macrophage polarization: an important role in inflammatory diseases. Front Immunol. 2024 Apr 10;15:1352946.
多发性硬化症(MS)与实验性自身免疫性脑脊髓炎(EAE):巨噬细胞与小胶质细胞浸润中枢神经系统,M1型通过释放炎症介质、诱导氧化应激导致髓鞘破坏和轴突损伤;疾病后期M2型占据主导,通过吞噬髓鞘碎片促进修复,膜蛋白Tim-3抗体、circRNA_0000518等可通过调控极化影响疾病进展。
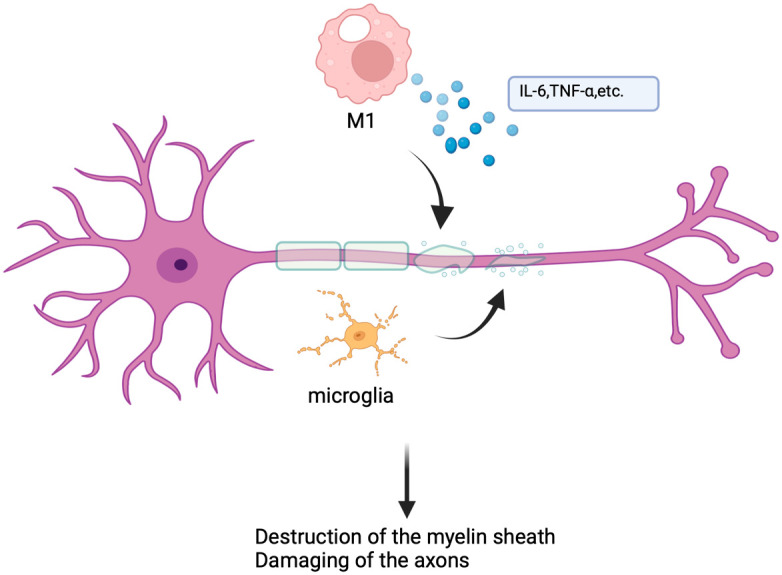
图3. 多发性硬化症中巨噬细胞的机制
Luo M, Zhao Fy et al. Macrophage polarization: an important role in inflammatory diseases. Front Immunol. 2024 Apr 10;15:1352946.
自身免疫性肝炎(AIH):以单核细胞(含巨噬细胞)浸润引发的界面性肝炎为特征,AIH-1型中M1样巨噬细胞占比升高,可溶性CD163(sCD163)可作为疾病监测潜在指标,RIP3、EZH2等分子通过调节极化影响疾病进程。
(二)动脉粥样硬化
动脉粥样硬化全病程以炎症为核心,巨噬细胞极化失衡是关键环节。内皮细胞受刺激后释放炎症介质,招募单核细胞进入动脉壁并分化为巨噬细胞:M1型吞噬氧化低密度脂蛋白(ox-LDL)形成泡沫细胞,聚集形成斑块脂质核心,同时分泌基质金属蛋白酶(MMPs)破坏血管胶原纤维,导致斑块破裂;M2型通过抑制炎症、促进脂质代谢延缓斑块进展,但随疾病进展数量减少。表观遗传修饰、miRNA调控、自噬异常等参与极化调控,如三氧化二砷通过调节自噬平衡极化,Kallistatin可减少M1样巨噬细胞浸润。
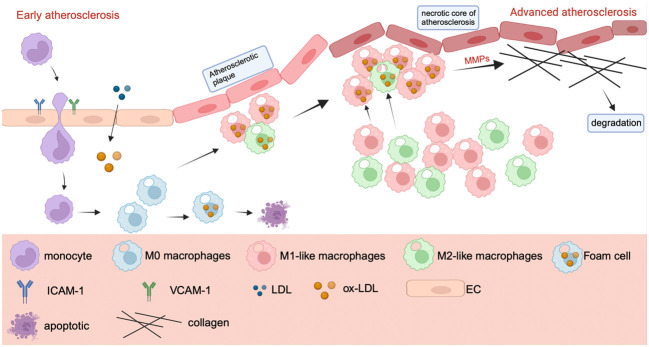
图4. 动脉粥样硬化中巨噬细胞极化的机制
Luo M, Zhao Fy et al. Macrophage polarization: an important role in inflammatory diseases. Front Immunol. 2024 Apr 10;15:1352946.
(三)过敏性疾病
过敏性疾病与Th2型免疫反应密切相关,巨噬细胞极化异常是核心病理机制。
过敏性鼻炎(AR):患者体内IL-4、IL-5等细胞因子升高,lncRNA-MIR222HG下调减少M2极化,lncRNA GAS5激活NF-κB通路促进M1极化,均加剧炎症。
特应性皮炎:巨噬细胞高水平浸润,Hsa_circ_0004287通过抑制p38/MAPK通路减少M1激活,紫花地丁配方通过激活JAK2/STAT3通路促进M2极化,均缓解病情。
过敏性哮喘:M2型巨噬细胞是主要效应细胞,ATP6V0d2通过调控Pu.1降解影响极化,LncRNA AK089514/miR-125b-5p/TRAF6轴增强M2极化,其异常与哮喘发病密切相关。
(四)2型糖尿病与肥胖
2型糖尿病(T2DM)和肥胖均为代谢紊乱性疾病,与巨噬细胞极化异常高度相关。肥胖患者脂肪组织中巨噬细胞富集,更易极化为M1型,分泌IL-1β激活NF-κB通路,引发胰岛素抵抗,促进T2DM发生;M1型依赖糖酵解供能,加剧炎症,M2型通过脂肪酸氧化参与组织修复。高糖环境直接促进M1极化,补体3(C3)、miR-34a等分子通过调控极化加重炎症与代谢紊乱,自噬异常也参与其中。
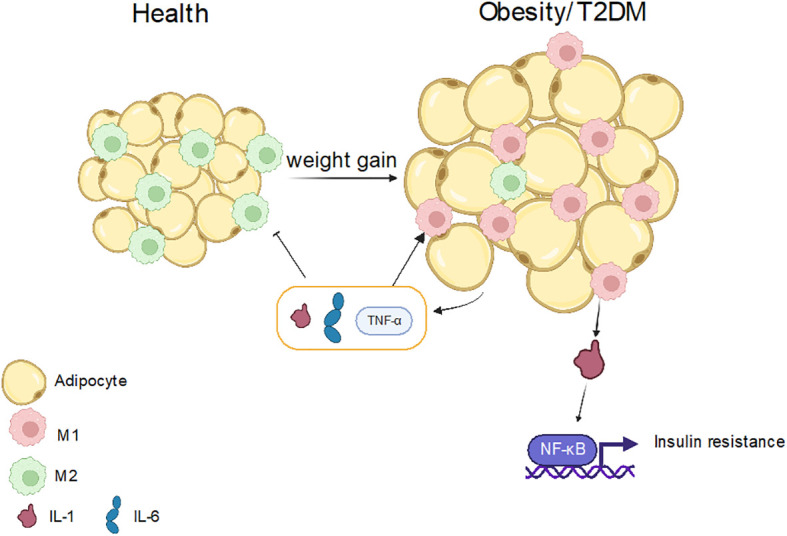
图5. 巨噬细胞极化在肥胖和 T2DM 中的作用
Luo M, Zhao Fy et al. Macrophage polarization: an important role in inflammatory diseases. Front Immunol. 2024 Apr 10;15:1352946.
(五)代谢稳态调控
代谢稳态的维持依赖代谢途径平衡与免疫反应协调,巨噬细胞极化是关键调控环节。信号转导和转录激活因子6、kruppel样因子4等通过促进M2极化或改善线粒体代谢,维持代谢平衡;IL-25通过交替激活M1和M2巨噬细胞,刺激米色脂肪产生,参与能量代谢调控。非肥胖人群M2型巨噬细胞数量多于M1型,体重减轻与M1向M2转化相关,营养失衡或感染打破极化平衡,会形成炎症与代谢紊乱的恶性循环。
三、LabEx实验服务助力巨噬细胞极化研究
巨噬细胞极化在炎症性疾病中的核心作用已得到广泛证实,当前科研领域虽取得诸多突破,但仍有诸多关键科学问题亟待解决。未来研究可依托专业技术平台的支撑,聚焦以下核心方向展开深入探索:
一是深入解析不同疾病中巨噬细胞极化的特异性调控网络,明确M2亚型间的功能差异及转换机制,为精准靶向提供理论基础。
LabEx的蛋白芯片、抗体芯片等技术平台,能够系统分析极化相关蛋白的表达谱特征,快速捕捉调控通路中的关键分子交互关系,为调控网络的构建提供全面且可靠的数据支撑。
二是聚焦调控极化的关键分子靶点挖掘,尤其是非编码RNA、表观遗传修饰因子等新型调控因子,这需要整合转录组学、表观遗传学等多维度技术手段。
LabEx已建立完善的单细胞测序平台及多组学整合分析体系,能够实现从基因到蛋白水平的全链条检测,助力科研人员高效筛选并验证具有功能意义的极化调控靶点。
三是通过动物模型与临床样本的协同研究,验证极化调控分子的临床价值,进而建立疾病诊断与预后评估的生物标志物。
LabEx在ELISA、Luminex液相微阵列、多重免疫组化等技术领域积累了丰富经验,累计处理样本超100万份,凭借严格的标准化操作流程和精准的检测技术,可确保临床样本与动物模型数据的一致性和可靠性,加速生物标志物的临床转化进程。
四是探索巨噬细胞极化与其他免疫细胞的相互作用机制,揭示炎症反应的网络调控规律。
这需要精准捕捉细胞间的功能关联及空间定位特征,LabEx的流式检测(FCM)可实现免疫细胞的精准分选与功能分析,而空间多组学技术更能直观呈现组织微环境中极化巨噬细胞与其他免疫细胞的分布模式及相互作用,为解析炎症网络调控提供全新视角。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


