一、T细胞耗竭——肿瘤免疫治疗的核心挑战
T细胞耗竭是指在慢性感染或肿瘤等病理条件下,由于长期暴露于持续性抗原及炎性微环境,T细胞逐步丧失效应功能及记忆特征的一种功能衰退状态。该过程通常表现为增殖能力下降、细胞因子分泌减少以及抑制性受体表达上调,并可能最终导致T细胞应答能力的不可逆损伤。
在肿瘤免疫、感染免疫及自身免疫性疾病中,T细胞耗竭均扮演关键角色。其发生机制涉及表观遗传重塑、转录调控网络改变及代谢失调等多层次生物学过程。目前,针对逆转或延缓T细胞耗竭的策略已成为疫苗研发、免疫治疗及靶向药物开发的重要方向,相关研究持续受到学术期刊、科研资助机构及临床转化领域的高度关注。
以下整理数篇代表性文献,就其研究思路与方法进行剖析,以期为该领域的进一步探索提供参考。
二、代谢重编程驱动T细胞耗竭——肿瘤微环境氨积累的作用
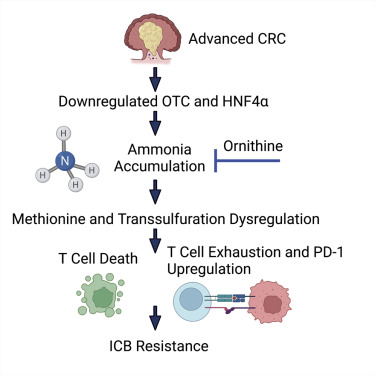
结直肠癌(CRC)晚期患者常面临治疗选择有限的困境。CRC肿瘤微环境因代谢异常及毗邻微生物群,导致包括氨在内的代谢废物累积。Cell Metabolism(IF:29.0)发表的研究通过构建CRC原位转移小鼠模型,并结合多组学分析,发现肿瘤组织中存在显著的氨蓄积现象。高浓度氨可诱导T细胞代谢重编程,进而增强其耗竭表型并抑制增殖能力。
临床数据分析显示,CRC患者血清氨水平升高,且氨相关基因表达特征与T细胞功能抑制、患者不良预后以及对免疫检查点阻断治疗反应不佳显著相关。机制研究表明,促进氨清除能够有效重新激活T细胞功能、抑制肿瘤生长并延长生存期。此外,降低肿瘤相关氨水平可协同增强抗PD-L1疗法的疗效。这些结果提示,靶向氨解毒过程可能为重新激活T细胞功能、提升免疫治疗应答提供新的策略。
三、SULT2B1-CS-DOCK2信号轴调控肝细胞癌微环境中的效应T细胞耗竭
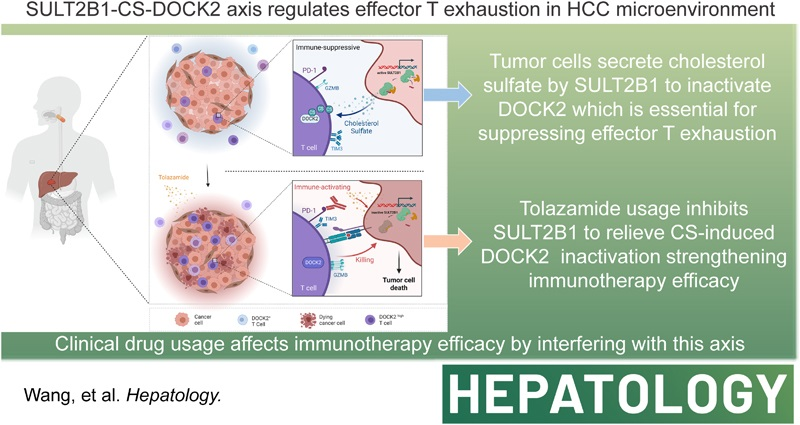
肝细胞癌(HCC)是一种高恶性程度的肿瘤。与经典的酪氨酸激酶抑制剂疗法相比,免疫检查点抑制剂在HCC治疗中显示出更优的疗效,但总体应答率仍有局限。其中,肿瘤浸润淋巴细胞,尤其是CD8⁺ T细胞的功能耗竭,是影响治疗效果的核心机制之一。Hepatology(IF:14.0)发表的研究通过机器学习与多重免疫组化分析,发现胞质分裂蛋白DOCK2是HCC中CD8⁺ T细胞浸润的潜在标志物。
通过机器学习与多重免疫组化分析,研究确认胞质分裂蛋白DOCK2是HCC中CD8⁺ T细胞浸润的潜在标志物。进一步的RNA测序、流式细胞术分析及小鼠HCC模型验证表明,DOCK2功能失活会导致肿瘤内浸润CD8⁺ T细胞呈现耗竭表型。利用准靶向代谢组学、质谱及飞行时间质谱技术,研究发现肿瘤细胞中磺基转移酶2B1(SULT2B1)介导合成的硫酸胆固醇,能够抑制T细胞中DOCK2的酶活性。通过虚拟筛选、分子对接模拟及实验验证,研究证实药物阿扎那韦甲磺酸盐可逆转由DOCK2失活介导的CD8⁺ T细胞耗竭,并能增强抗PD-L1抗体联合阿帕替尼在HCC免疫治疗中的协同疗效。
综上所述,本研究揭示DOCK2是调控HCC中CD8⁺ T细胞浸润的关键因子,而肿瘤细胞通过SULT2B1合成硫酸胆固醇,进而促使效应T细胞发生耗竭。这一发现提示,靶向SULT2B1-CS-DOCK2信号轴可能为改善HCC免疫治疗疗效提供新的干预策略。
四、基于CRISPR/Cas9筛选发现CHSY1通过激活琥珀酸代谢途径促进结直肠癌肝转移中CD8⁺ T细胞耗竭
结直肠癌(CRC)最常发生肝脏转移,超过50%的患者在诊断或治疗过程中会出现肝转移。转移的发生取决于一系列被称为侵袭性转移级联的分子事件。然而,肝脏微环境中调控转移起始的关键基因及通路尚不明确。Journal of Experimental & Clinical Cancer Research(IF:11.3)发表的研究利用CRISPR/Cas9全基因组筛选系统,发现硫酸软骨素合成酶CHSY1在CRC肝转移中发挥关键作用。
本研究利用体内小鼠模型,通过CRISPR/Cas9全基因组筛选系统,系统性鉴定了调控CRC肝转移的关键因子。筛选结果提供了涵盖促进或抑制CRC肝定植的基因谱。通过逐一进行基因沉默验证,研究发现硫酸软骨素合成酶CHSY1可能参与CRC转移进程。随后的体内外功能实验证实,CHSY1在促进CRC肝转移中发挥关键作用。结合TCGA数据库分析与CRISPR筛选结果,发现CHSY1在CRC原发灶及肝转移组织中均显著高表达,且其高表达与患者不良预后密切相关。
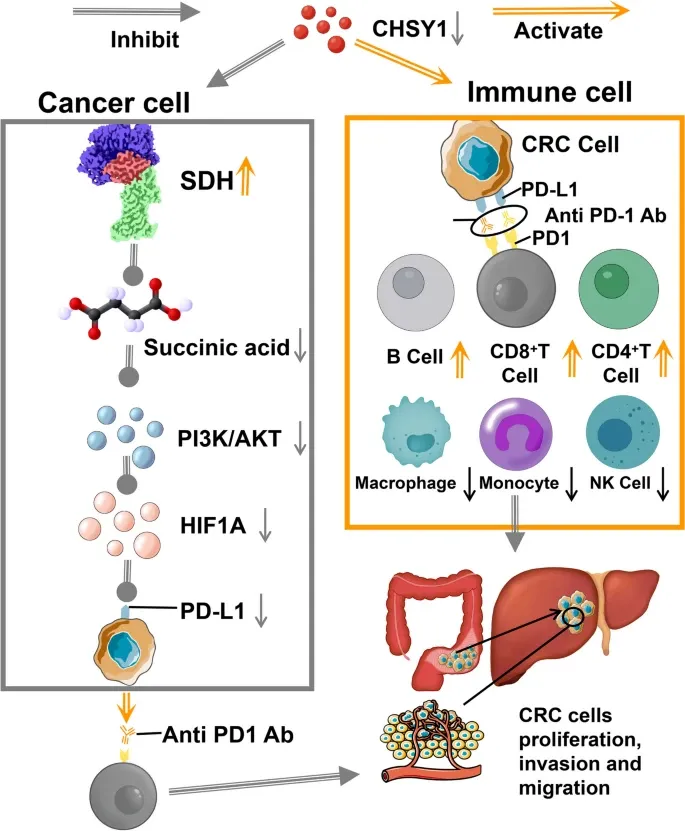
机制研究表明,CHSY1不仅直接促进CRC肝转移,还通过诱导CD8⁺ T细胞耗竭及上调PD-L1表达,营造免疫抑制性微环境。代谢组学分析进一步揭示,CHSY1通过激活琥珀酸代谢途径,驱动CD8⁺ T细胞功能耗竭,进而促进CRC肝转移进展。
在转化应用层面,研究证实青蒿素作为CHSY1活性抑制剂,能够显著抑制肝转移、增强抗PD-1疗法的疗效。进一步构建的PLGA包裹青蒿素联合ICG探针的递送系统,有效降低了肝转移负荷,提升了抗PD-1治疗CRC的效果。综合机制表明,CHSY1通过激活琥珀酸代谢及下游PI3K/AKT/HIF-1α信号通路,促进CD8⁺ T细胞耗竭,从而驱动CRC肝转移。
综上所述,靶向CHSY1联合免疫检查点抑制剂,可形成协同抗肿瘤效应。青蒿素作为潜在CHSY1抑制剂,与抗PD-1联用为CRC肝转移的治疗提供了新的靶向策略与临床转化前景。
原文链接:https://jeccr.biomedcentral.com/articles/10.1186/s13046-023-02803-0
五、p21通过调控CD4⁺ T细胞功能状态抑制结直肠癌抗肿瘤免疫应答中的T细胞耗竭
T细胞在抗结直肠癌(CRC)免疫应答中发挥关键作用,但其效应功能常受T细胞耗竭的限制。目前,调控T细胞耗竭的内在分子机制尚未完全阐明。本研究旨在探究细胞周期蛋白依赖性激酶抑制剂Cdkn1a/p21在CD4⁺ T细胞中的功能,及其对抗肿瘤免疫应答的调节作用。Gastroenterology(IF:29.4)发表的研究揭示了细胞周期调控因子p21在维持CD4⁺ T细胞功能中的关键作用。
研究利用小鼠CRC模型,系统分析了p21在CD4⁺ T细胞中的功能。同时,通过检测I期至IV期CRC患者样本中p21的表达水平,评估其临床相关性。体外共培养实验进一步用于解析p21缺陷对CD4⁺ T细胞效应功能的影响。
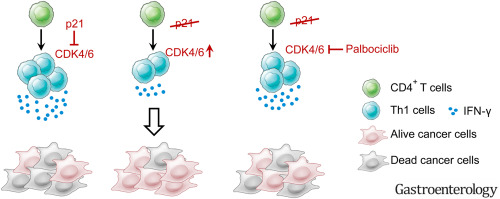
结果表明,细胞周期调控因子p21的活化对CD4⁺ T细胞的细胞毒功能至关重要。在Th1细胞中特异性缺失p21会促进小鼠CRC肿瘤生长。临床数据分析显示,CRC患者肿瘤浸润CD4⁺ T细胞中p21的低表达与不良预后显著相关。机制上,p21缺陷的Th1细胞在CRC小鼠模型中呈现耗竭表型,主要表现为效应/效应记忆T细胞比例下降,以及共刺激分子CD27/CD28表达缺失。
通过使用细胞周期蛋白依赖性激酶4/6抑制剂帕博西尼处理p21缺陷T细胞,并进行过继性T细胞回输实验,研究证实该处理可恢复T细胞的细胞毒性功能,并有效逆转p21缺陷CD4⁺ T细胞的耗竭状态。这一发现为未来基于T细胞功能调控的免疫治疗策略提供了潜在方向。
本研究揭示了p21在协调细胞周期进程与维持Th1细胞功能、防止其耗竭中的关键作用。同时,提示细胞周期蛋白依赖性激酶抑制剂(如帕博西尼)在缓解T细胞耗竭、增强抗肿瘤免疫方面具有重要治疗潜力,为CRC及其他实体肿瘤的免疫治疗提供了新的理论依据。
六、总结与展望
T细胞耗竭作为肿瘤免疫治疗的主要障碍,其调控机制涉及代谢重编程、信号通路异常、表观遗传改变及细胞周期失调等多个层面。近期研究从不同角度揭示了T细胞耗竭的新机制,并提出了相应的干预策略:
💯靶向肿瘤代谢微环境(如氨清除策略)
💯调控关键信号通路(如SULT2B1-CS-DOCK2轴)
💯干预代谢-表观遗传交叉调控(如CHSY1-琥珀酸代谢通路)
💯调节细胞周期相关蛋白(如p21-CDK通路)
这些研究不仅深化了对T细胞耗竭机制的理解,更为开发新型联合免疫治疗策略提供了理论依据。未来研究需进一步探索不同机制间的交互作用,开发特异性更强的靶向药物,并通过临床转化验证其安全性和有效性,最终实现肿瘤免疫治疗疗效的全面提升。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


