转化生长因子-β(TGF-β)作为肿瘤微环境中关键的免疫抑制因子,其信号网络在肿瘤发生发展中呈现复杂的调控作用。通过经典SMAD依赖途径与非经典信号通路的动态转换,TGF-β不仅实现从抑癌到促癌的功能转变,还通过精准调控肿瘤相关成纤维细胞(CAF)活化与T细胞谱系功能,构建系统性免疫抑制微环境,成为肿瘤免疫逃逸的核心驱动因素。
一、TGF-β的信号传导网络与功能转换机制
(一)核心分子互作模式
TGF-β家族中,TGF-β1在多数实体瘤中占据主导表达地位,通过高亲和力结合细胞表面的Ⅱ型转化生长因子-β受体(TGF-βRII)启动信号级联反应。TGF-βRII广泛分布于肿瘤细胞、CAF及免疫细胞表面,与Ⅰ型受体(TGF-βRI)形成异源二聚体受体复合物,该复合物是下游信号传导的核心枢纽,介导 TGF-β 生物学效应的启动与传递。
(二)双重信号传导通路的动态调控
TGF-β的生物学功能依赖经典SMAD依赖途径与非经典途径的协同与转换,其功能偏向性随肿瘤进展阶段动态变化:
1. 经典SMAD途径:在癌前病变阶段,TGF-β结合受体后激活SMAD2/3蛋白,后者与SMAD4形成异源多聚体复合物并进入细胞核,调控细胞周期抑制因子等靶基因表达,发挥抑制细胞异常增殖、维持基因组稳定性的抑癌功能,是该阶段TGF-β生物学作用的主要分子基础。
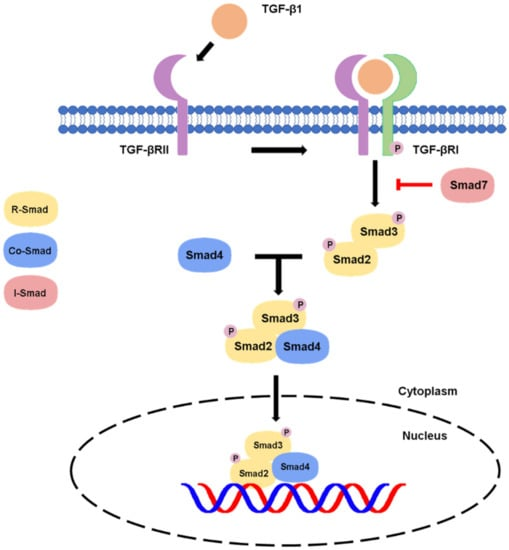
图1. TGF-β信号的经典途径
Chung JY, Chan MK et al.. TGF-β Signaling: From Tissue Fibrosis to Tumor Microenvironment. Int J Mol Sci. 2021 Jul 15;22(14):7575.
2. 非经典途径:随着肿瘤进展,经典SMAD通路常因基因突变、表观遗传修饰等发生失活,MAPK、PI3K/AKT及RhoA/ROCK等非经典途径逐渐占据主导。这些通路通过调控细胞骨架重塑、代谢重编程及细胞迁移相关基因表达,赋予TGF-β强大的促癌活性,推动肿瘤恶性演进。
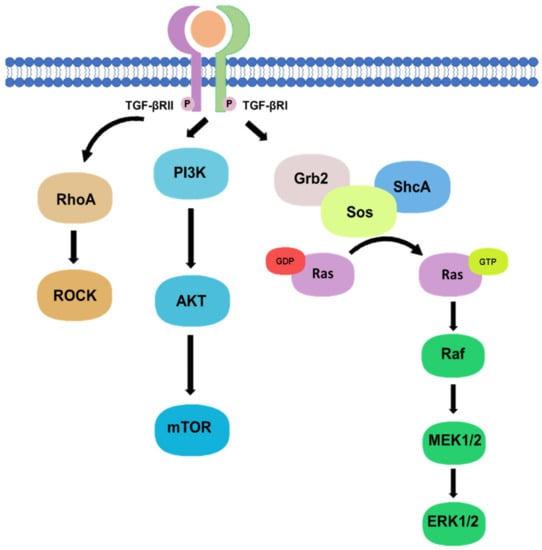
图2. TGF-β信号的非经典途径
Chung JY, Chan MK et al.. TGF-β Signaling: From Tissue Fibrosis to Tumor Microenvironment. Int J Mol Sci. 2021 Jul 15;22(14):7575.
(三)肿瘤微环境中的多维度促癌效应
TGF-β的促瘤功能呈现多靶点、网络化特征:通过诱导上皮间质转化(EMT)程序,增强癌细胞的迁移与侵袭能力;调控血管内皮生长因子(VEGF)等血管生成相关因子的表达,优化肿瘤血供微环境;核心作用在于重塑肿瘤免疫微环境,通过抑制效应免疫细胞功能、激活免疫抑制细胞群体,构建免疫耐受微环境;同时激活CAF参与肿瘤基质重构,形成物理与免疫双重屏障,全方位助推肿瘤进展。
二、TGF-β对CAF的调控:肿瘤微环境屏障的构建机制
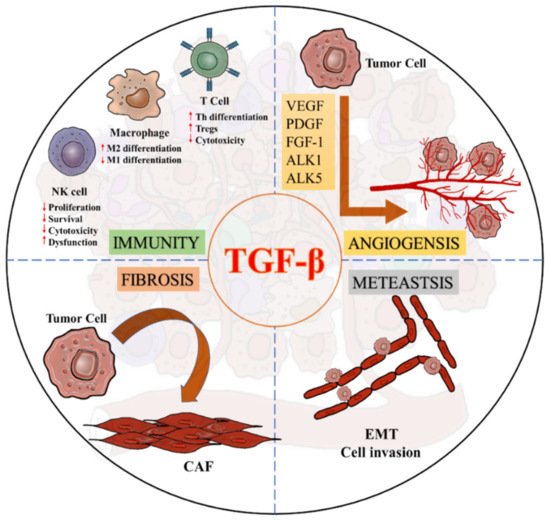
图3. TGF-β信号在促瘤TME中的多种作用
Chung JY, Chan MK et al.. TGF-β Signaling: From Tissue Fibrosis to Tumor Microenvironment. Int J Mol Sci. 2021 Jul 15;22(14):7575.
(一)CAF的活化与表型重编程
成纤维细胞是TGF-β最敏感的靶细胞类型,也是肿瘤微环境中丰度最高的间质细胞。在TGF-β的持续刺激下,正常成纤维细胞发生显著的表型重编程,向肌成纤维样细胞转化,伴随α-平滑肌肌动蛋白(α-SMA)、Ⅰ型胶原蛋白(COL1A1)、纤维连接蛋白(FN1)等特征性标志物基因的表达上调,最终形成具备高收缩活性、强分泌功能的CAF群体,在肿瘤基质中占据功能主导地位。
(二)CAF介导的肿瘤屏障功能机制
活化的CAF通过多重途径构建肿瘤防御体系,强化肿瘤的恶性表型:
1.物理屏障构建:通过大量沉积胶原、纤维连接蛋白等细胞外基质成分,重塑肿瘤间质结构,增加组织致密性,形成物理屏障,阻碍免疫细胞向肿瘤核心区域浸润。
2.免疫抑制调控:分泌IL-6、CXCL12等趋化因子与细胞因子,特异性招募免疫抑制细胞(如M2型巨噬细胞、髓系来源抑制细胞)进入肿瘤微环境;同时直接抑制效应性免疫细胞(如CD8⁺T细胞、树突状细胞)的功能活性,加剧免疫耐受。
3.旁分泌信号调控:通过分泌VEGF、表皮生长因子等促增殖因子,直接促进肿瘤细胞的增殖与存活,同时调控血管生成相关信号,为肿瘤生长提供营养支持。
(三)TGF-β-CAF正反馈环路的强化作用
CAF被TGF-β激活后,可通过自分泌方式持续分泌TGF-β,形成稳定的正反馈调控环路。该环路不仅进一步放大自身的活化信号,还能刺激邻近成纤维细胞的表型转换,持续强化间质致密化与免疫抑制信号,使肿瘤微环境逐渐固化为对免疫系统极度不利的“免疫豁免区”,是肿瘤免疫逃逸持续性的关键分子机制。
三、TGF-β对T细胞的调控:免疫功能抑制的核心网络
(一)对造血干细胞与T细胞发育的调控
在生理稳态下,TGF-β通过经典SMAD途径抑制造血干细胞(HSC)的过度增殖与异常分化,维持干细胞池的稳定与功能平衡,防止干细胞耗竭与恶性转化。但在肿瘤相关应激或组织损伤条件下,高浓度或持续暴露的TGF-β信号会诱导HSC进入深度静止状态,显著抑制其增殖与分化能力,甚至诱导凋亡,间接削弱T细胞及其他血液免疫细胞谱系的生成与补充,从源头限制免疫效应细胞的供给。
(二)对成熟T细胞功能的谱系特异性调控
TGF-β对成熟T细胞的调控具有明确的谱系特异性,通过多层面机制抑制抗肿瘤免疫应答:
1. CD8⁺T细胞功能抑制:直接抑制CD8⁺T细胞的增殖活性,降低穿孔素、颗粒酶B等细胞毒性效应分子的表达水平;同时干扰CD8⁺T细胞的能量代谢过程与迁移能力,诱导其呈现耗竭表型(如PD-1、Tim-3等抑制性受体高表达),显著削弱其抗肿瘤杀伤功能。
2. Treg细胞扩增与功能强化:促进外周调节T细胞(Treg)的分化与扩增,增强Treg细胞的免疫抑制活性。Treg通过分泌IL-10、TGF-β等免疫抑制因子,形成局部免疫抑制微环境,进一步削弱效应T细胞与树突状细胞的功能,加剧免疫耐受。
3.Th细胞谱系转换调控:调控辅助性T细胞(Th细胞)的谱系分化,促进炎症性Th17细胞谱系形成,同时抑制Th1细胞谱系分化。该调控模式在增强局部炎症反应的同时,显著削弱细胞免疫功能,为肿瘤免疫逃逸创造条件。
(三)TGF-β的骨髓保护相关分子机制
除免疫调控功能外,TGF-β还具备潜在的骨髓保护特性。其核心机制在于维持HSC处于静止期,减少HSC在应激状态下的增殖消耗,从而避免化疗或放疗等治疗手段导致的骨髓过度抑制。而通过抑制TGF-β信号,可重新激活静止期HSC进入增殖活化状态,加速血液细胞的生成与恢复,为肿瘤治疗后的骨髓功能重建提供潜在的调控靶点。
四、结论
TGF-β通过复杂信号网络调控肿瘤进展,可激活CAF构建双重屏障、抑制T细胞功能并诱导免疫逃逸,是肿瘤恶性演进与免疫治疗抵抗的核心驱动因素。深入解析其信号传导及对CAF、T细胞的调控网络,是理解肿瘤免疫微环境重塑的关键。LabEx可提供多因子检测、流式分析、免疫组化等一站式技术服务,助力精准解析TGF-β信号调控节点,为开发靶向抑制策略、探索多靶点联合模式提供核心数据支撑,赋能相关抗肿瘤科研突破。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


