线粒体是真核细胞中高度保守的细胞器,传统认知中其核心功能是通过氧化磷酸化产生三磷酸腺苷(ATP),为细胞生命活动提供能量。近年来,随着分子生物学技术的发展,线粒体的非能量代谢功能逐渐被揭示,尤其在免疫与炎症调控领域的重要作用受到广泛关注。神经免疫炎症作为多种神经系统疾病(如阿尔茨海默病、帕金森病等)的核心病理环节,其发生发展与线粒体功能异常密切相关。线粒体通过多种分子机制调控免疫细胞活化、炎症因子释放及炎症信号传导,成为连接能量代谢与免疫炎症反应的关键枢纽。 同时,线粒体相关研究(如线粒体自噬、线粒体动力学、线粒体功能障碍等)已成为国家自然科学基金资助的热点方向,免疫与炎症相关项目持续占据资助重点地位。深入阐明线粒体调控免疫与炎症的分子机理,不仅有助于揭示相关疾病的发病本质,更为开发靶向线粒体的新型治疗策略提供了重要思路,具有重要的科学价值与临床意义。
一、线粒体:先天免疫信号的核心整合平台
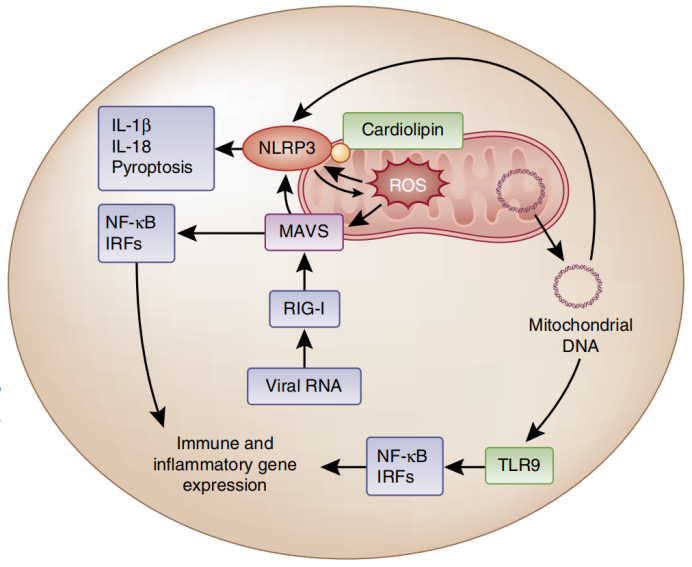
线粒体是先天免疫的信号平台
Subramanian N, Natarajan K, et al. The adaptor MAVS promotes NLRP3 mitochondrial localization and inflammasome activation. Cell. 2013 Apr 11;153(2):348-61.
先天免疫是机体抵御病原体入侵的第一道防线,线粒体通过整合多种免疫信号,成为先天免疫激活的关键平台。线粒体抗病毒蛋白MAVS(Mitochondrial Antiviral Signaling Protein)作为定位于线粒体外膜的核心接头蛋白,在抗病毒免疫中发挥关键作用:当病毒RNA感受器RIG-I(Retinoic Acid-Inducible Gene I)和MDA5(Melanoma Differentiation-Associated Protein 5)识别细胞内病毒RNA后,可诱导MAVS发生寡聚化,进而激活转录因子NF-κB(Nuclear Factor-κB)和IRFs(Interferon Regulatory Factors)信号通路,促进I型干扰素及抗病毒基因的表达,实现宿主防御[1]。 值得注意的是,线粒体活性氧(mtROS)可直接激活MAVS的寡聚化,不依赖病毒RNA识别即可诱导I型干扰素产生,形成独立的宿主防御途径。此外,MAVS还能直接促进NLRP3(NOD-Like Receptor Pyrin Domain-Containing Protein 3)炎症小体的组装,激活下游caspase-1信号通路,启动炎症反应。而NLRP3炎症小体的激活反过来会导致线粒体损伤和mtROS产生,线粒体内膜去极化后暴露的心磷脂进一步招募NLRP3,形成正向调控环路,凸显了线粒体在先天免疫信号网络中的核心地位。
二、线粒体调控免疫与炎症的关键分子机制
(一)线粒体DNA(mtDNA)释放
mtDNA作为损伤相关分子模式(DAMP),在 mitochondria 受损或细胞应激状态下会被释放到细胞质中,通过激活炎症小体(如NLRP3)诱导IL-1β、IL-18等炎症因子的产生,启动炎症反应。此外,释放的mtDNA还可通过cGAS-STING信号通路激活先天免疫,促进干扰素及促炎细胞因子的表达,参与免疫调控过程。
(二)活性氧(ROS)产生
线粒体是细胞内ROS的主要来源,mtROS作为重要的第二信使,参与NF-κB、MAPK等多条信号通路的调控。适量的mtROS可促进免疫细胞活化和炎症反应的启动,而过量的mtROS则会导致氧化应激损伤,加剧炎症反应和细胞凋亡。在神经免疫炎症中,mtROS的异常积累会诱发神经细胞损伤和炎症因子释放,推动疾病进展。
(三)线粒体动力学调控
线粒体的融合与分裂(即线粒体动力学)平衡对维持线粒体功能至关重要。线粒体融合由MFN1、MFN2等蛋白介导,可维持线粒体网络的完整性和功能稳定性;线粒体分裂则由DRP1等蛋白调控,参与受损线粒体的分离与清除。线粒体动力学异常会影响mtROS产生、mtDNA释放及细胞凋亡过程:分裂异常导致线粒体碎片化,促进mtROS生成和炎症激活;融合异常则降低线粒体功能,加剧细胞应激和炎症反应。
(四)线粒体自噬
线粒体自噬是选择性清除受损或功能失调线粒体的过程,通过维持线粒体质量和功能稳态,减少mtROS产生和mtDNA释放,从而抑制炎症反应。在免疫细胞中,线粒体自噬可调控免疫细胞的活化、增殖和凋亡,参与免疫应答的精细调控。当线粒体自噬功能异常时,受损线粒体累积会诱发持续的炎症反应,促进相关疾病的发生发展。
(五)线粒体生物发生
线粒体生物发生是新线粒体生成的过程,由PGC-1α等分子调控,可增加线粒体数量和改善线粒体功能,提高细胞能量代谢水平,从而增强免疫细胞的活性和炎症应答能力。适当的线粒体生物发生有助于机体抵御病原体入侵,而生物发生不足则会导致免疫功能低下,加剧炎症相关疾病的进展。
(六)其他调控机制
除上述机制外,线粒体还通过多种途径参与免疫与炎症调控:延胡索酸可诱导线粒体DNA的囊泡释放,激活RIG-I/MDA5-MAVS途径驱动先天免疫;LKB1-AMPK信号通路通过调节细胞能量代谢和线粒体功能,影响免疫细胞活化和炎症反应;此外,线粒体还可通过调控细胞代谢、钙离子稳态、内质网应激等过程,间接参与免疫与炎症调控。
三、线粒体在神经免疫炎症病理过程中的作用
神经免疫炎症的发生发展涉及神经细胞激活、炎症反应、细胞凋亡等多个环节,线粒体通过上述分子机制深度参与其中:
(一)调控 ROS 生成水平
作为 ROS 主要产生者,线粒体通过调节 mtROS 生成量影响炎症程度。过量 mtROS 引发氧化应激,导致神经细胞损伤及 TNF-α、IL-1β 等炎症因子释放,加剧病理进程;抑制其过度产生可减轻细胞损伤、缓解炎症。
(二)调节相关信号通路活化
NLRP3 炎症小体、NF-κB 等线粒体相关信号通路与神经免疫炎症密切相关,其异常活化会促进炎症因子释放和神经细胞凋亡,调控通路活化程度可为疾病治疗提供靶点。
(三)调控相关蛋白表达
MAVS、NLRP3、DRP1 等线粒体相关蛋白的异常表达会导致线粒体功能障碍和炎症激活,调节其表达可改善线粒体功能,减轻神经免疫炎症症状。
四、研究热点与应用前景
线粒体调控免疫与炎症的相关研究已成为生命科学领域的研究前沿,也是国家自然科学基金的重点资助方向。近年来,线粒体自噬、线粒体动力学、mtDNA释放机制、靶向线粒体的炎症调控等方向持续受到关注,相关研究成果为理解免疫炎症相关疾病的发病机制提供了重要突破。 在治疗应用方面,靶向线粒体的治疗策略已成为炎症相关疾病(尤其是神经免疫炎症疾病)的潜在治疗方向。通过调控线粒体功能(如激活线粒体自噬、抑制mtROS产生、调节线粒体动力学平衡)、干预线粒体相关信号通路(如NLRP3炎症小体通路、MAVS信号通路)、靶向线粒体DNA释放等方式,可实现对免疫炎症反应的精准调控,为相关疾病的治疗提供新的思路。此外,线粒体相关分子(如MAVS、NLRP3、mtROS等)也已成为潜在的药物靶点,相关抑制剂或激活剂的研发为疾病治疗提供了重要工具。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


