一、乳酸化修饰:连接代谢与表观遗传调控的新型蛋白质翻译后修饰
乳酸化修饰(lactylation),亦称赖氨酸乳酸化(KLa),是近年来新发现的一类蛋白质翻译后修饰。其生化本质为乳酸基与蛋白质赖氨酸残基的ε-氨基发生共价偶联,进而参与并调控基因表达。2019年10月24日,芝加哥大学赵英明教授团队在《自然》(Nature)期刊上发表了里程碑式研究成果“Metabolic regulation of gene expression by histone lactylation”。该研究首次报道在人及小鼠细胞内,组蛋白上存在特异的乳酸化修饰,并证实该修饰能直接调控染色质状态与基因转录活性。这一发现不仅开创了乳酸化修饰研究的先河,也为深入阐释“代谢‑表观遗传”交互调控网络提供了全新的分子视角。
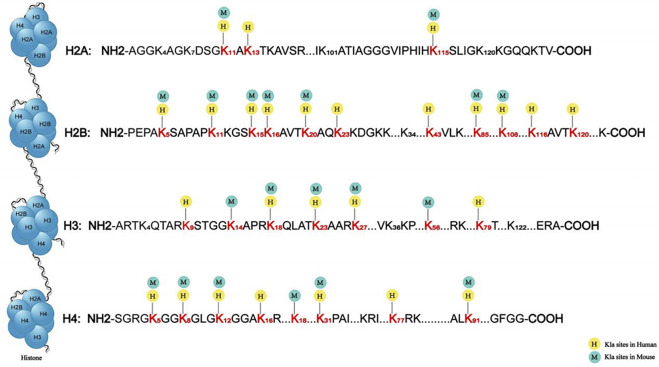
图1. 人类和小鼠的组蛋白乳酸化位点
近年来,围绕乳酸化修饰的高水平研究成果持续涌现,其生理与病理功能不断被揭示。同时,在国家自然科学基金等项目资助中,针对乳酸化修饰的相关课题数量亦呈显著增长趋势。目前,乳酸化修饰已成为生命科学与基础医学领域备受关注的前沿研究方向之一。
二、乳酸化修饰的生物学功能与疾病关联研究
(1)Warburg效应与组蛋白乳酸化的关联机制
Warburg效应的核心特征即细胞在有氧条件下仍维持高水平糖酵解,导致大量乳酸生成。近年研究表明,乳酸不仅作为代谢产物,还可通过诱导组蛋白发生乳酸化修饰,进而参与表观遗传层面的基因表达调控。这一发现提示,Warburg效应可能通过调控组蛋白乳酸化等表观遗传途径,影响疾病的发生发展。因此,组蛋白乳酸化修饰的阐明,为深入解析Warburg效应在肿瘤、免疫性疾病等病理过程中的分子机制提供了新视角,也为相关疾病的靶向干预策略开辟了潜在方向。
(2)组蛋白乳酸化修饰的动态调控
组蛋白乳酸化是一种在进化上保守、广泛存在且具有时空动态特征的蛋白质翻译后修饰。其修饰水平受到特定酶系统的精密调控,包括负责“写入”修饰的乳酸转移酶以及负责“擦除”修饰的去乳酸化酶。值得注意的是,部分已知的组蛋白乙酰转移酶(HAT)和组蛋白脱乙酰酶(HDAC)也被发现可能参与调控包括乳酸化在内的多种酰化修饰,提示了不同修饰类型间可能存在交叉调控网络。
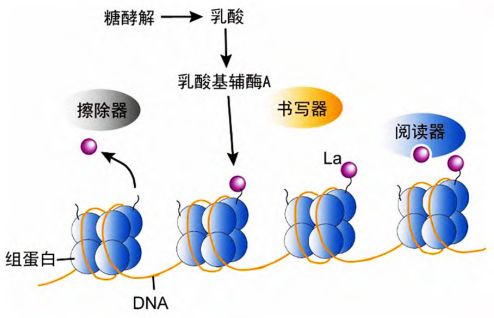
图2. 乳酸介导的组蛋白乳酸化
(3)组蛋白乳酸化在疾病发生发展中的作用
1. 肿瘤发生发展
在肿瘤表观遗传调控中,代谢物介导的组蛋白修饰是连接细胞代谢与基因表达的关键环节。组蛋白乳酸化作为其中重要的一种修饰形式,在肿瘤微环境塑造、免疫逃逸及细胞恶性转化等过程中发挥重要作用。研究表明,肿瘤细胞代谢重编程产生的乳酸可通过诱导特定组蛋白位点乳酸化,调控与肿瘤发生、发展相关基因的表达。
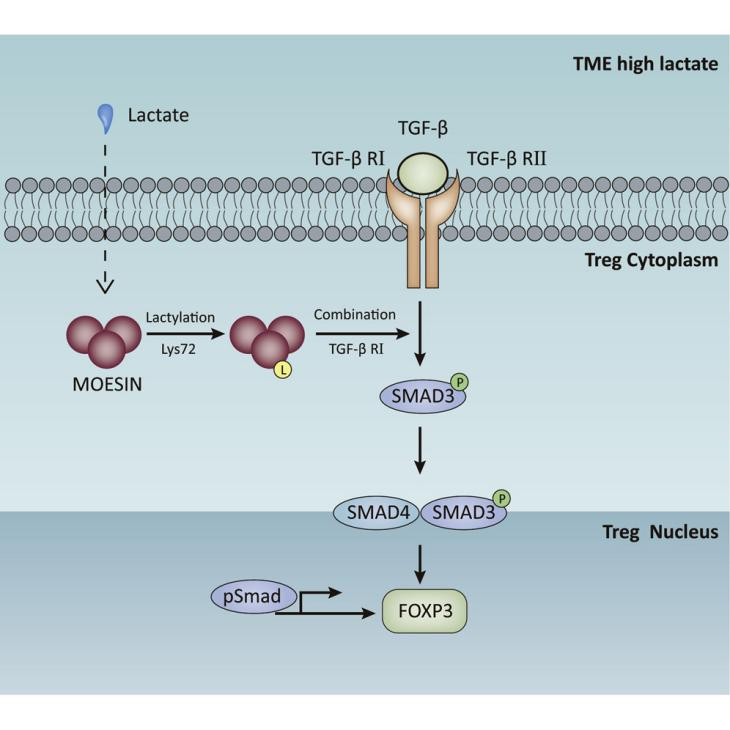
图3. 肿瘤代谢物乳酸通过调节MOESIN乳酸化和增强调节性T细胞中的TGF-β信号传导来促进肿瘤发生
2. 肺部疾病
研究显示,细胞代谢异常与多种肺部疾病的病理进程密切相关。在肺纤维化、肺动脉高压等疾病中,肺成纤维细胞、平滑肌细胞及内皮细胞的糖酵解活性异常增强是关键驱动因素。这种增强的糖酵解不仅导致三羧酸循环紊乱和能量代谢异常,亦引起乳酸蓄积,进而通过诱导组蛋白乳酸化等表观遗传改变,促进细胞增殖、迁移等病理表型。
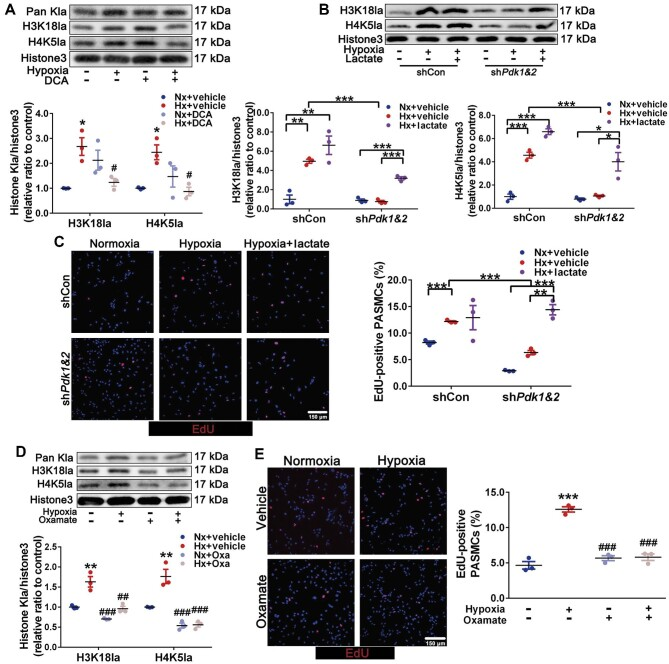
图4. 乳酸蓄积诱导的组蛋白乳酸化促进肺动脉平滑肌细胞增殖
3. 免疫调控
巨噬细胞在天然免疫中具有高度可塑性,其功能状态可在促炎与抗炎/修复表型间转换,这一过程对维持免疫稳态至关重要。近年研究发现,代谢重编程及其衍生的乳酸可通过调控组蛋白乳酸化,影响巨噬细胞极化相关基因的表达,从而调控其从促炎状态向修复状态的转变,在炎症调控与组织修复中扮演重要角色。
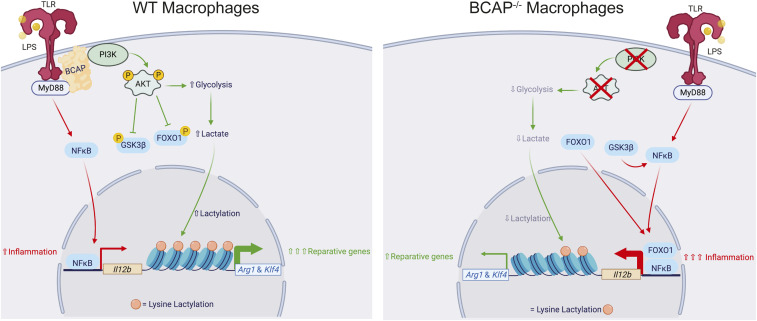
图5. TLR信号适配器BCAP通过促进组蛋白乳酸化调节炎症向修复性巨噬细胞的转变
三、研究总结与未来展望
组蛋白乳酸化作为一种新型的蛋白质翻译后修饰,其生理与病理功能及调控机制的深入解析,对于全面理解包括肿瘤在内的多种疾病的发生与发展具有重要意义。当前研究虽已初步揭示乳酸化修饰在肿瘤生物学、免疫调控及肺部疾病等领域的复杂作用,然而该研究方向整体仍处于早期阶段,诸多关键科学问题亟待阐明。未来研究需进一步揭示乳酸化修饰的特异性“写入”、“擦除”及“识别”酶系统,明确其在细胞与机体层面的动态调控网络,并深入探索其作为疾病诊断标志物或治疗靶点的转化潜力。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


