一、技术原理与应用概述
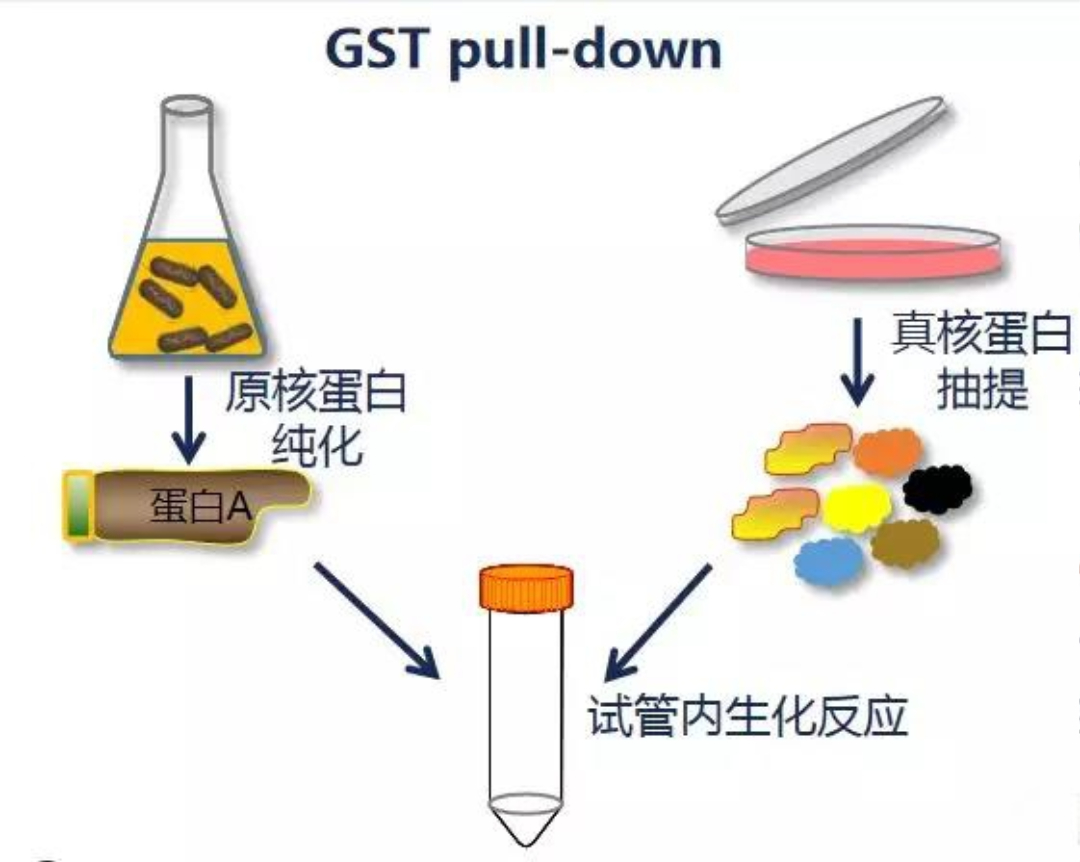
GST pull-down技术是一种广泛应用于体外的蛋白质相互作用研究方法。该技术首先通过将含有谷胱甘肽S-转移酶(GST)标签的融合蛋白固定在谷胱甘肽琼脂糖珠表面,形成亲和介质;随后与含有潜在互作蛋白的细胞裂解液共同孵育,使目标蛋白特异性结合于固化相。经过多次洗涤去除非特异性结合成分后,利用洗脱步骤收集与GST融合蛋白相互作用的蛋白质复合物。所得产物可通过Western Blot对已知互作关系进行验证,或借助质谱分析鉴定未知相互作用蛋白。
由于其实验流程相对简便、检测灵敏度较高,GST pull-down技术已被广泛视为验证酵母双杂交等遗传学筛选结果的重要体外实验手段。近年来,随着蛋白质组学与功能蛋白质研究的不断深入,该技术在蛋白质互作网络解析及功能机制研究中的应用日益广泛,并持续受到学术界的重视。
二、GST Pull-down技术的原理与实现机制
Pull-down技术作为一种经典的体外蛋白质相互作用研究方法,其核心在于将作为"诱饵"的目标蛋白固定在固相基质(如琼脂糖凝胶)上。当含有潜在互作蛋白的细胞提取液流经该基质时,能够与固相化"诱饵"蛋白特异性结合的配体蛋白(即"捕获蛋白")将被吸附保留,而非特异性结合的蛋白质则通过洗涤步骤被有效去除。随后,通过改变洗脱条件(如pH、离子强度或竞争性配体),可将特异性结合的蛋白复合物回收,进而用于后续分析。该技术不仅可用于验证已知蛋白质间的相互作用,还可用于从复杂生物样品或体外表达系统中鉴定新的互作蛋白。
为提高实验的特异性和效率,常将目标"诱饵"蛋白与易于纯化的标签蛋白进行融合表达。其中,谷胱甘肽S-转移酶(GST)融合系统因其操作简便、纯化条件温和而被广泛应用。该系统基于GST与谷胱甘肽(GSH)间的高亲和力相互作用:首先将GST融合蛋白固定在偶联有GSH的琼脂糖树脂上,形成稳定的亲和界面;随后使含有待测蛋白的溶液流经该树脂,"诱饵"蛋白即可捕获溶液中与之相互作用的蛋白质。
具体而言,GST pull-down技术通过谷胱甘肽亲和树脂固化GST融合蛋白,使其作为"诱饵"固定相。当含有目的蛋白的样品(如细胞裂解液、纯化蛋白或体外翻译产物)与树脂共同孵育后,与"诱饵"特异性结合的"捕获蛋白"将被保留在树脂上。经过充分洗涤去除非特异性结合成分,洗脱得到的复合物可通过SDS-PAGE及Western Blot进行分析,以验证已知相互作用或利用质谱等技术筛选未知互作蛋白。该系统具有兼容性广的特点,"诱饵"与"捕获"蛋白均可来源于多种体系,包括细胞裂解物、重组纯化蛋白或体外转录翻译系统,为蛋白质相互作用研究提供了灵活可靠的技术平台。
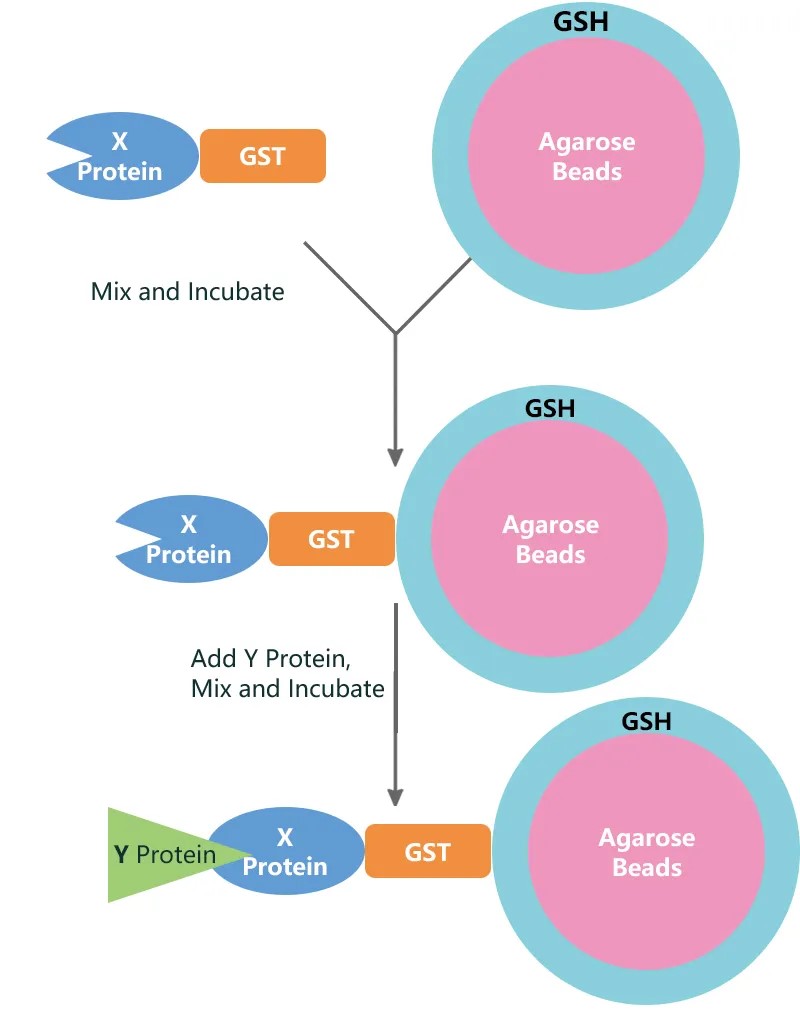 图1.GST pull down实验原理
图1.GST pull down实验原理
三、GST Pull-down实验操作流程
本实验通常采用将抗体预先与蛋白A/G琼脂糖珠偶联的方式进行,该方法虽然最终得率相对较低,但能够有效避免抗体在洗脱过程中与目标蛋白共洗脱的问题。若实验目标旨在获取高纯度目的蛋白,且允许抗体共同洗脱时,亦可选择将抗体与蛋白样品先行孵育,再加入蛋白A/G琼脂糖珠,但需注意该方法可能因抗体共洗脱而对后续Western Blot检测产生干扰。实验流程主要涵盖以下三个关键部分:
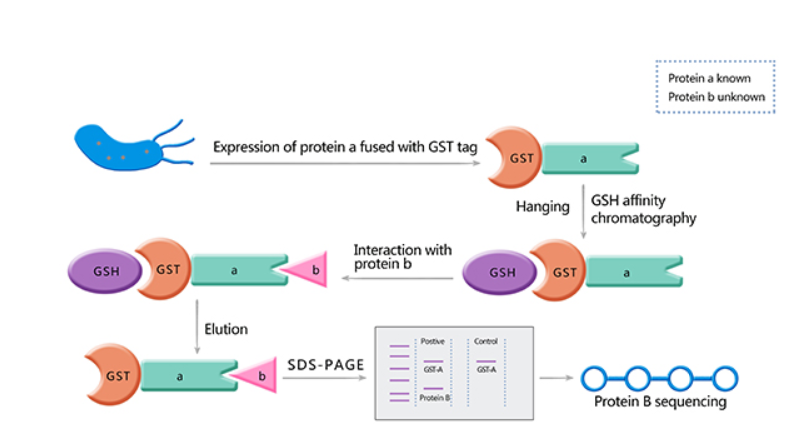
步骤一:GST融合蛋白的制备
👉将目标蛋白的特定结构域或完整编码序列克隆至GST融合表达载体
👉将重组表达载体转化至适宜的大肠杆菌表达菌株
👉在含有相应抗生素的LB培养基中扩大培养,并进行诱导表达
👉收集菌体,通过超声破碎或化学裂解等方式制备细胞裂解液,获取可溶性GST融合蛋白
步骤二:细胞裂解液的制备
👉选用适宜的细胞裂解缓冲液(如PBS或RIPA缓冲液)
👉在裂解缓冲液中加入蛋白酶抑制剂及磷酸酶抑制剂,以维持蛋白质的天然状态及修饰完整性
步骤三:GST Pull-down实验操作
👉将纯化的GST融合蛋白与谷胱甘肽琼脂糖树脂在适宜条件下孵育,使其固相化
👉将制备的细胞裂解液与上述树脂在低温下充分孵育,促使目标蛋白与GST融合蛋白特异性结合
👉使用洗涤缓冲液多次清洗树脂,彻底去除非特异性吸附的杂蛋白
👉采用含还原型谷胱甘肽的洗脱缓冲液或直接加入SDS上样缓冲液,将互作蛋白复合物从树脂上洗脱
👉收集洗脱产物,通过SDS-PAGE、Western Blot或质谱分析等技术进行后续检测与鉴定
该实验流程系统性强,可广泛应用于蛋白质相互作用的验证与筛选研究,为后续功能机制解析提供实验依据。
四、GST Pull-down技术的优势与局限性分析
技术优势
✔️直接互作鉴定能力:该技术能够捕获与"诱饵"蛋白直接发生相互作用的蛋白质,有助于区分直接结合与通过大型复合物产生的间接关联。
✔️提升蛋白可溶性:GST标签具有较好的溶解性,可与目的蛋白形成融合蛋白,常能改善部分难溶性蛋白的表达状态,从而简化纯化与互作实验的操作流程。
✔️高亲和性与高纯度:谷胱甘肽(GSH)与GST之间的相互作用具有高亲和力与高特异性,基于GSH树脂的纯化过程洗脱条件相对温和,有助于获得纯度较高的互作蛋白复合物。
技术局限性
✔️存在假阳性可能:在体外非生理条件下,两个在细胞内空间定位不同的蛋白可能因电荷吸引、疏水作用或非特异性强吸附而发生结合。因此,实验结果通常需通过免疫共沉淀(Co-IP)等细胞内验证方法进行二次确认。
✔️体外系统的固有局限:实验过程在细胞裂解液或纯化蛋白体系中进行,脱离了完整的细胞环境与动态调控网络,可能无法完全模拟细胞内真实的蛋白质互作状态、翻译后修饰及亚细胞定位效应。
✔️标签潜在的结构干扰:GST标签分子量较大(约26 kDa),其融合表达可能改变目的蛋白的天然构象、折叠动力学或局部结构,从而影响其互作特性,导致假阴性或假阳性结果。
五、总结
综上所述,GST Pull-down技术是一种高效、特异的体外蛋白质相互作用研究工具,尤其在初步筛选与直接互作验证中具有重要价值。然而,鉴于其技术原理与操作体系的固有特点,研究者需审慎解读实验结果,并结合体内实验及其他互补技术进行综合验证,以得出更为可靠的科学结论。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


