免疫系统的功能平衡是机体维持健康的核心前提——既要高效识别并清除外来病原体,又需严格避免对自身组织产生异常免疫攻击。长期以来,免疫领域科研聚焦于效应性免疫细胞的抗感染机制,而对免疫系统的“自我约束”机制认知有限。2025年诺贝尔生理学或医学奖的颁布,使Treg这一关键调控细胞成为科研焦点。Treg通过独特的分子机制,在介导外周免疫耐受、调控炎症反应阈值、维持肠道微生态免疫平衡等基础生物学过程中发挥核心作用。其发现不仅揭示了免疫平衡的核心分子密码,更为解析免疫相关疾病的病理机制提供了全新的科研靶点。
一、Treg的核心免疫调控机制研究
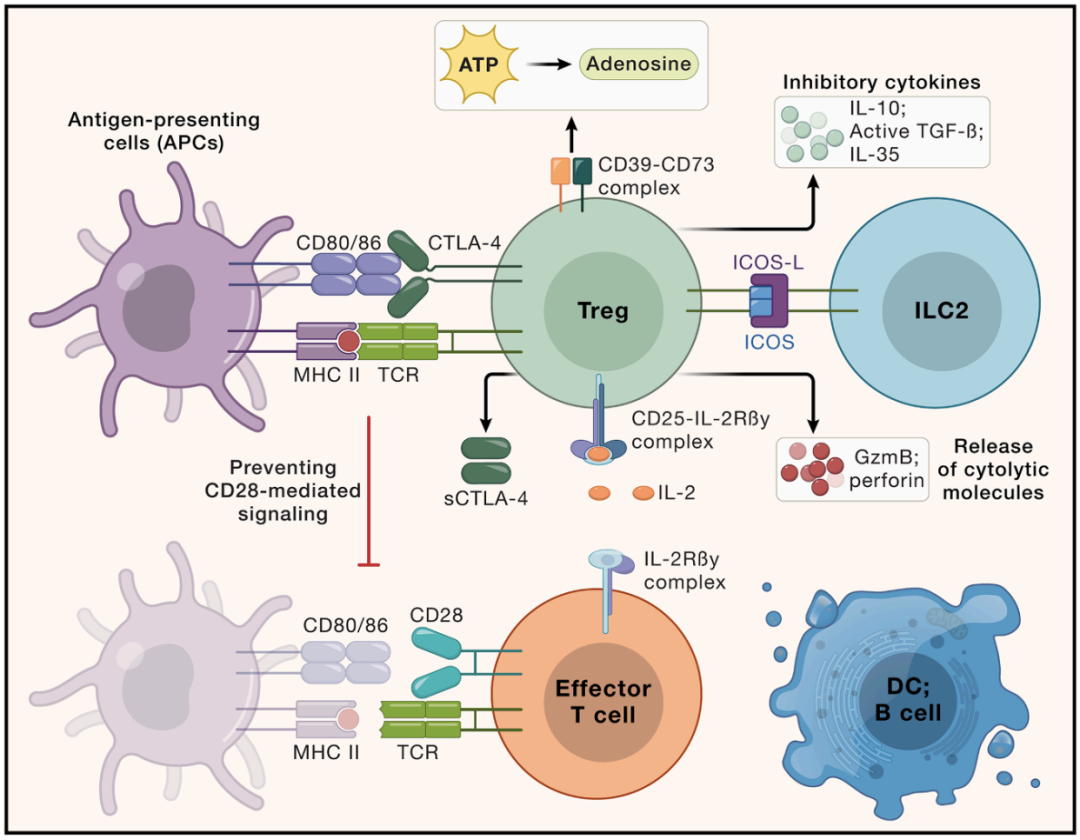
Treg 细胞通过直接的细胞间接触以及调节可溶性因子来抑制适应性免疫反应和先天免疫反应
Zou C, Li P, et al. Next steps in regulatory T cells: Biology and clinical application. Cell. 2026 Jan 8;189(1):6-22.
(一)自身免疫耐受的分子调控:阻止免疫“内讧”的核心机制
机体免疫系统每日需完成数十亿细胞的识别与排查,其中自体反应性T细胞可能因抗原识别信号异常,将肾脏细胞、胰岛细胞等自身组织误认为病原体,引发自身免疫攻击。科研证实,Treg通过双重分子机制维持自身免疫耐受:
1. 抗炎信号介导的抑制机制:Treg可分泌IL-10、IL-35等抗炎细胞因子,通过与自体反应性T细胞表面的受体结合,启动下游免疫抑制信号通路,抑制其活化与增殖,从而阻断异常免疫攻击的启动;
2. 营养竞争介导的清除机制:Treg高表达CD25分子,可竞争性摄取环境中有限的IL-2——作为T细胞活化增殖的必需细胞因子,IL-2的剥夺使异常活化的自体反应性T细胞因营养匮乏而发生凋亡或功能失活;
3. 预先筛选与清除机制:Treg通过表达特异性识别受体,可主动识别并结合可能发生“叛变”的自体反应性T细胞,通过直接接触介导的细胞毒性作用或招募其他免疫抑制细胞,实现对异常细胞的精准清除,从根源上降低自身免疫病发生风险。这一机制的发现,颠覆了传统对免疫耐受的认知,为解析自身免疫病的发病机制提供了关键理论依据。
(二)炎症反应的精准调控:平衡防御与损伤的分子网络
炎症是机体应对创伤、感染的基础防御反应,但其持续过度激活会导致健康组织损伤。科研表明,Treg作为炎症反应的“分子调节器”,通过多重机制调控炎症强度:
1. 转化生长因子β(TGF-β)介导的炎症抑制:Treg分泌的TGF-β可直接结合炎症细胞(如巨噬细胞、嗜酸性粒细胞)表面的受体,抑制其促炎因子(如TNF-α、IL-6)的分泌,同时阻断炎症细胞的过度增殖,实现对炎症反应的“降温”;
2. 组织修复的调控机制:Treg可通过分泌趋化因子,招募皮肤成纤维细胞、血管内皮细胞等修复相关细胞向损伤部位迁移,加速伤口愈合;同时,Treg可抑制过度的纤维化反应,减少疤痕组织形成。相关科研数据显示,Treg活性缺失的模型动物,伤口愈合速度显著减慢30%以上,且疤痕组织增生明显;
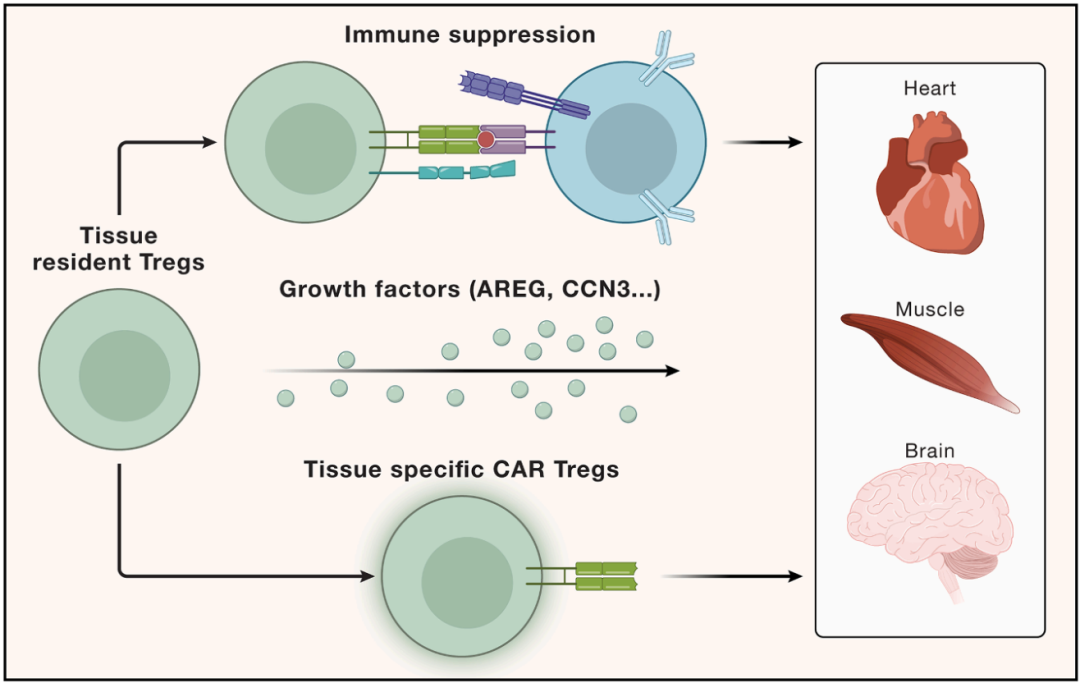
Treg 细胞促进组织修复和再生
Zou C, Li P, et al. Next steps in regulatory T cells: Biology and clinical application. Cell. 2026 Jan 8;189(1):6-22.
3. 局部免疫微环境的重塑:Treg可穿透呼吸道、肠道等黏膜屏障,在局部组织中富集并调节免疫微环境,通过调控黏膜上皮细胞的屏障功能、抑制免疫细胞的异常浸润,维持黏膜组织的免疫稳态,为解析慢性炎症的病理机制提供了重要研究方向。
(三)肠道微生态的免疫平衡:辨友识敌的分子机制
人体肠道内定植的上万亿微生物构成复杂的微生态系统,其中包含益生菌、潜在致病菌及外来食物蛋白,其免疫平衡的维持依赖Treg的精准调控。科研揭示,Treg通过以下分子机制实现肠道免疫稳态:
1. 微生物识别与选择性调控:Treg表达特异性模式识别受体,可精准区分肠道内的益生菌(如双歧杆菌、乳酸菌)与致病菌(如沙门氏菌、大肠杆菌)。对致病菌,Treg可招募效应T细胞、巨噬细胞等进行特异性清除;对益生菌,Treg则分泌营养因子(如短链脂肪酸受体激动剂),促进其在肠道黏膜的定植繁殖,维持肠道菌群平衡;
2. 食物蛋白的免疫耐受机制:Treg可通过摄取并呈递食物中的外来蛋白(如牛奶酪蛋白、鸡蛋卵清蛋白),向免疫系统传递“无害信号”,诱导免疫细胞对其产生特异性耐受,避免过敏反应发生。科研证实,Treg功能缺陷的模型动物,肠道黏膜对食物蛋白的免疫反应显著增强,易引发过敏性炎症。这一机制的发现,为解析肠道微生态与免疫系统的相互作用提供了关键分子靶点。
二、Treg相关的科研突破与研究方向
(一)免疫调控网络的解析
目前,科研已明确Treg与其他免疫细胞(如效应T细胞、B细胞、树突状细胞)之间存在复杂的信号交互网络。例如,Treg通过表达CTLA-4分子,可竞争性结合树突状细胞表面的CD80/CD86分子,阻断其向效应T细胞传递活化信号;同时,树突状细胞分泌的IL-12可反向调控Treg的功能活性。这些信号通路的解析,为构建完整的免疫调控网络模型提供了重要基础。
(二)疾病相关的Treg功能异常机制研究
在自身免疫病、慢性炎症、肠道相关疾病等病理状态下,Treg的数量、活性或功能存在显著异常。科研发现,类风湿关节炎患者外周血中Treg的IL-10分泌水平显著降低,而炎症性肠病患者肠道黏膜中Treg的趋化能力缺陷。通过基因测序技术,已鉴定出多个与Treg功能相关的易感基因,其突变或表达异常可能导致Treg调控功能受损,为解析疾病的遗传易感机制提供了重要线索。
(三)Treg的可塑性与调控机制研究
最新科研证实,Treg具有一定的功能可塑性——在特定炎症微环境下,部分Treg可丧失免疫抑制功能,转化为具有促炎活性的效应样细胞,这一过程与转录因子的表观遗传调控密切相关。解析Treg可塑性的分子机制,可为干预免疫相关疾病的病理进程提供全新思路,目前已成为免疫领域的研究热点。
三、Treg细胞因子检测服务哪个公司有
调节性T细胞(Treg)作为免疫系统的“核心调控单元”,其介导的外周免疫耐受机制揭示了免疫平衡的分子密码,通过精准调控自身免疫耐受、炎症反应及肠道微生态平衡,成为连接先天免疫与适应性免疫的关键枢纽。目前Treg基础科研已取得突破性进展,其分子调控机制解析为免疫领域研究提供全新理论框架,未来随着对其生物学功能的深度探索及科研技术革新,Treg有望成为解析免疫相关疾病病理机制的核心靶点。LabEx可提供单细胞测序、流式检测、多因子分析、空间多组学及免疫组化等一站式技术服务,助力精准解析Treg的异质性特征、分子调控网络及组织微环境互作机制,为免疫调控机制研究、疾病病理机制解析提供核心数据支撑,赋能免疫领域基础科研持续突破。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


