血管内皮生长因子(VEGF)及其受体(VEGFR)构成的信号通路是调控血管生成与血管通透性的核心分子网络,在胚胎发育、组织修复等生理过程中发挥基础性作用,同时也是病理性血管生成的关键驱动因素。
一、VEGF家族成员的分子特征与功能特异性
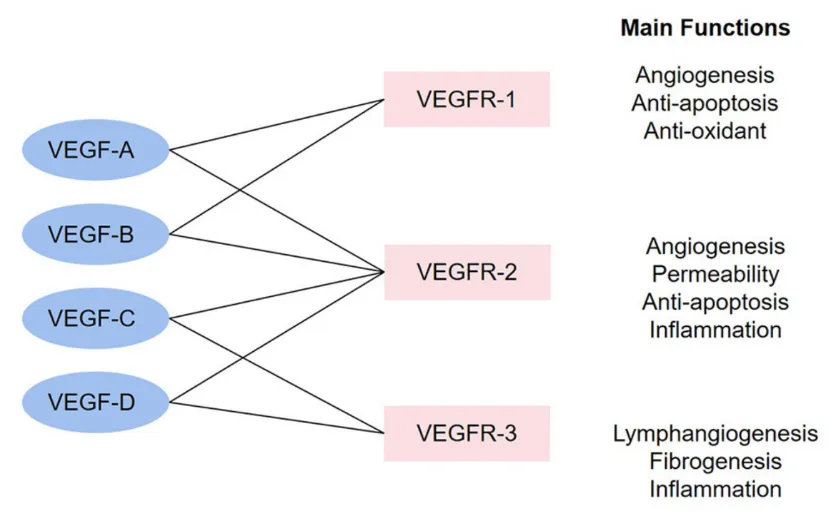
VEGF家族成员的组合及其主要功能
Zhou Y, Zhu X,et al. The Role of the VEGF Family in Coronary Heart Disease. Front Cardiovasc Med. 2021 Aug 24;8:738325.
VEGF 家族包含 VEGF-A、VEGF-B、VEGF-C、VEGF-D 及胎盘生长因子(PlGF)等关键成员,各成员通过结构特异性与功能分工共同调控血管系统的发育与稳态。
1. 核心成员组成:包括VEGF-A、VEGF-B、VEGF-C、VEGF-D及胎盘生长因子(PlGF)。
2. 各成员功能分工:
VEGF-A:经典核心成员,主导血管新生与血管通透性增加,是生理/病理性血管生成的关键驱动因子。
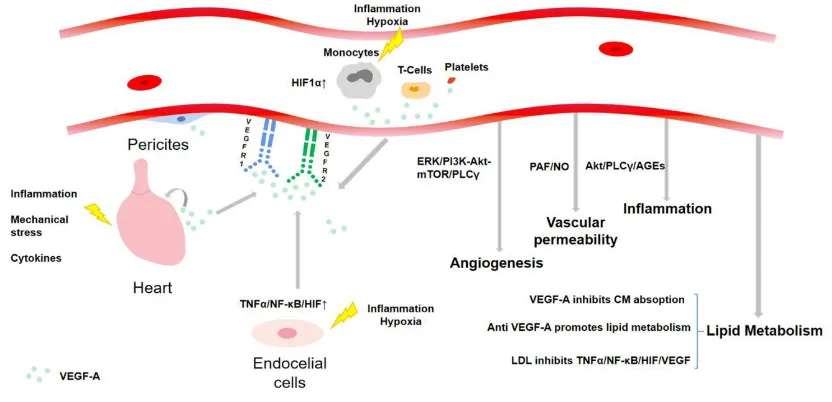
VEGF-A的来源及功能调控机制
Zhou Y, Zhu X,et al. The Role of the VEGF Family in Coronary Heart Disease. Front Cardiovasc Med. 2021 Aug 24;8:738325.
VEGF-B:参与心血管保护及脂质代谢调控,与VEGFR-1结合调节心肌能量代谢。
VEGF-C/D:特异性调控淋巴管生成,通过结合VEGFR-3参与淋巴管发育与重构。
PlGF:在炎症、肿瘤微环境中表达,协同VEGF-A增强促血管生成效应。
3. 功能特异性基础:源于与不同VEGFR亚型的结合亲和力差异及下游信号激活效率区别。
二、VEGFR家族的结构特征与信号激活机制
1. 家族亚型与共性结构:
主要亚型:VEGFR-1(Flt-1)、VEGFR-2(KDR/Flk-1)、VEGFR-3(Flt-4)。
共性结构:含7个细胞外免疫球蛋白样结构域、跨膜结构域、膜邻接区、2个酪氨酸激酶结构域、激酶插入区及C末端结构域。
2. 各亚型激活特点:
VEGFR-1:高配体结合亲和力,低激酶活性,作为“信号调控器”或“陷阱受体”调控VEGFR-2激活效率。
VEGFR-2:介导血管生成核心效应,配体结合后诱导二聚化与自磷酸化,启动下游信号。 - VEGFR-3:主要表达于淋巴管内皮细胞,结合VEGF-C/D后调控淋巴管发育与功能。
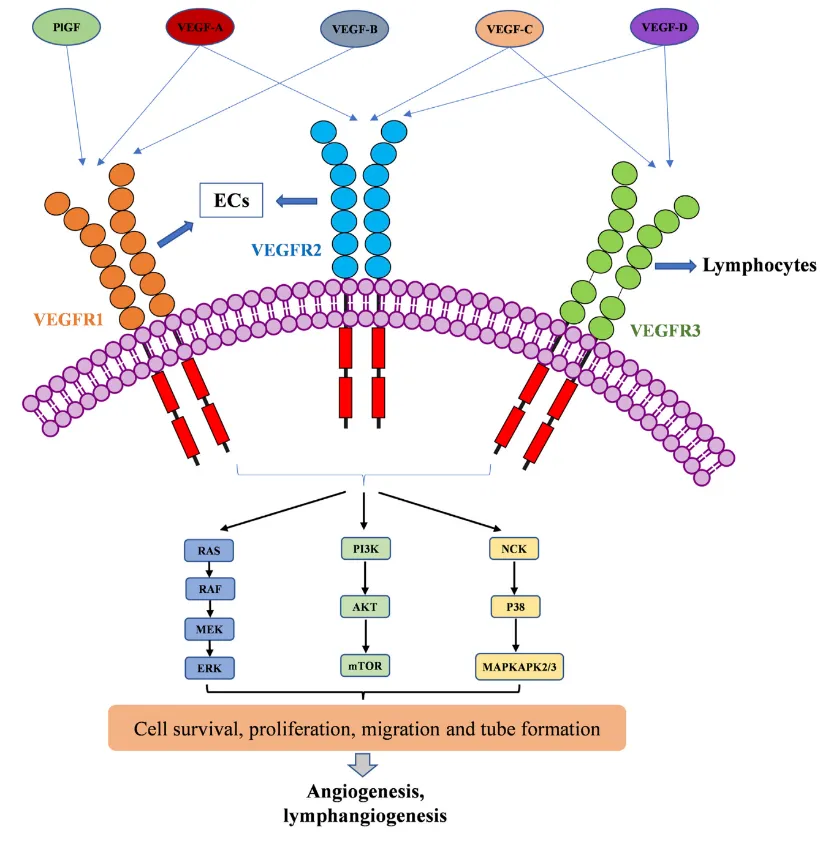
VEGF 家族生长因子激活 VEGFR;并导致下游血管生成和淋巴管生成的信号通路
Wang L, Liu WQ, et al. Recent advances of anti-angiogenic inhibitors targeting VEGF/VEGFR axis. Front Pharmacol. 2024 Jan 4;14:1307860.
3. 共受体调控:
神经纤毛蛋白(NRP-1/2)可与VEGFR形成复合物,增强配体结合亲和力与信号特异性。
三、VEGF/VEGFR通路的下游信号转导网络
VEGFR-2 作为血管生成信号传导的核心枢纽,激活后可启动多条相互关联的下游信号通路,通过复杂的交叉调控与反馈机制,精确调控内皮细胞的生物学功能。
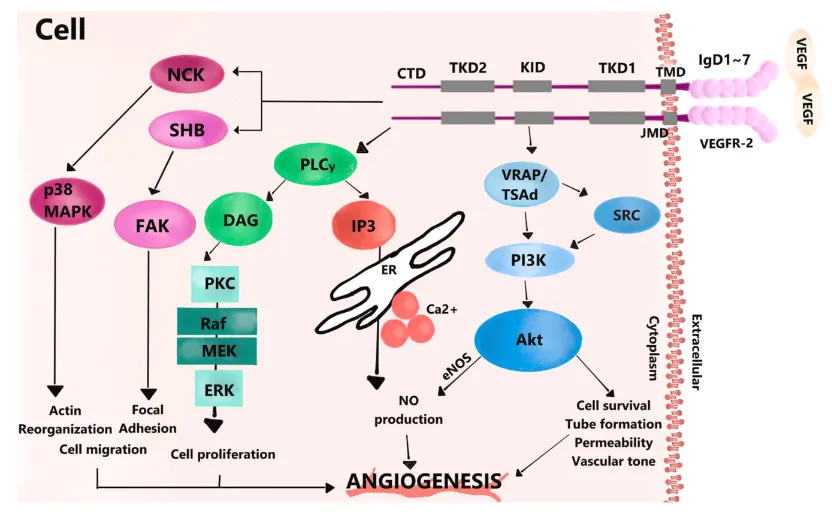
VEGFR-2的信号通路
Lorenc P, Sikorska A, et al. Physiological and tumor-associated angiogenesis: Key factors and therapy targeting VEGF/VEGFR pathway. Biomed Pharmacother. 2024 Nov;180:117585.
1. PI3K/Akt/eNOS通路:
激活路径:VEGFR-2→TSAd适配蛋白→PI3K→Akt活化。
核心功能:抑制内皮细胞凋亡、促进存活;增强eNOS活性,生成NO以调节血管舒张与通透性。
2. PLCγ/IP3/DAG与Raf/MEK/ERK通路:
PLCγ/IP3/DAG:水解PIP2生成IP3(促胞内Ca²⁺释放)与DAG(激活PKC)。
Raf/MEK/ERK:由PKC启动,通过磷酸化级联反应驱动内皮细胞增殖与血管分支形成。
3 .FAK/p38 MAPK通路:
适配蛋白SHB/NCK介导激活,调控细胞与基质黏附动态及细胞骨架重塑,促进内皮细胞定向迁移。
4. Rho家族GTP酶通路:
经PI3K间接激活,RhoA、Rac1、Cdc42协同调控细胞骨架重排,保障血管腔形成与分支建构。
四、VEGF/VEGFR通路的生理调控与病理激活机制
(一)生理功能
1. 胚胎发育:主导血管发生与血管生成,构建原始血管网络并完成成熟重构。
2. 成年个体:参与组织修复、伤口愈合、子宫内膜周期性重建,维持血管稳态。
3. 核心作用:精准调控内皮细胞增殖、迁移与管腔形成,保障血管结构完整与功能正常。
(二)病理激活机制
1. 肿瘤相关:
① 缺氧诱导HIF-1α上调,促进VEGF表达,协同FGF-2、PDGF等因子诱导内皮细胞活化。 - 内皮祖细胞动员、周细胞脱离、TAMs介导的ECM重塑,共同推动肿瘤血管生成。
② 肿瘤血管呈现结构紊乱、通透性强等特征,加剧肿瘤进展。
2. 其他疾病:
视网膜病变:VEGF过量表达引发异常血管新生与渗漏,破坏视网膜结构。
类风湿性关节炎:促进滑膜血管增生,加重炎症反应。
五、总结与科研展望
VEGF/VEGFR信号通路作为血管生成的核心调控网络,其分子机制的深入解析是相关疾病基础研究与靶向干预的关键。当前虽在家族功能、信号转导等方面取得显著进展,但仍有诸多科学问题亟待探索,如VEGF异构体功能特异性、共受体调控机制、通路交叉对话等。
LabEx作为专业的科研技术服务平台,可为此类研究提供全方位支持:依托多因子检测、流式细胞术、免疫组化等多技术平台,精准检测VEGF家族配体、VEGFR受体及下游信号分子(如Akt、ERK、eNOS等)的表达与活性;提供定制化实验方案设计、样本处理、数据解析等一体化服务,助力研究者高效验证通路激活状态、探索调控机制及疾病关联研究。借助LabEx的技术支撑,可加速VEGF/VEGFR通路的科研突破,为相关疾病的基础研究与转化医学应用提供有力保障。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


