简介
染色质免疫沉淀(ChIP)技术,是表观遗传学研究里的 “明星方法”,能快速锁定蛋白质和 DNA 的结合位点,揭开二者互作的神秘面纱。
染色质免疫沉淀(ChIP)技术,是表观遗传学研究里的 “明星方法”,能快速锁定蛋白质和 DNA 的结合位点,揭开二者互作的神秘面纱。
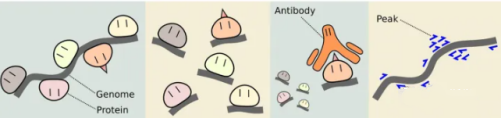
这项技术的底层逻辑是抗原抗体的特异性识别:用特定抗体 “钓取” 目标 DNA 结合蛋白,同时把它结合的 DNA 片段一起富集起来,最终就能在全基因组层面,搞清楚细胞或组织里蛋白质和 DNA 到底是怎么 “互动” 的。
技术原理
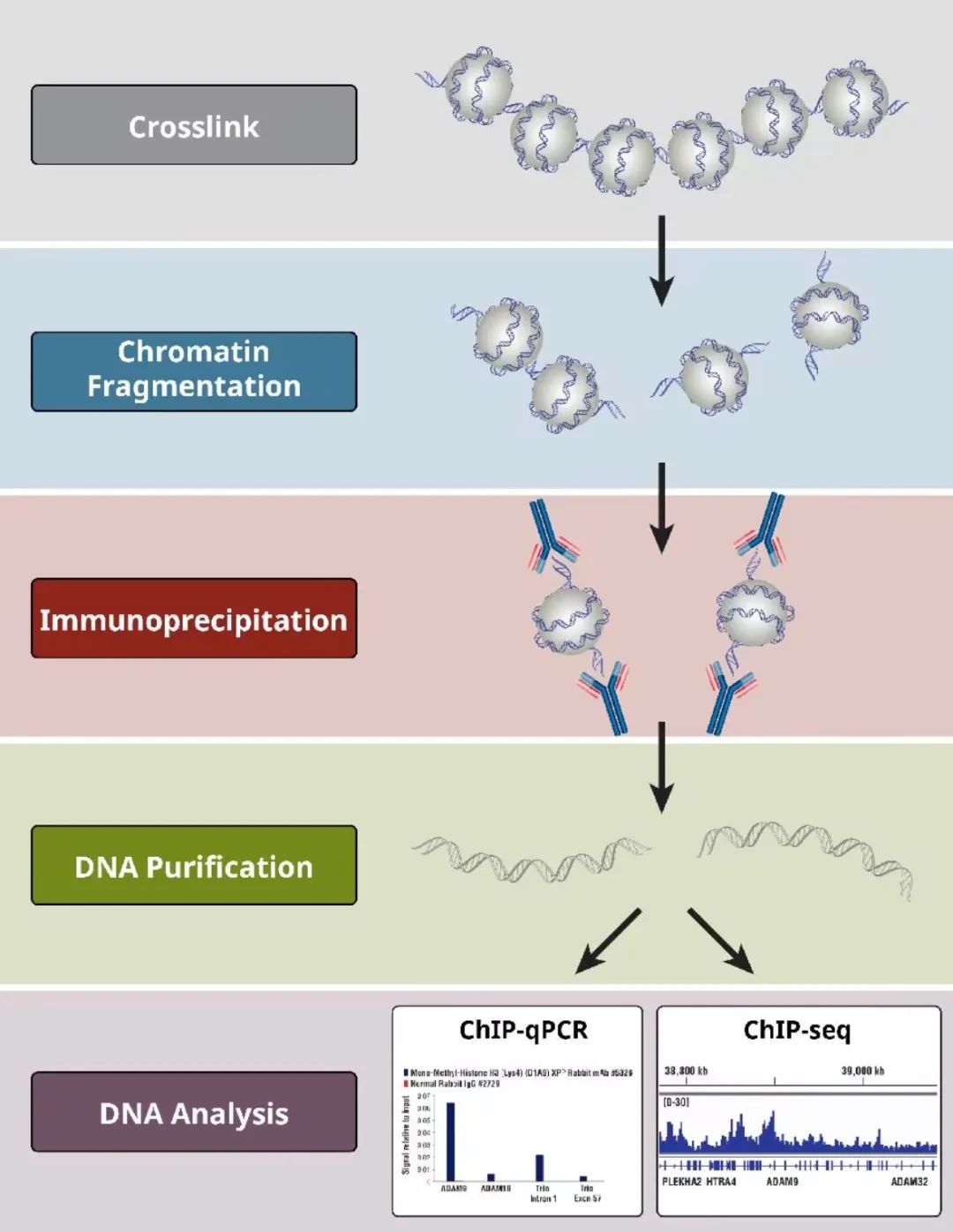
ChIP 技术的关键在于 “锁住” 蛋白质和 DNA 的真实结合状态:先在细胞正常生长的条件下,用化学试剂把 DNA 和结合在上面的蛋白质 “粘” 在一起,避免后续操作中二者分离;接着用超声或酶把缠结的染色质剪成小段,方便后续精准筛选;再用专门识别目的蛋白的抗体,把 “蛋白 - DNA” 复合物 “抓” 出来,实现特异性富集。
ChIP 技术的关键在于 “锁住” 蛋白质和 DNA 的真实结合状态:先在细胞正常生长的条件下,用化学试剂把 DNA 和结合在上面的蛋白质 “粘” 在一起,避免后续操作中二者分离;接着用超声或酶把缠结的染色质剪成小段,方便后续精准筛选;再用专门识别目的蛋白的抗体,把 “蛋白 - DNA” 复合物 “抓” 出来,实现特异性富集。
整个实验要经过细胞固定、染色质剪碎、免疫沉淀、解除交联、DNA 提纯、DNA 检测这几步。不过因为步骤多、每一步的操作细节都容易影响结果,所以做实验时一定要设置对照,而且得结合经验判断结果是否可靠,这样才能避免实验白做。
研究意义
核酸与蛋白质作为生命活动的核心生物大分子,二者之间的动态相互作用是调控各类生命进程的基础,贯穿细胞生长、增殖、分化、遗传信息传递及代谢稳态维持等关键生理过程。深入解析蛋白质与核酸的互作机制,是揭开生命现象本质、阐明疾病发生发展分子机理的核心突破口。而染色质免疫沉淀(ChIP)技术,凭借其能在生理状态下捕获蛋白质与DNA天然结合状态的优势,成为表观遗传学及分子生物学领域中,研究蛋白质-DNA互作关系、挖掘基因表达调控网络的核心工具,为疾病机制研究、药物靶点筛选等提供了重要技术支撑。
实验材料
一、核心器材
静音混合器、高速低温离心机、超声破碎仪、电泳仪、水平电泳槽、普通PCR仪、实时荧光定量PCR仪(Real-time PCR仪)。
二、试剂与耗材
1. 细胞样本:HeLa细胞;
2. 缓冲液及基础试剂:HEPES、NaCl、KOH、HCl、Triton X-100、NP-40、十二烷基硫酸钠(SDS)、NaHCO₃、去氧胆酸钠、乙二胺四乙酸(EDTA)、Tris缓冲液、蛋白酶抑制剂混合物、蛋白酶K;
3. 免疫沉淀相关试剂:Protein A/G磁珠(预结合鲑精DNA封闭);
4. 对照及检测试剂:GAPDH对照引物、阳性对照抗体(乙酰化组蛋白H3抗体,Anti-Acetyl Histone H3)、阴性对照抗体(正常家兔IgG,Normal IgG);
5. 核酸检测试剂:琼脂糖、PCR反应Mix、SYBR Green qPCR Mix。
三、实验步骤
ChIP实验核心流程可分为试剂配制、细胞固定、染色质断裂、免疫沉淀等关键环节,其中试剂配制与细胞固定是保障实验成功的基础,具体操作如下:
(一)试剂配制
所有缓冲液需提前配制并调节至对应pH值,蛋白酶抑制剂需临用前新鲜加入,避免酶解目标蛋白,具体配方如下:
(1)裂解缓冲液(FA Lysis Buffer):50 mmol/L HEPES-KOH(pH 7.5)、140 mmol/L NaCl、1 mmol/L EDTA(pH 8.0)、1% Triton X-100、0.1% 去氧胆酸钠、0.1% SDS,临用前加入适量蛋白酶抑制剂。
(2)RIPA缓冲液:50 mmol/L Tris-HCl(pH 8.0)、150 mmol/L NaCl、2 mmol/L EDTA(pH 8.0)、1% NP-40、0.5% 去氧胆酸钠、0.1% SDS,临用前加入适量蛋白酶抑制剂。
(3)漂洗缓冲液(Wash Buffer):0.1% SDS、1% Triton X-100、2 mmol/L EDTA(pH 8.0)、150 mmol/L NaCl、20 mmol/L Tris-HCl(pH 8.0)。
(4)最终漂洗缓冲液(Final Wash Buffer):0.1% SDS、1% Triton X-100、2 mmol/L EDTA(pH 8.0)、500 mmol/L NaCl、20 mmol/L Tris-HCl(pH 8.0)。
(二)细胞固定
细胞固定的核心是在生理状态下交联DNA与蛋白质,维持二者天然结合状态,操作需轻柔以避免细胞破裂,步骤如下:
(1)取直径150 mm培养皿,待培养的HeLa细胞汇合度达80%~90%(细胞数量约1×10⁷个)时进行实验;向培养皿中20 ml培养基内,加入550 μl 37%甲醛(或1100 μl 18.5%甲醛),使甲醛终浓度为1%。
(2)轻柔晃动培养皿混匀,室温孵育10 min,确保交联充分且均匀。
(3)终止交联:加入甘氨酸至终浓度125 mmol/L,轻柔混匀后室温孵育5 min,彻底终止甲醛的交联作用。
(4)将培养皿转移至冰上预冷,抑制细胞内源性酶活性,防止目标复合物降解。
(5)小心吸尽培养基,加入20 ml冰冷的PBS,轻柔清洗细胞表面残留培养基及试剂。
(6)吸尽PBS,重复上述PBS清洗步骤1次,确保清洗彻底。
(7)加入2 ml含1×蛋白酶抑制剂复合物的冰冷PBS,用细胞刮刀沿培养皿壁轻柔刮取细胞,收集至1.5 ml离心管中。
(8)置于高速低温离心机,1000 g、4 ℃条件下离心5 min,收集细胞沉淀。
(9)吸弃上清液,向细胞沉淀中加入750 μl预冷的FA Lysis缓冲液,轻柔吹打重悬细胞,获得细胞裂解液,后续用于染色质断裂步骤。
(三)染色质断裂
(1)将含细胞裂解液的离心管置于冰上,进行超声破碎。超声参数设定为:功率310 W,冲击20 s,间隔2 s,共进行3个循环。需注意,超声条件具有细胞系特异性,且与细胞数量密切相关,需通过预实验摸索确定最优条件。超声过程中,将探头尽量深入管内,但避免接触管底及侧壁,防止产生泡沫影响实验效果。
(2)超声破碎完成后,于4 ℃、10,000 g条件下离心10 min,去除细胞碎片等不溶性杂质。
(3)小心吸取上清液,分装至新的1.5 ml离心管中,每管50 μl,分装后可置于-80 ℃冰箱保存,保存期最长不超过3个月。
(4)取100 μl超声破碎产物,加入5 μl浓度为20 mg/ml的蛋白酶K,于65 ℃条件下旋转混匀,进行解交联反应,反应时长为4~5 h(或过夜)。反应结束后,取一半样品进行酚-氯仿抽提,后续通过1.5%琼脂糖凝胶电泳检测超声破碎效果,确保染色质片段符合实验要求。
(四)染色质免疫沉淀
(1)将每管50 μl的超声破碎产物按1:10比例稀释,加入450 μl RIPA缓冲液,轻轻混匀。从中吸取5 μl(占总体积的1%)作为Input对照,置于4 ℃保存,备用(用于后续第4步验证)。
(2)向每个样品管中分别加入阳性对照抗体、阴性对照抗体(正常IgG)及目标蛋白抗体,抗体用量范围为1~10 μg。由于抗体的效力、纯度及特异性存在差异,建议通过抗体梯度稀释实验,确定该实验体系的最适抗体用量。
(3)向各管中加入20 μl充分混匀的Protein A/G beads(预结合鲑鱼精DNA,Salmon Sperm DNA),轻柔混匀。
(4)置于4 ℃环境中旋转孵育1 h(或过夜),确保抗体与抗原及beads充分结合形成免疫复合物。
(5)孵育结束后,于2000 g条件下离心1 min,小心弃去上清液,保留beads复合物。
(6)用1 ml Wash缓冲液清洗beads,共清洗3次,每次清洗后于2000 g离心1 min,弃去上清液,彻底去除未结合的杂蛋白及杂质。
(7)最后用1 ml Final Wash缓冲液清洗beads 1次,2000 g离心1 min,弃去上清液,完成beads纯化。
(五)解交联反应和DNA的纯化
通过蛋白酶K介导的解交联反应释放结合的DNA,随后采用酚-氯仿抽提结合乙醇沉淀法纯化DNA,或直接使用DNA纯化柱回收DNA,具体步骤如下:
(1)向每份样品(含Input对照组)中加入120 μl Elution缓冲液,置于30 ℃环境中旋转孵育15 min,使DNA从免疫复合物中洗脱。
(2)于2000 g条件下离心1 min,收集上清液。
(3)将上清液转移至新的离心管中,可暂时置于-20 ℃保存。
(4)向各管中加入5 μl浓度为20 mg/ml的蛋白酶K,65 ℃条件下旋转混匀,进行二次解交联反应,时长4~5 h(或过夜),确保交联完全解除。
(5)对解交联后的样品进行酚-氯仿抽提,后续通过乙醇沉淀法纯化DNA,纯化后加入100 μl无菌水溶解DNA,置于-20 ℃保存备用。
(六)DNA的鉴定
ChIP实验回收DNA的常用鉴定方法为半定量PCR和实时荧光定量PCR(Real-time PCR),可通过扩增特异性靶序列验证实验有效性及富集效率。
(七)实验结果及分析
(1)交联后的染色质经超声断裂后,通过2%琼脂糖凝胶电泳分析,合格的破碎效果应满足:染色质片段平均长度在200~1000 bp之间,片段分布均匀,无明显拖尾或大片段残留。
(2)对纯化后的DNA片段进行PCR扩增验证,选取管家基因GAPDH的启动子区作为扩增靶序列(扩增片段大小为165 bp)。理想结果为:阳性对照及Input对照均能检测到清晰的扩增条带,无DNA模板的空白对照无扩增条带,阴性对照(正常IgG)可出现微弱扩增条带,但条带亮度与阳性对照存在显著差异,表明实验特异性良好。
注意事项
(1)甲醛交联时间需通过预实验确定,因其受细胞类型、细胞数量影响较大。交联时间过长会导致实验材料丢失,且增加超声破碎难度;交联时间过短则会造成交联不完全,影响免疫沉淀效果。
(2)超声破碎通过机械力断裂染色质,过程中易产生热量及泡沫,导致蛋白质变性,降低ChIP效率。因此,超声操作需全程在冰上进行,采用时断时续的超声程序,避免长时间连续超声,防止蛋白质降解及染色质结构破坏。
(3)ChIP实验需设置完善的对照体系,缺少对照会无法评估实验结果的可靠性。阳性抗体对照、阴性抗体(正常IgG)对照为基础对照;Input对照不仅可验证染色质破碎效果,还能根据Input及沉淀样品中靶序列的含量,按取样比例计算ChIP富集效率,是实验有效性验证的关键。
(4)目标蛋白抗体的选择是ChIP实验成功的核心。蛋白质与染色质交联后,抗体的抗原表位可能被掩盖(与染色质结合位点过近),导致抗体无法识别,影响免疫复合物形成。因此,并非所有抗体均适用于ChIP实验,需选用经ChIP实验验证合格的抗体,以保障实验结果的准确性和可靠性。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


