一、引言
衰老作为生物界普遍存在的现象,其本质是细胞和分子水平上多种损伤的累积效应。随着全球人口老龄化进程的加速,衰老相关疾病的发病率持续攀升,给社会经济和公共卫生系统带来了沉重负担。60岁以上老年患者常伴随多种合并症,需要多维度的联合治疗方案以实现长期疗效。近年来,衰老相关分子机制的研究成为生命科学领域的热点,尤其是线粒体功能障碍和表观遗传调控等机制,因其在多疾病中具有普适性,受到CNS等顶级期刊的高度关注。深入阐明衰老的分子调控网络及其与疾病的关联,对于开发新型防治策略具有重要意义。
二、衰老的核心分子机制
(一)线粒体功能障碍
线粒体作为细胞的"能量工厂",其功能稳态与衰老过程密切相关。随着年龄增长,线粒体生物合成能力下降、自噬清除功能受损,导致功能失调的线粒体积累。线粒体功能障碍通过多重途径驱动衰老:一方面,受损线粒体产生大量活性氧(ROS),引发氧化应激反应,造成DNA、蛋白质等生物大分子损伤;另一方面,线粒体DNA(mtDNA)突变积累,进一步加剧线粒体代谢紊乱,导致能量供应不足。此外,线粒体分裂与融合失衡、线粒体自噬(mitophagy)缺陷等也参与衰老调控,PINK1和Parkin通路功能失调会降低线粒体自噬效率,加重细胞损伤。

线粒体功能障碍会导致多种与衰老相关的疾病
Guo J, Huang X, et al. Aging and aging-related diseases: from molecular mechanisms to interventions and treatments. Signal Transduct Target Ther. 2022 Dec 16;7(1):391.
(二)表观遗传改变
表观遗传修饰通过DNA甲基化、组蛋白修饰、RNA甲基化等方式调控基因表达,且不改变DNA序列。衰老过程中,表观遗传调控网络发生显著重塑:DNA甲基化模式异常导致衰老相关基因表达失调;组蛋白H3磷酸化、H4脱乙酰化等修饰变化在衰老细胞中普遍存在;m6A RNA甲基化积累影响基因转录后调控。这些表观遗传改变直接影响细胞增殖、分化和凋亡,参与干细胞耗竭、细胞衰老等过程的调控,是衰老相关疾病发生的重要分子基础。
(三)蛋白质稳态失衡
蛋白质稳态是细胞维持正常功能的关键,依赖于蛋白质折叠、降解和修复系统的协同作用。衰老导致分子伴侣功能下降、泛素-蛋白酶体系统和自噬-溶酶体系统功能减弱,使得错误折叠、氧化损伤的蛋白质无法有效清除,进而形成聚集。这些异常蛋白质不仅丧失正常生理功能,还会引发内质网应激、炎症反应等,破坏细胞内环境稳态。蛋白质稳态失衡与神经退行性疾病、代谢性疾病等多种衰老相关疾病的发病机制密切相关。

衰老相关疾病中蛋白质稳态的分子机制
Guo J, Huang X, et al. Aging and aging-related diseases: from molecular mechanisms to interventions and treatments. Signal Transduct Target Ther. 2022 Dec 16;7(1):391.
(四)其他关键机制
除上述核心机制外,端粒功能障碍、干细胞耗竭、衰老相关分泌表型(SASP)等也是衰老的重要调控因素。端粒长度随细胞分裂逐渐缩短,端粒损耗会导致细胞周期停滞,引发细胞衰老;干细胞群体随年龄增长出现数量减少和功能衰退,影响组织修复与再生能力;衰老细胞分泌的SASP因子(包括细胞因子、趋化因子、蛋白酶等)会引发慢性炎症,通过旁分泌作用诱导邻近健康细胞衰老,形成"炎症-衰老"恶性循环。
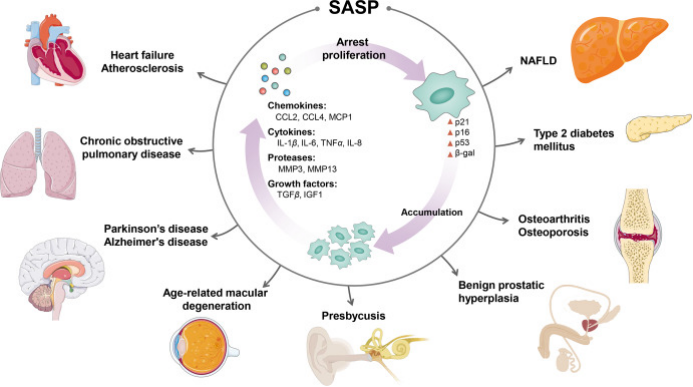
SASP 与各种年龄相关疾病相关
Guo J, Huang X, et al. Aging and aging-related diseases: from molecular mechanisms to interventions and treatments. Signal Transduct Target Ther. 2022 Dec 16;7(1):391.
三、衰老相关分子机制在疾病中的作用
(一)神经退行性疾病
1. 阿尔茨海默病(AD):AD是60岁以上人群常见的进行性神经系统疾病,核心病理特征为神经元丢失、淀粉样蛋白β(Aβ)沉积和tau蛋白过度磷酸化。线粒体功能障碍在AD中表现为线粒体自噬受损,导致功能失调线粒体积累,ROS释放增加,进而促进Aβ聚集和tau蛋白磷酸化;表观遗传方面,DNA甲基化异常、组蛋白修饰改变导致神经退行性相关基因表达失调;Aβ寡聚化和tau蛋白聚集破坏突触可塑性,引发神经毒性,同时星形胶质细胞功能异常导致SASP因子异常分泌,加重中枢神经系统炎症。
2. 帕金森病(PD):PD以运动障碍为主要表现,病理特征是多巴胺能神经元中α-突触核蛋白(α-syn)聚集形成路易体。α-syn错误折叠和聚集是PD的核心致病因素,其前原纤维与LAG3结合引发细胞毒性;衰老相关的神经炎症加剧病情,纤维状α-syn通过与TLR2相互作用激活NLRP3炎症小体,促进IL-1β分泌;约20种基因突变(如SNCA、PARK7)与PD相关,影响多巴胺能神经元功能,而线粒体功能障碍进一步加重神经元损伤。
(二)心血管疾病
1. 心力衰竭(HF):全球HF患者超6400万,心脏衰老是其关键危险因素。衰老心肌细胞存在线粒体功能障碍、氧化应激增加和代谢失调等问题,通过旁分泌信号诱导邻近健康细胞衰老,促进心脏纤维化和炎症反应;氧化应激破坏线粒体完整性,形成"氧化损伤-线粒体功能下降"恶性循环;表观遗传改变(如KDM4D过表达、m6A甲基化异常)调控心肌细胞增殖和衰老;化疗药物(如蒽环类)通过诱导DNA损伤和线粒体功能障碍,引发心肌细胞衰老,最终导致HF。
2. 动脉粥样硬化:氧化应激是动脉粥样硬化的主要驱动因素,Nrf2功能缺陷会增强氧化应激,加速内皮细胞衰老;表观遗传层面,miRNA(如miR-217)通过下调SIRT1表达,诱导内皮细胞功能障碍;血管平滑肌细胞(VSMC)衰老导致炎性细胞因子(IL-1、IL-6)分泌增加,促进斑块生长和破裂;免疫系统功能随年龄下降,Th17与调节性T细胞比例失衡,加剧血管组织损伤。
(三)代谢性疾病
1. 2型糖尿病(T2DM):T2DM以胰岛素分泌缺陷和胰岛素抵抗为特征,65岁以上人群发病率显著升高。β细胞衰老导致胰岛素分泌不足,端粒缩短是β细胞衰老的重要标志;高血糖和高游离脂肪酸(FFA)引发ROS积累和炎症反应,激活TLR4-MyD8通路,促进促炎因子分泌,损害β细胞和脂肪细胞功能;脂肪细胞衰老引发代谢器官炎症和胰岛素抵抗,而肠道微生物群失调进一步加速疾病进展;SASP因子(如CCL4、IL-6)在β细胞衰老中起关键作用,诱导邻近细胞功能障碍。
2. 非酒精性脂肪性肝病(NAFLD):肝脏自噬功能随年龄下降,导致线粒体死亡途径激活,而端粒磨损与NAFLD进展相关;胰岛素抵抗状态下,肝脏脂肪超负荷引发线粒体功能障碍和氧化应激,诱导线粒体自噬异常;肠道微生物产物通过肠肝循环影响肝脏代谢,革兰氏阴性菌与NAFLD纤维化密切相关;Kupffer细胞活化分泌促炎因子,促进肝细胞衰老、炎症和纤维化,推动NAFLD从单纯性脂肪肝向非酒精性脂肪性肝炎(NASH)进展。

衰老相关代谢疾病中衰老与 NAFLD 之间的串扰。
Guo J, Huang X, et al. Aging and aging-related diseases: from molecular mechanisms to interventions and treatments. Signal Transduct Target Ther. 2022 Dec 16;7(1):391.
(四)骨骼肌肉系统疾病
1. 骨关节炎(OA):氧化应激扰乱软骨细胞代谢平衡,ROS激活信号通路上调p53和p21表达,引发细胞凋亡和炎症;软骨细胞线粒体数量减少、膜完整性受损,促进MMP13表达,导致软骨基质丢失;衰老软骨细胞释放SASP因子诱导滑膜炎,而AMPK和mTOR通路调控能量代谢和炎症反应,参与OA发病。
2. 骨质疏松症(OP):衰老导致成骨细胞与破骨细胞平衡失调,骨形成减少而骨吸收增加;过量ROS诱导成骨细胞凋亡,抑制骨矿化;骨髓间充质干细胞(MSC)随年龄耗竭,其成骨分化能力下降而脂肪分化能力增强,是老年OP的主要原因之一;基因组不稳定和DNA损伤加速骨细胞衰老,进一步加重骨质流失。
(五)慢性阻塞性肺疾病(COPD)
COPD与衰老相关的机制包括:
纤毛细胞和肺泡细胞数量减少,影响粘液清除和气体交换;
肺祖细胞耗竭导致组织修复能力下降;免疫细胞功能随年龄改变,增加感染风险;
线粒体功能障碍和自噬减少加速肺气肿进展;
mTOR信号通路过度激活、端粒功能障碍和基因组不稳定性,共同推动COPD发生发展。
四、靶向衰老机制的疾病干预策略展望
针对衰老相关分子机制的干预是防治衰老相关疾病的潜在途径。目前研究方向主要包括:
1. 线粒体功能改善:通过激活AMPK通路、调控线粒体分裂与融合、增强线粒体自噬等方式,改善线粒体质量和功能。例如,SIRT1激活剂可通过调节线粒体蛋白乙酰化,改善心肌细胞代谢;
2. 表观遗传调控:开发DNA甲基转移酶抑制剂、组蛋白去乙酰化酶抑制剂等,靶向纠正衰老相关的表观遗传异常;
3. 蛋白质稳态恢复:利用分子伴侣增强剂、自噬激活剂等,促进异常蛋白质降解,维持细胞内蛋白质稳态;
4. SASP靶向干预:通过清除衰老细胞(senolytics)、抑制SASP因子分泌等方式,减轻慢性炎症反应;
5. 端粒保护:激活端粒酶逆转录酶,延缓端粒缩短,维持细胞增殖能力。
此外,生活方式干预(如热量限制)、天然抗氧化剂补充等也被证实可通过调节衰老机制,延缓疾病进展。未来,多靶点联合干预策略可能成为衰老相关疾病治疗的重要方向,需要进一步开展基础与临床转化研究。
五、结论
衰老相关分子机制是连接衰老过程与多种疾病的核心纽带,其中线粒体功能障碍和表观遗传改变作为关键调控节点,在神经退行性疾病、心血管疾病、代谢性疾病等多种疾病中发挥共性作用。深入解析这些机制的分子网络和调控通路,有助于揭示疾病的发病本质。靶向衰老核心机制的干预策略为衰老相关疾病的防治提供了新的思路,未来需要通过多学科交叉研究,推动相关药物和干预手段的研发与临床应用,最终实现延缓衰老、降低疾病负担的目标。
LabEx多款现货Panel支持衰老研究,欢迎咨询~
| 乐备实官网货号 | Panel | 技术平台 | 检测指标 |
| LXMH10-1 | 人炎症10因子Panel | MSD | IFN-γ,IL-1β,IL-2,IL-4,IL-6,IL-8,IL-10,IL-12p70,IL-13,TNF-α |
| LXLBH10-1 | 人炎症10因子Panel | Luminex | IL-1 β/IL-1F2,IL-2,IL-4,IL-6 ,IL-8/CXCL8,IL-10,IL-12 p70,IL-13,TNF-α,IFN-γ |
| LXMM10-1 | 小鼠炎症10因子Panel | MSD | IFN-γ,IL-1β,IL-2,IL-4,IL-5,IL-6,IL-10,IL-12p70,KC/GRO,TNF-α |
| LXLBM10-1 | 小鼠炎症10因子Panel | Luminex | IL-1 β/IL-1F2,IL-2,IL-4,IL-5,IL-6 ,IL-10,IL-12p70,CXCL1/GRO/α/KC/CINC-1,IFN-γ,TNF-α |
| LXLBR10-1 | 大鼠炎症10因子Panel | Luminex | IL-1 β/IL-1F2,IL-2,IL-4,IL-5,IL-6 ,IL-10,IL-12p70,CXCL1/GRO/α/KC/CINC-1,IFN-γ,TNF-α |
| LXLBM23-1 | 小鼠细胞因子-23因子Panel | Luminex | Eotaxin/CCL11,G-CSF,GM-CSF,IFN-γ,IL-10,IL-12(p40),IL-12(p70),IL-13,IL-17A,IL-1α,IL-1β,IL-2,IL-3,IL-4,IL-5,IL-6,IL-9,GRO-α (Gro-a/KC/CXCL1),MCP-1/CCL2,MIP-1α/CCL3,MIP-1β,RANTES,TNF-α |
| LXLBR23-1 | 大鼠细胞因子-23因子Panel | Luminex | G-CSF,GM-CSF,GRO/KC,IFN-γ,IL-1α,IL-1β,IL-2,IL-4,IL-5,IL-6,IL-7,IL-10,IL-12 (p70),IL-13,IL-17A,IL-18,M-CSF,MCP-1,MIP-1α,MIP-3α,RANTES,TNF-α,VEGF |
| LXLBM31-1 | 小鼠趋化因子-31因子Panel | Luminex | BCA-1/CXCL13,CTACK/CCL27,ENA-78/CXCL5,Eotaxin/CCL11,Eotaxin-2/CCL24,Fractalkine/CX3CL1,GM-CSF,I-309/CCL1,IFN-γ,IL-1β,IL-2,IL-4,IL-6,IL-10,IL-16,IP-10/CXCL10,I-TAC/CXCL11,KC/CXCL1,MCP-1/CCL2,MCP-3/CCL7,MCP-5/CCL12,MDC/CCL22,MIP-1α/CCL3,MIP-1β/CCL4,MIP-3α/CCL20,MIP-3β/CCL19,RANTES/CCL5,SCYB16/CXCL16,SDF-1α/CXCL12,TARC/CCL17,TNF-α |
| LXLRH46-1 | 人细胞因子-46因子Panel | Luminex | CCL2/JE/MCP-1,CCL3/MIP-1 alpha,CCL4/MIP-1 beta,CCL5/RANTES,CCL11/Eotaxin,CCL19/MIP-3 beta,CCL20/MIP-3 alpha,CD40 Ligand/TNFSF5,CXCL1/GRO alpha/KC/CINC-1,CXCL2/GRO beta/MIP-2/CINC-3,CXCL10/IP-10/CRG-2,EGF,FGF basic/FGF2/bFGF,Flt-3 Ligand/FLT3L,G-CSF,GM-CSF,Granzyme B,IFN-alpha 2/IFNA2,IFN-beta,IFN-gamma,IL-1 alpha/IL-1F1,IL-1 beta/IL-1F2,IL-1ra/IL-1F3,IL-2,IL-3,IL-4,IL-5,IL-6,IL-7,IL-8/CXCL8,IL-9,IL-10,IL-12 p70,IL-13,IL-15,IL-17/IL-17A,IL-17E/IL-25,IL-33,Lymphotoxin-alpha/TNF-beta,PD-L1/B7-H1,PDGF-AA,PDGF-AB/BB,TGF-alpha,TNF-alpha,TRAIL/TNFSF10,VEGF |












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


