摘要: 酵母双杂交系统是一种基于真核生物转录调控原理建立的体内蛋白质相互作用研究工具。该系统通过将目标蛋白分别与转录因子的DNA结合结构域(BD)和转录激活结构域(AD)融合,在酵母细胞中重建功能完整的转录激活因子,从而将蛋白质间的物理互作转化为易于检测的报告基因信号。因其高效、灵敏且操作相对简便,该系统已成为功能基因组学、蛋白质组学及药物靶点筛选等领域的关键技术之一。
一、系统原理
酵母双杂交系统的理论基础源于对真核细胞转录激活过程的理解。典型的转录激活因子包含两个功能独立但物理上可分离的结构域:DNA结合结构域(BD)和转录激活结构域(AD)。BD负责特异性结合至下游报告基因的启动子区域,而AD则负责招募转录复合体以启动基因表达。这两个结构域单独存在时均不具备激活转录的能力;只有当它们通过某种方式在空间上相互接近时,方能行使完整的转录激活功能。
基于此机制,研究者将待研究的蛋白质X与BD融合表达(形成“诱饵”蛋白),将蛋白质Y与AD融合表达(形成“猎物”蛋白)。当这两种融合蛋白被共表达于同一酵母报告菌株中时,若X与Y发生相互作用,便会将BD与AD在空间上拉近,从而激活下游报告基因的转录与表达。反之,若两者无相互作用,则报告基因保持沉默。因此,通过检测报告基因的表达情况,即可间接推断目标蛋白质之间是否存在特异性相互作用。
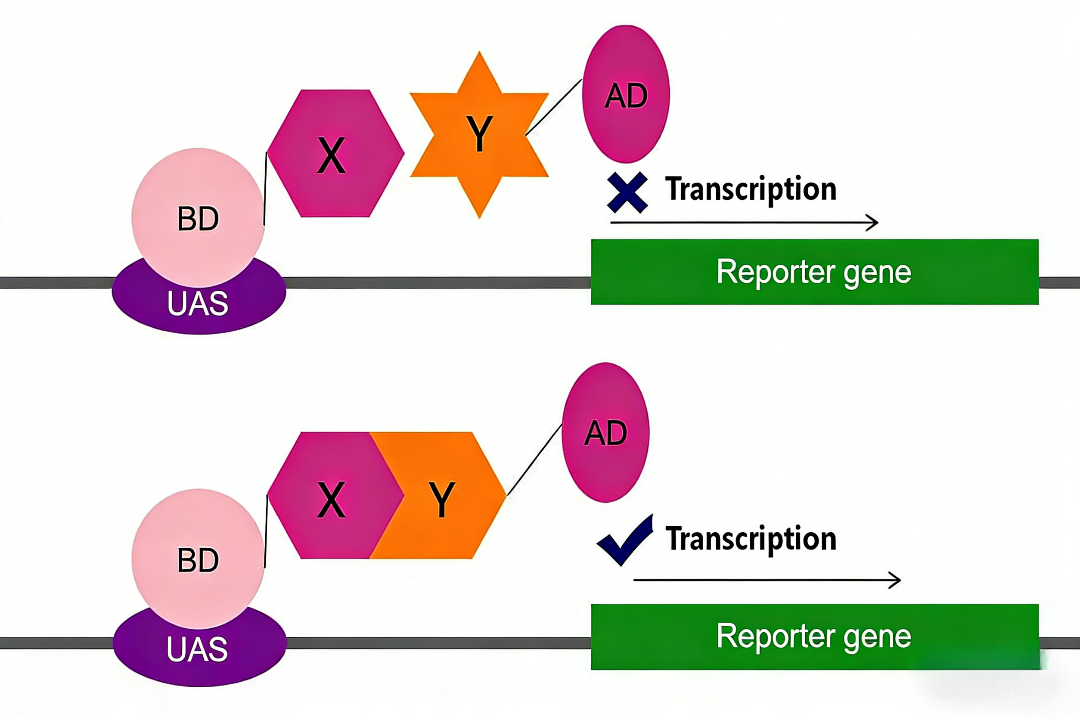 图1:酵母双杂交原理
图1:酵母双杂交原理
二、核心构成元件
一个完整的酵母双杂交系统由三个核心组件构成:
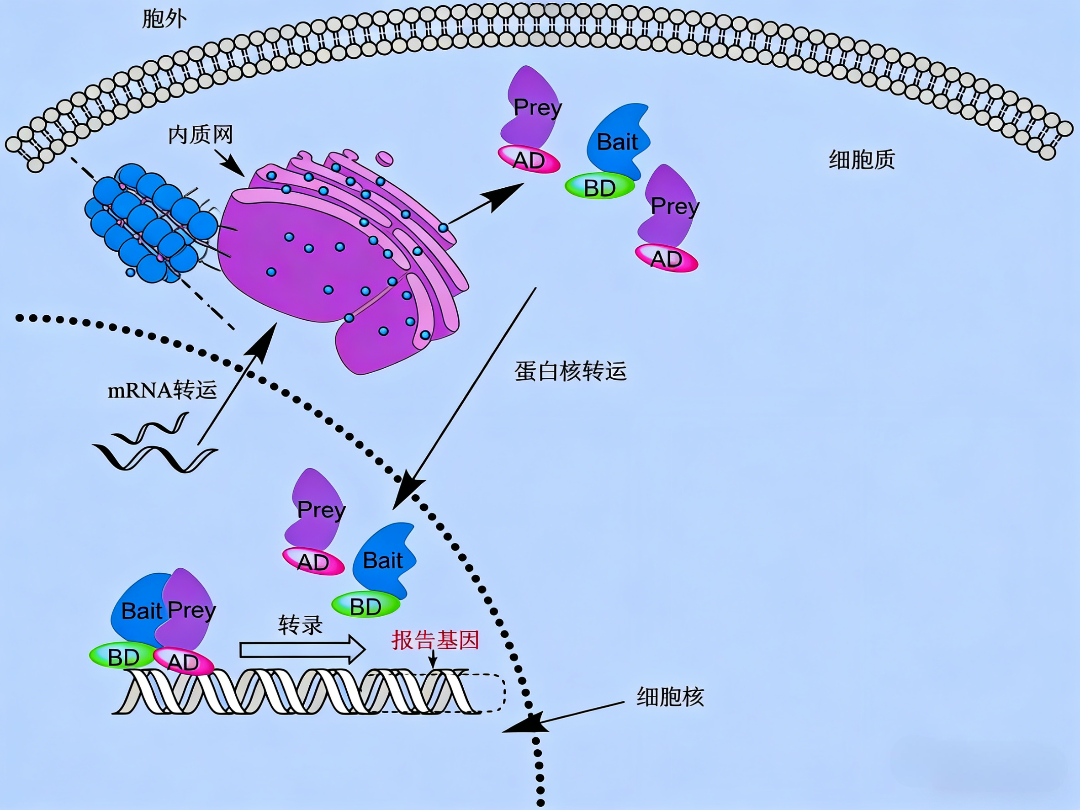
1、诱饵载体:用于表达BD-诱饵蛋白(Bait)的融合蛋白。诱饵蛋白通常是已知的、待研究的核心蛋白。
2、猎物载体:用于表达AD-猎物蛋白(Prey)的融合蛋白。猎物可以是单个已知蛋白,也常为cDNA文库、基因片段或突变体库,用于筛选未知的互作伙伴。
3、报告系统宿主菌株:一种经过基因工程改造的酵母菌株,其基因组中整合了一个或多个受特定启动子调控的报告基因。该启动子包含能被BD识别的DNA序列。常用的报告基因包括HIS3、URA3、LacZ(β-半乳糖苷酶)和ADE2等。菌株本身带有相应报告基因的营养缺陷型标记(如his3Δ),只有当报告基因被激活并表达时,酵母才能在缺乏相应营养的培养基上生长或显现其他表型,从而实现阳性互作的筛选与鉴定。为增加可靠性,常使用多个独立的报告基因以减少假阳性。
目前广泛应用的系统主要有两类:
👉Gal4系统:BD与AD分别来源于酵母自身的转录因子Gal4(通常BD对应1-147位氨基酸,AD对应768-881位氨基酸)。
👉LexA系统:BD由原核的LexA阻遏蛋白提供,AD则常采用大肠杆菌的酸性激活肽B42。
三、酵母作为宿主系统的优势
选择酵母(特别是酿酒酵母)作为工作平台,主要基于其以下优点:
✔️遗传操作便捷:酵母生长快速,易于进行高效的遗传转化、质粒提取和遗传杂交。
✔️完备的遗传工具:拥有丰富的选择性标记、明确的营养缺陷型以及成熟的报告基因系统。
✔️背景干扰较低:酵母作为单细胞真核生物,其内源性蛋白网络与哺乳动物等高等真核生物差异较大,可降低与外源表达蛋白发生非特异性相互作用的背景噪音。
✔️具备基本的翻译后修饰能力:能对异源蛋白进行一定的翻译后修饰(如磷酸化),有助于研究依赖于修饰的蛋白质互作。
四、主要应用领域
1、验证已知蛋白质间的相互作用:为假设的蛋白质互作提供直接的体内证据。
2、筛选互作蛋白:以已知功能的蛋白质作为诱饵,从cDNA文库中“钓取”新的互作蛋白,用于揭示信号通路或蛋白复合物成员。
3、绘制蛋白质相互作用网络:通过大规模筛选,构建特定生物学过程或通路的蛋白质互作图谱。
4、鉴定互作的关键结构域或关键氨基酸:通过对诱饵或猎物蛋白进行定点突变或截断,确定介导互作所必需的最小功能区域或关键残基。
5、初步探索未知蛋白的功能:以功能未知的新蛋白作为诱饵,通过其捕获的已知互作蛋白的功能,推测该新蛋白可能参与的生物学过程。
6、药物靶点与先导化合物筛选:评估小分子化合物对特定蛋白质相互作用的影响,用于药物发现与作用机制研究。
五、系统优势与局限性分析
核心优势:
👉高灵敏度:检测基于报告基因产物的积累,可放大并检测到微弱或瞬时的相互作用。
👉操作相对简便:整个过程在活细胞内进行,无需繁琐的蛋白质纯化与体外重建步骤。
👉体内环境:在完整的真核细胞环境中检测互作,更能反映潜在的生理相关性。
👉适用于大规模筛选:可高通量地筛选文库,发现新的相互作用对。
主要局限性:
👉假阳性问题:这是该系统最突出的挑战。原因包括:①某些蛋白本身具有转录激活活性(自激活);②蛋白在酵母内异常表达或折叠可能产生非生理性的粘附作用;③报告基因的异常激活。
👉假阴性问题:某些真实的相互作用可能因蛋白在酵母中表达、折叠、定位不正确,或需要特殊的翻译后修饰(酵母无法提供)而无法被检测到。
👉作用环境非天然:相互作用发生在酵母细胞核内,可能不适用于所有蛋白(如膜蛋白、分泌蛋白或需要特定细胞器环境的蛋白)。
👉间接检测:检测到的是转录激活信号,而非直接观测蛋白质复合物,仍需其他实验(如免疫共沉淀)进一步验证。
降低假阳性的常用策略:
👉严格的对照设计:必须测试诱饵和猎物蛋白单独存在时是否自激活报告基因。
👉多重报告基因验证:使用两个或以上不同营养缺陷或酶学报告基因(如HIS3 + LacZ),要求多个报告基因同时被激活才判定为阳性。
👉基因整合稳定表达:将报告基因稳定整合到染色体上,避免质粒拷贝数波动带来的表达差异。
👉反向验证实验:交换BD/AD的融合方向(如将诱饵与AD融合,猎物与BD融合)进行重复验证。
👉独立实验验证:必须通过免疫共沉淀、Pull-down、荧光共振能量转移等体外或更接近天然体系的实验对阳性结果进行最终确认。
六、结论
酵母双杂交系统作为一种经典的体内蛋白质互作研究技术,凭借其独特的原理设计、灵敏的检测能力和操作的便利性,在生命科学研究中发挥着不可替代的作用。尽管存在假阳性等局限性,但通过严谨的实验设计和多重验证策略,其可靠性可以得到有效保障。它不仅是验证二元相互作用的有效工具,更是大规模发掘未知蛋白质互作、解析复杂生物网络的有力平台。随着技术的不断发展与优化(如膜酵母双杂交、三元杂交系统的出现),其应用范围正不断扩大,持续推动着蛋白质功能与细胞信号传导研究的深入。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


