2026 年 1 月 7 日,哈佛医学院团队在《Nature》期刊在线发表题为 “Bidirectional CRISPR screens decode a GLIS3-dependent fibrotic cell circuit” 的研究论文(全文链接:https://doi.org/10.1038/s41586-025-09907-x)。
该研究通过整合单细胞与空间转录组分析、双向 CRISPR 筛选等技术,系统解析了炎症性肠病(IBD)中纤维化形成的细胞与分子调控机制,首次鉴定出 “巨噬细胞–成纤维细胞–IL11–GLIS3” 构成的病理性细胞回路,明确转录因子 GLIS3 是驱动纤维化的核心调控因子,为纤维化相关疾病的靶向治疗提供了全新潜在靶点。

💯文章亮点
1. 技术创新:构建多维度疾病机制解析体系
- 方法学突破:整合空间转录组学、全基因组 CRISPR 功能筛选与条件性基因敲除动物模型,建立复杂疾病细胞互作网络的系统性解析框架;
- 靶点筛选新范式:以 IL11+ IAF 病理细胞状态为导向的功能性筛选策略,高效捕获传统差异表达分析难以识别的核心调控转录因子。
2. 理论突破:阐明炎症 - 纤维化转化核心机制
- 揭示新型细胞互作回路:明确 TGFβ/IL-1β 信号诱导、GLIS3 介导的巨噬细胞–成纤维细胞互作机制,定义调控组织重塑的关键分子轴(GLIS3-IL11);
- 定位纤维化调控枢纽:确立 GLIS3 作为整合上游炎症信号与下游纤维化基因程序的核心转录因子,为基质细胞在慢性炎症中的命运决定机制提供全新理论依据。
3. 临床价值:提供精准抗纤维化治疗新方向
- 提出特异性治疗策略:靶向 GLIS3 通路可实现成纤维细胞特异性抗纤维化干预,在抑制病理性基质沉积的同时,规避对全身免疫功能的非特异性干扰,提升治疗安全性与有效性。
4. 普适意义:构建泛器官纤维化研究统一框架
- 跨器官机制保守性:“巨噬细胞–成纤维细胞–GLIS3” 调控轴在肝、肺、肾等多器官慢性纤维化中可能具有功能保守性,为泛器官纤维化的机制研究与靶向药物开发提供统一理论框架及潜在干预路径。
💯研究背景
慢性炎症会过度刺激纤维生成过程,最终引发纤维化。这一病理状态是多种慢性疾病进展的共同终点,占疾病相关死亡的 45%,但当前治疗手段十分有限。
单细胞图谱研究已明确,具有功能异质性和定位特异性的成纤维细胞是驱动纤维化发生的核心细胞群体。不过,针对这类致病性成纤维细胞的干预仍面临关键挑战:一方面,对其在疾病背景下的分子调控机制理解尚不透彻;另一方面,现有免疫抑制疗法主要靶向非特异性促炎介质,难以实现对成纤维细胞的精准调控,限制了治疗效果。
💯主要研究方法
1. 多维细胞图谱构建
- 单细胞转录组测序:对炎症性肠病(IBD)患者与健康对照的肠道组织样本进行单细胞 RNA 测序,系统构建肠道细胞全景图谱,精准鉴定炎症相关成纤维细胞(IAF)亚群;
- 空间转录组学:在组织原位解析 IAF 的空间定位及微环境特征,明确其与巨噬细胞等免疫细胞的邻近分布关系,揭示病理性细胞互作的空间基础。
2. 无偏倚机制筛选
- 全基因组双向 CRISPR 筛选:以 IL11 表达为功能性表型指标,同步开展基因敲除(CRISPRko)与基因激活(CRISPRa)筛选,系统性鉴定调控 IAF 活化的关键分子。
3. 分子调控机制解析
- 染色质免疫沉淀测序(ChIP-seq):通过特异性抗体富集 GLIS3 结合的 DNA 片段,鉴定其基因组直接结合位点,明确下游靶向基因;
- RNA 测序(bulk + scRNA-seq):综合分析 GLIS3 敲除 / 过表达后成纤维细胞的转录组变化,揭示其调控的分子网络及功能通路,阐明其在促纤维化程序中的核心作用。
4. 体内外功能验证
- 条件性基因敲除小鼠模型:构建成纤维细胞特异性 Il11 和 Glis3 条件性敲除小鼠,结合慢性结肠炎模型,系统评估其在肠道纤维化进程中的病理功能;
- 细胞共培养与信号阻断实验:体外重建巨噬细胞 - 成纤维细胞共培养体系,利用中和抗体阻断 TGFβ/IL-1β 信号通路,明确二者在成纤维细胞活化中的关键作用。
5. 临床关联验证
- 公开队列数据分析:基于独立大型儿科溃疡性结肠炎(UC)患者队列,分析 GLIS3 特征基因表达谱与疾病严重程度、临床进展的相关性,评估其作为生物标志物的转化价值。
💯实验结果
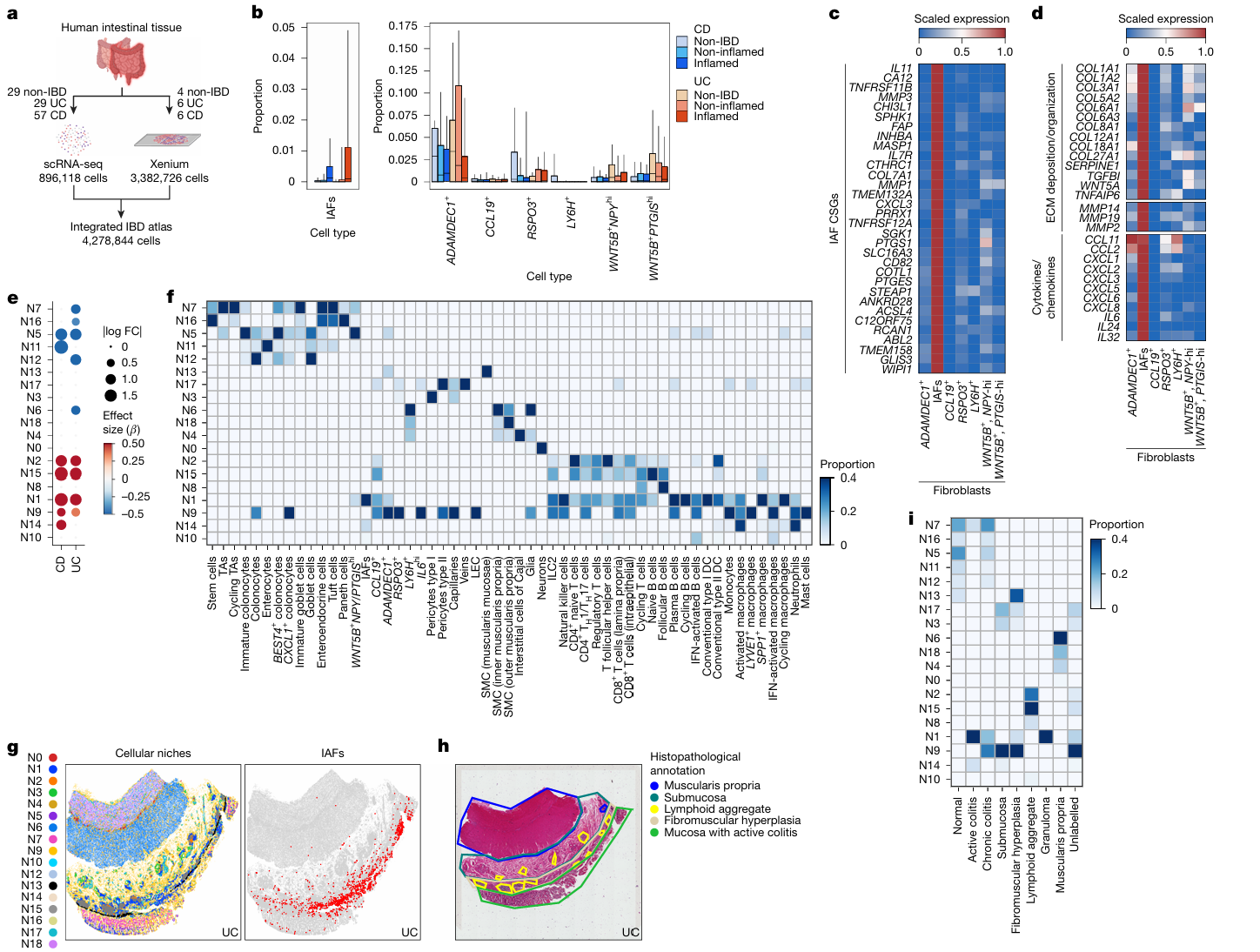
1. IBD 单细胞与空间图谱:定位病理性 IAF 生态位
- 实验设计:整合炎症性肠病(IBD)患者与健康对照的肠道组织 scRNA-seq 数据,构建包含 427 万细胞的全景图谱,覆盖上皮、免疫、基质、成纤维细胞等多个细胞谱系;结合 Xenium 空间转录组学与细胞邻域分析,解析特定细胞亚群的空间分布及生态位特征。
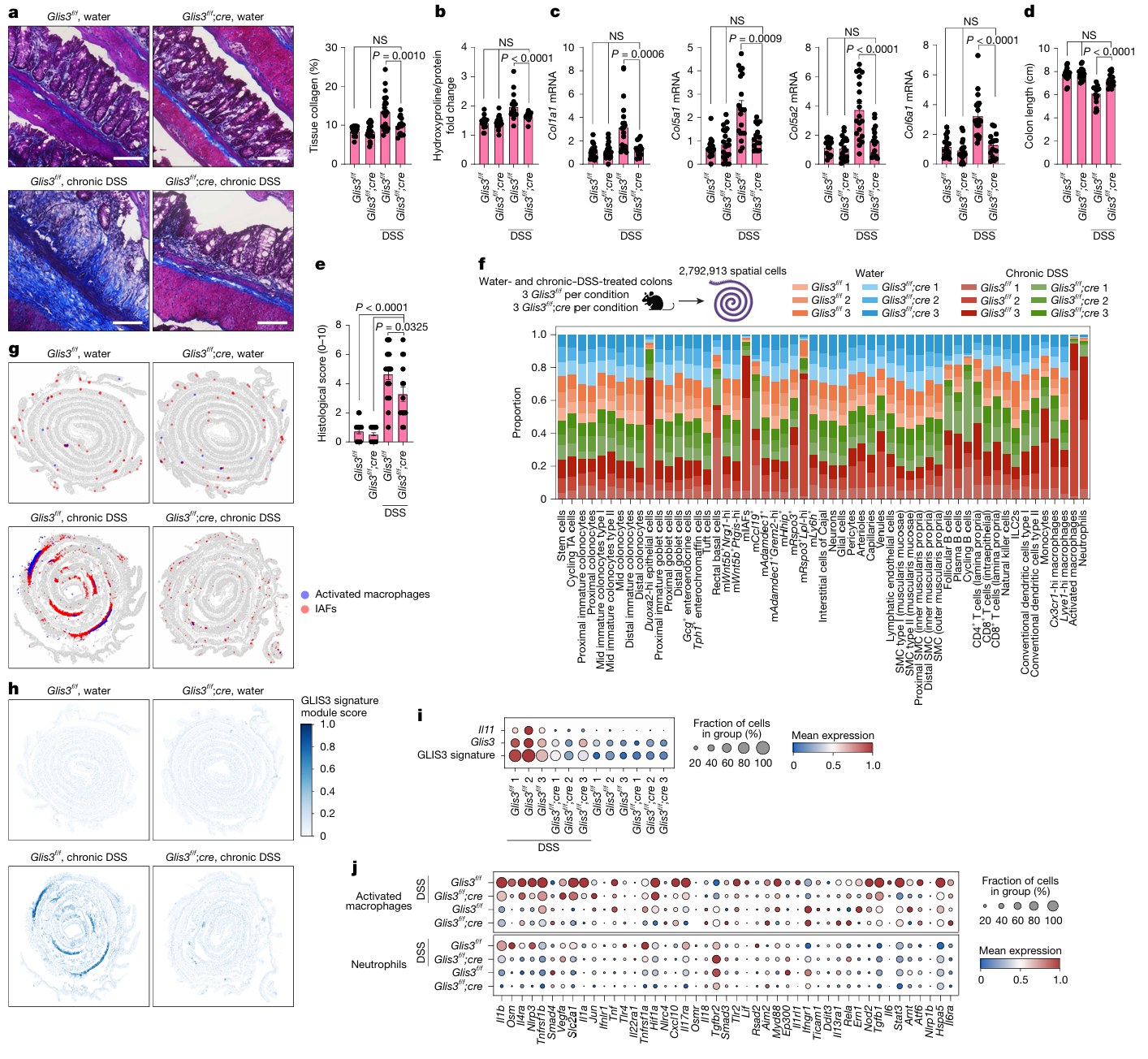
- 主要结果:炎症状态下,修复型 ADAMDEC1 + 成纤维细胞数量减少,而 IL-11 + 炎症相关成纤维细胞(IAFs)显著扩增;IAFs 特异性高表达纤维化相关基因(CD82、PRRX1)、细胞外基质(ECM)重塑基因(COL1A1、COL6A1)及中性粒细胞趋化因子(CXCL3、CXCL8)。通过细胞邻域分析识别出 19 个细胞生态位,IAFs 高度富集于 N1 和 N14 生态位,与 FCN1+IL1B + 活化巨噬细胞紧密共定位;这些生态位在纤维化和溃疡组织中高度富集,且主要分布于活动性 / 慢性结肠炎的黏膜区域。
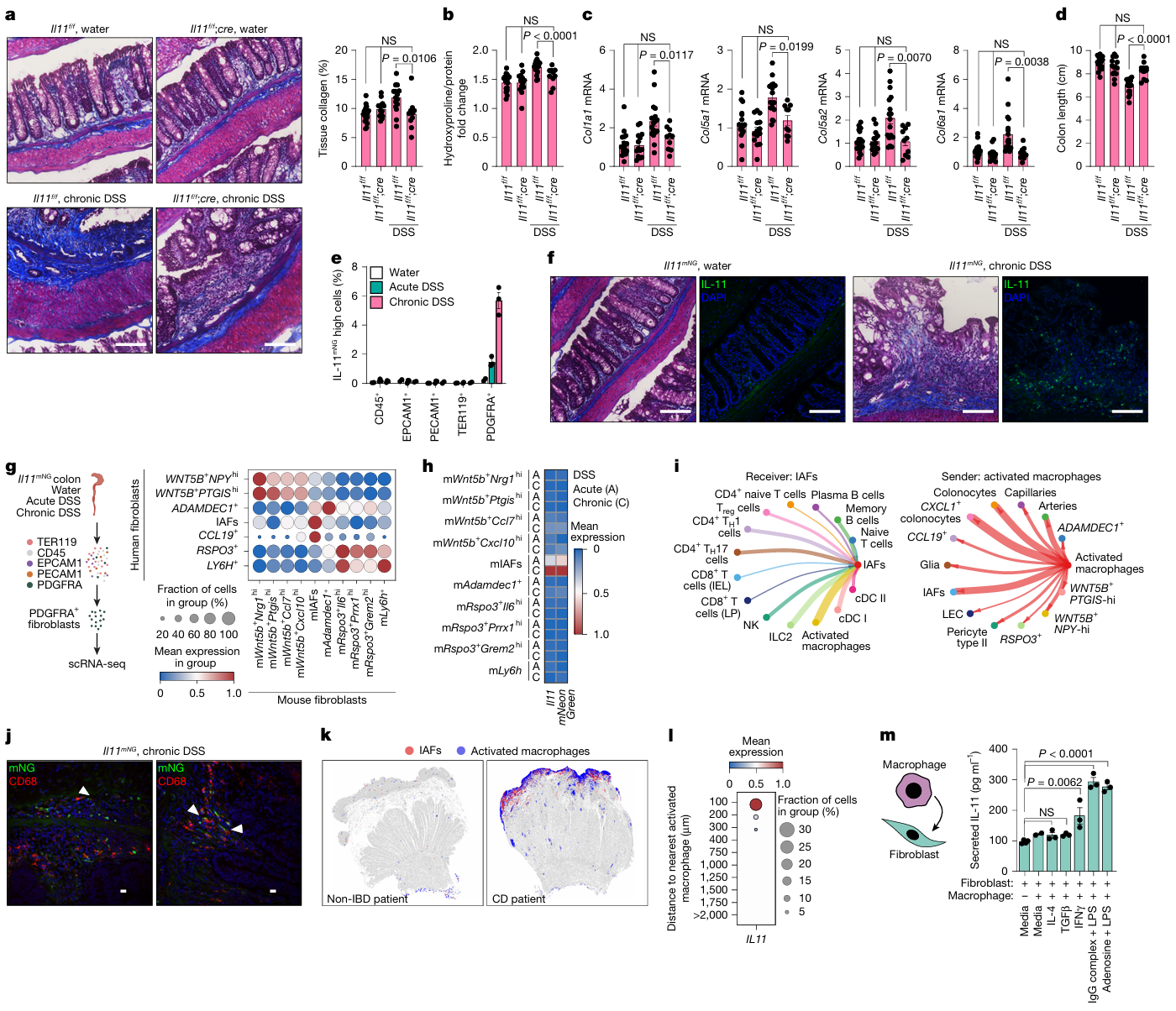
2. IL-11 细胞环路:调控纤维化的关键功能轴
- 实验设计:①构建 IL-11 条件性敲除小鼠与 IL-11-mNeonGreen 报告小鼠,结合慢性 DSS 诱导结肠炎模型,评估 IL-11 缺失对肠道纤维化的影响;②通过跨物种转录组分析,对比小鼠 IAFs(mIAFs)与人类 IAFs 的同源性及基因表达特征;③利用细胞邻域空间分析与巨噬细胞 - 成纤维细胞共培养体系,明确 IAFs 的上游信号来源及 IL-11 诱导机制。
- 主要结果:①慢性 DSS 结肠炎模型中,IL-11 缺失可显著减少结肠胶原沉积、降低羟脯氨酸含量及纤维化相关胶原基因(COL1A1、COL6A1)表达,且不影响炎症严重程度,但能有效减轻炎症驱动的组织重塑;②跨物种比较证实,mIAFs 与人类 IAFs 高度同源,均高表达抗 TNF 治疗抵抗相关基因,且慢性 DSS 处理后 mIAFs 丰度显著升高,并特异性共表达 IL-11 与报告基因;③空间分析显示活化巨噬细胞与 IAFs 在体内紧密相邻(间距≤100μm),体外共培养实验进一步证实,促炎表型巨噬细胞可通过新生转录依赖机制,诱导成纤维细胞分泌 IL-11,明确活化巨噬细胞是 IAFs 的核心上游信号来源。
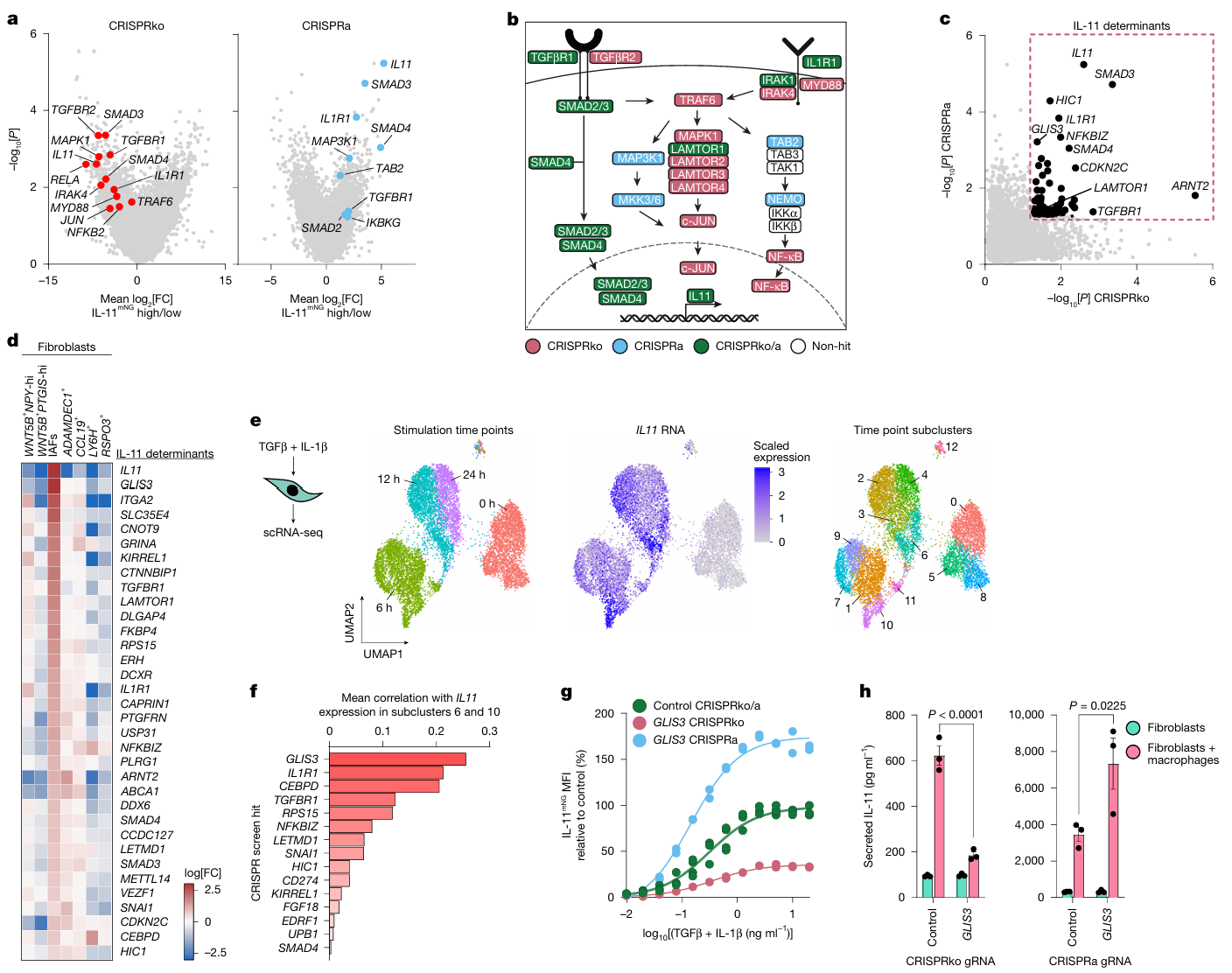
3. 全基因组 CRISPR 筛选:锁定 IAF 活化核心调控因子 GLIS3
- 实验设计:①构建 IL-11-mNG 报告人成纤维细胞系,同步开展 CRISPR 基因敲除(CRISPRko)与激活(CRISPRa)筛选,靶向鉴定调控 IL-11 表达的关键基因;②通过时间分辨单细胞 RNA-seq,追踪 TGFβ+IL-1β 刺激下成纤维细胞 IL-11 表达动态及细胞分群特征,结合相关性分析筛选核心转录因子;③通过 GLIS3 敲除 / 激活实验、细胞定位观察及信号通路阻断实验,验证 GLIS3 对 IL-11 的调控作用及上游激活机制。
- 主要结果:①筛选共鉴定出 61 个调控 IL-11 表达的核心基因,涵盖 TGFβ/IL-1β 信号通路组件(TGFBR1、SMAD3、IRAK2)及免疫调节基因(LAMTOR1、NFKBIZ);②时间分辨 scRNA-seq 显示,TGFβ+IL-1β 刺激 6 小时后成纤维细胞启动 IL-11 表达,且该基因在簇 6 和簇 10 细胞中高富集,相关性分析明确转录因子 GLIS3 为调控 IL-11 的顶级候选基因;③双向功能验证证实,GLIS3 敲除可显著抑制成纤维细胞 IL-11 的表达与分泌,而 GLIS3 激活则能强效增强 IL-11 表达;进一步机制表明,活化巨噬细胞可诱导 GLIS3 在成纤维细胞中核定位,且 TGFβ 与 IL-1β 信号协同作用,促进 GLIS3 转录水平上调。
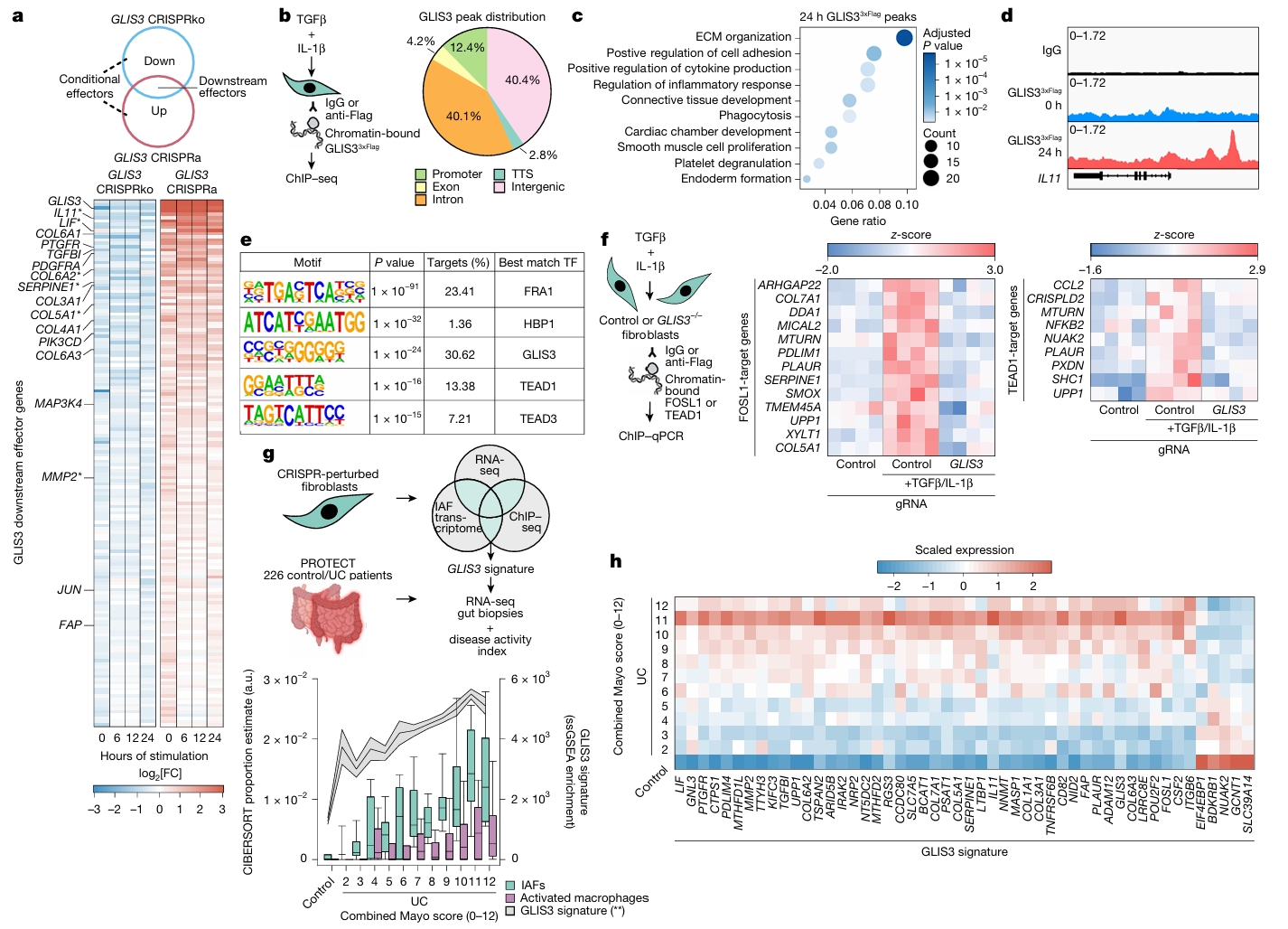
4. GLIS3:调控 IAF 功能程序与疾病分层的核心枢纽
- 实验设计:①联合 RNA-seq 与 ChIP-seq 技术,解析 GLIS3 调控的下游效应基因网络及直接结合靶点;②通过基序分析探究 GLIS3 与其他转录因子的协同调控机制,验证 GLIS3 缺失对下游因子结合活性的影响;③基于 GLIS3 靶基因构建特征评分,在 226 例溃疡性结肠炎(UC)患者队列中,关联评分与疾病严重程度、特征细胞丰度的相关性,评估其疾病预测价值。
- 主要结果:①组学分析证实,GLIS3 可调控 150 余个下游效应基因,涵盖纤维化相关基因、炎症介质及组织重塑基因,且能直接结合 IL-11 转录起始位点上游区域,直接调控其表达;②基序分析显示,GLIS3 结合区域富集 FOSL1 和 TEAD1/3 转录因子结合基序,GLIS3 缺失会显著削弱 FOSL1 与 TEAD1 对靶基因的结合能力,提示三者存在协同调控网络;③基于 GLIS3 靶基因构建的特征评分,可有效对 226 例 UC 患者按疾病严重程度分层,该特征评分与 IAFs 及活化巨噬细胞丰度呈正相关,其中包含 GLIS3、IL-11 在内的 50 个核心基因,可独立预测患者疾病严重程度。
5. 体内功能验证:GLIS3 是肠道纤维化的关键驱动因子
- 实验设计:①构建成纤维细胞特异性 Glis3 敲除小鼠,结合慢性结肠炎模型,通过病理切片分析、胶原含量检测等,评估 Glis3 缺失对肠道纤维化及炎症表型的影响;②利用空间转录组学技术,对比 Glis3 敲除小鼠与野生型小鼠的肠道组织,解析细胞亚群丰度、特征基因表达及炎症介质水平的变化。
- 主要结果:①慢性结肠炎模型中,成纤维细胞特异性 Glis3 敲除小鼠的纤维化表型显著减轻,同时伴随炎症反应缓解、胶原沉积量减少,明确证实 Glis3 在肠道纤维化进程中发挥不可或缺的关键作用;②空间转录组分析显示,Glis3 敲除后,小鼠 IAFs(mIAFs)与活化巨噬细胞丰度显著下降,GLIS3 特征基因表达下调,中性粒细胞等免疫细胞比例降低,且 IL-1β、OSM、TNF 等纤维炎症介质的表达水平同步降低,提示 GLIS3 可调控纤维炎症微环境的整体稳态。
💯总结
本研究以鉴定病理性细胞单元→解析细胞互作回路→锁定核心转录调控因子→验证病理功能与临床价值为研究思路,通过双向 CRISPR 功能筛选首次明确 GLIS3 是驱动炎症相关成纤维细胞活化及纤维化的核心转录因子,同时阐明其受 TGFβ/IL-1β 信号协同调控的分子机制,构建了从临床现象解析、分子机制挖掘到临床前功能验证的完整科学研究闭环。该研究不仅大幅深化了对炎症性肠病(IBD)纤维化发生发展机制的认知,更首次揭示了靶向 GLIS3 信号通路阻断 “炎症 - 纤维化” 转化的新型治疗策略,为纤维化相关疾病的精准靶向治疗提供了全新分子靶点与理论支撑,兼具重要的科学价值与广阔的转化医学应用前景。
单细胞转录组和空间转录组哪里有?
LabEx提供一站式多组学服务:包含单细胞转录组测序(点击)和DSP空间转录组测序(点击)。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


