一、引言
衰老过程伴随着机体代谢的系统性重构,表现为能量消耗下降、脂肪堆积、胰岛素抵抗等特征,这些变化与肥胖的代谢表型存在诸多相似之处,且二者均显著增加2型糖尿病风险并降低预期寿命。既往研究表明,老年哺乳动物存在碳水化合物向脂肪代谢的转变、线粒体功能减退、血清代谢组改变及NAD⁺、牛磺酸水平下降等现象,推动了生酮饮食、代谢物补充等抗衰老策略的探索。 代谢组学可量化代谢物浓度变化,而稳定同位素示踪技术能精准表征代谢通路活性(通量),二者结合为解析衰老相关代谢重构提供了有力工具。然而,现有研究多聚焦于单一性别小鼠的血清或特定器官代谢组,对衰老过程中循环及组织代谢通量的系统性评估尚不完善,仅证实烟酰胺和葡萄糖的循环通量在老年小鼠中得以维持。此外,衰老与肥胖引发的代谢通量改变是否存在本质差异,核心代谢通路在衰老中是否具备稳健性等关键问题仍不明确。 本研究通过整合代谢组学与稳定同位素示踪技术,全面解析衰老对小鼠代谢物浓度及通量的影响,对比衰老与肥胖的代谢重构差异,揭示衰老过程中代谢系统的核心特征与调控机制,为理解衰老的代谢基础及相关疾病防治提供实验支撑。

二、材料与方法
(一)实验动物
选用C57BL/6J野生型小鼠,分为年轻组(3-6个月)与老年组(21个月以上);同时选取3-5个月龄的ob/ob肥胖小鼠作为对照,所有小鼠均在标准环境下饲养,实验前禁食8小时。
(二)代谢组学分析
通过颈静脉采血收集血清样本,采用液相色谱-高分辨率质谱法(LC-MS)定量分析170余种血清代谢物浓度;同时收集大脑、肝脏、肌肉等15种组织,检测400余种小分子代谢物,通过错误发现率(FDR)校正评估年龄及年龄×性别交互作用对代谢物丰度的影响。
(三)稳定同位素示踪实验
对植入导管的自由活动小鼠进行稳定同位素标记代谢物恒速输注,涵盖葡萄糖、乳酸、谷氨酰胺等核心代谢物及哌啶酸、4-羟基脯氨酸等非核心代谢物。通过测量内源性代谢对输注示踪剂的稀释程度,计算循环代谢通量(F_circ);利用双标记[U-¹³C, ¹⁵N]谷氨酰胺追踪碳氮原子的下游代谢去向。
(四)数据分析
采用线性模型拟合评估代谢物浓度与通量的年龄相关性,通过对数倍比变化(log2FC)比较组间差异,统计显著性设定为FDR校正后P<0.05。
三、结果
(一)老年小鼠血清代谢组发生广泛重构
LC-MS检测显示,老年小鼠血清中约30%的代谢物呈现显著年龄相关性变化,5%的代谢物存在年龄×性别交互效应(图1A)。具体表现为血糖、酮体(3-羟基丁酸、乙酰乙酸)及甘油三酯浓度下降,而瘦素和胰岛素水平升高,提示老年小鼠可能通过增加胰岛素分泌维持葡萄糖稳态(图1B、D)。血清游离脂肪酸总量未随年龄显著变化,其中棕榈酸、油酸等主要脂肪酸浓度保持稳定(图1C)。这些结果表明,衰老虽未改变核心能量底物的整体供应,但显著重塑了血清代谢物的组成格局。
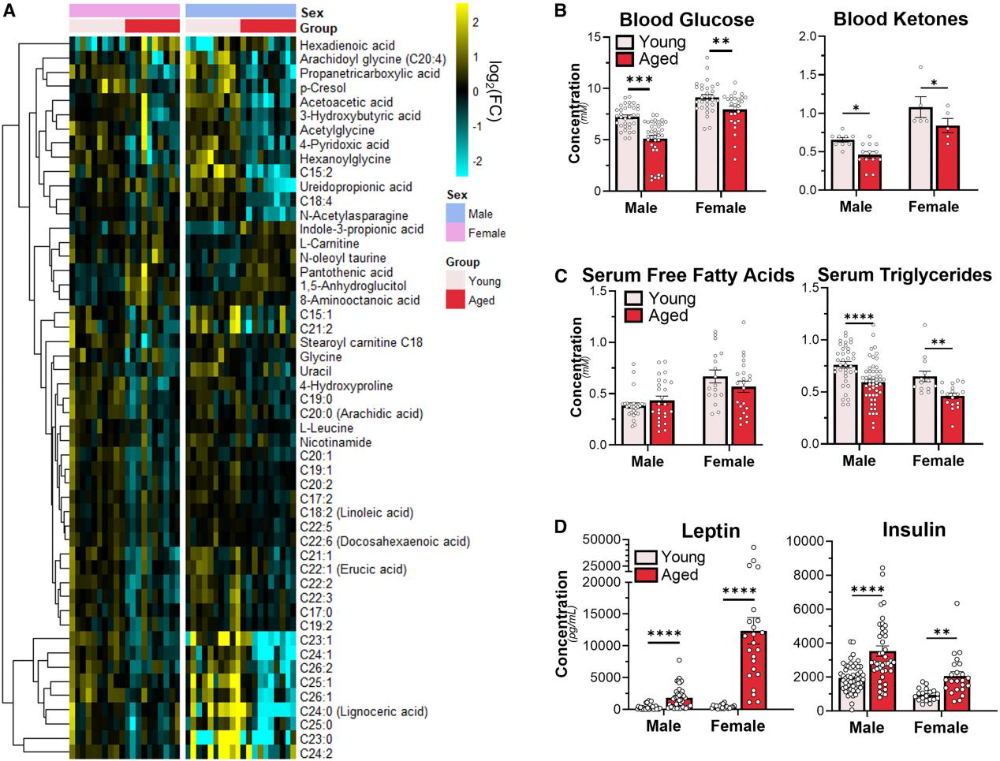
图1. 衰老重塑血清代谢组
(二)核心代谢通量在衰老过程中保持稳健
尽管血清代谢物浓度发生广泛改变,但核心循环代谢通量的维持情况远超预期。在所有测量的核心通量(>100 nmol/分钟/只小鼠)中,葡萄糖、乳酸、乙酸、甘油等主要碳载体的通量均未随年龄变化,仅谷氨酰胺通量在老年小鼠中增加约30%,且该变化呈年龄依赖性逐步发生(图2B)。对比分析显示,衰老过程中代谢物通量的变化幅度显著小于其浓度变化,而肥胖小鼠(ob/ob)的核心代谢通量改变更为剧烈,葡萄糖、乳酸、甘油通量较野生型小鼠升高50%-85%,亮氨酸、赖氨酸通量增加,缬氨酸、蛋氨酸通量降低(图2C、E)。此外,肥胖小鼠的牛磺酸通量显著增加,而衰老小鼠无此变化,表明衰老与肥胖通过不同机制调控代谢通量(图2D)。
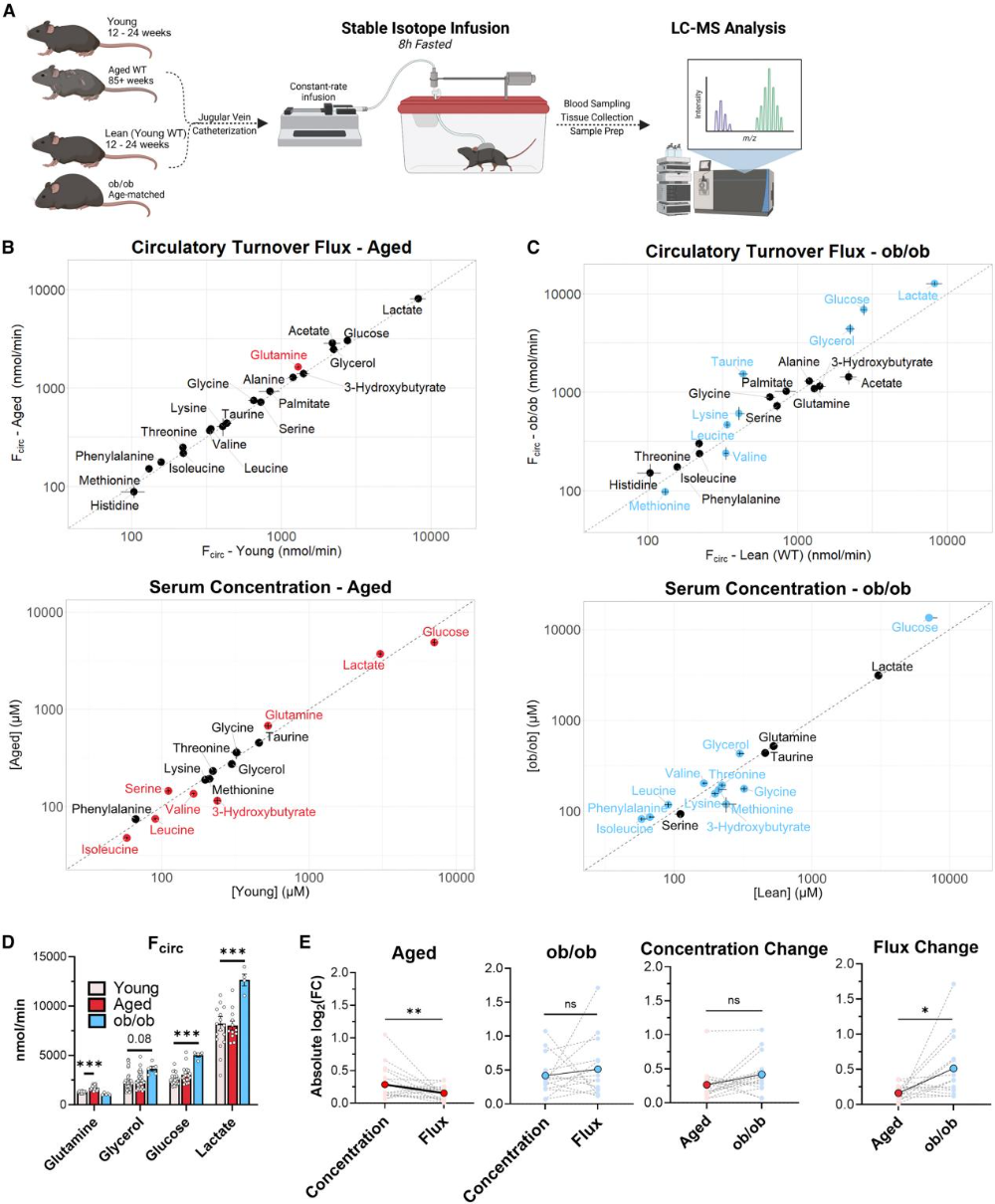
图2. 核心代谢通量在衰老过程中的保持程度优于肥胖状态
(三)谷氨酰胺代谢的年龄相关性重构
鉴于谷氨酰胺通量的独特变化,进一步追踪其代谢去向发现,老年小鼠在禁食和再喂食状态下均表现出谷氨酰胺循环通量升高(图3A)。双标记示踪实验证实,谷氨酰胺的¹³C标记更多进入α-酮戊二酸和柠檬酸,参与三羧酸循环的分解代谢,而未显著进入葡萄糖或乳酸(图3B);同时,谷氨酰胺的¹⁵N标记向支链氨基酸(缬氨酸、亮氨酸、异亮氨酸)的转移增加,提示转氨基通量升高(图3C)。这些结果表明,衰老过程中谷氨酰胺作为碳源和氮供体的利用效率均有所提升,可能为老年机体提供额外的能量和生物质合成原料。
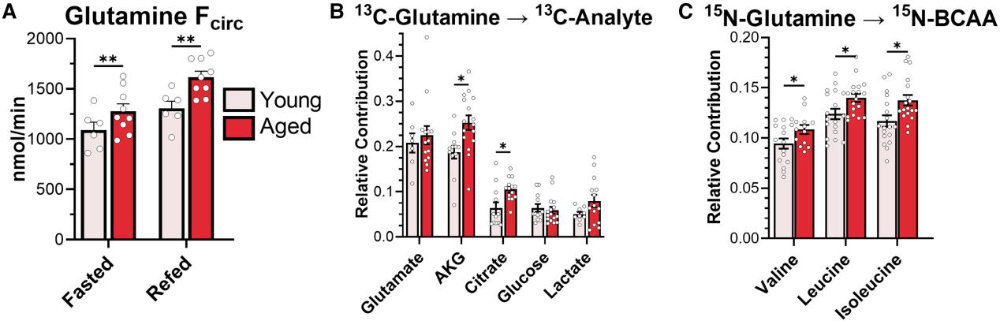
图3. 谷氨酰胺对下游代谢物贡献的年龄相关性增加
(四)赖氨酸分解代谢途径的选择性转变
老年小鼠血清赖氨酸浓度未发生年龄相关性变化,但氨基己二酸水平下降、哌啶酸水平升高,二者分别源自赖氨酸分解的saccharopine途径和哌啶酸途径(图4A)。通量分析显示,老年小鼠的赖氨酸循环通量保持稳定,但赖氨酸向哌啶酸的转化增加,向氨基己二酸的转化减少,且哌啶酸的循环通量显著升高(图4B、D)。组织代谢组分析进一步证实,多个组织中赖氨酸浓度下降,氨基己二酸浓度广泛降低,而哌啶酸浓度普遍升高(图4E),表明衰老诱导赖氨酸分解代谢从saccharopine途径向哌啶酸途径转变,可能通过改变代谢产物的生物学功能影响衰老进程。
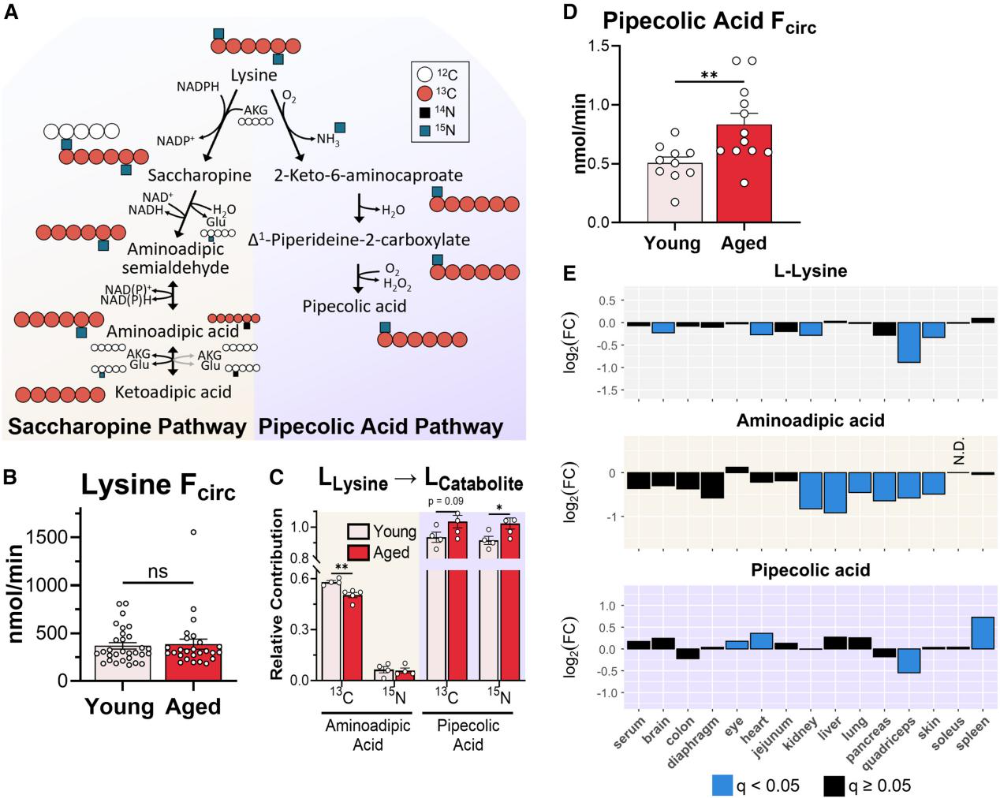
图4. 衰老重塑赖氨酸分解代谢,转向偏好哌啶酸途径
(五)牛磺酸代谢的组织特异性调控
牛磺酸被认为与衰老密切相关,但本研究发现老年小鼠的牛磺酸循环通量和血清浓度均未发生显著变化,与ob/ob小鼠的牛磺酸通量升高形成对比(图5A、B)。组织水平分析显示,牛磺酸浓度在肝脏、肺和胰腺中增加,在眼睛、股四头肌和皮肤中轻微减少(<10%)(图5C)。进一步检测牛磺酸相关代谢物发现,不饱和酰基牛磺酸(如N-油酰牛磺酸)在血清和组织中普遍增加,而亚牛磺酸浓度在所有检测组织中均显著下降(图5D、F),提示衰老主要影响牛磺酸的衍生物代谢,而非牛磺酸本身的稳态。
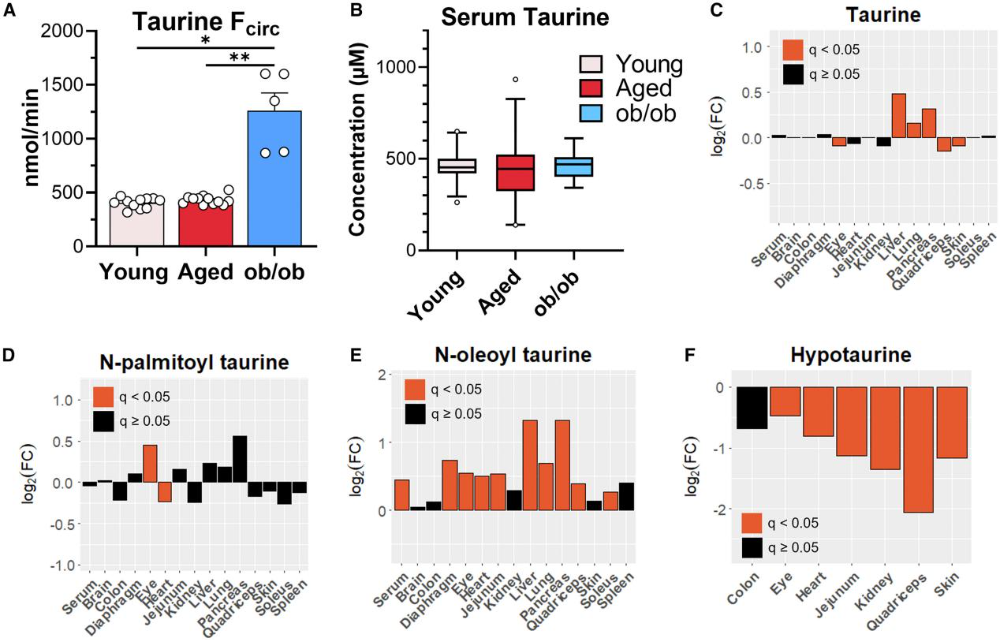
图5. 老年小鼠体内的牛磺酸水平与通量维持稳定
(六)组织代谢组的异质性与全局变化
15种组织的代谢组分析显示,衰老诱导的代谢变化具有显著组织特异性:大脑和肠道代谢组高度保守,眼睛、肾脏和皮肤的改变最为显著;在肌肉组织中,心脏、比目鱼肌等抗肌肉减少症组织的代谢变化小于股四头肌(图6A)。此外,血清代谢物的变化幅度通常大于组织,且肌肉和肾脏的代谢变化约50%可由血清代谢组解释,而肝脏、大脑与血清的相关性较弱,眼睛则呈负相关(图6B)。进一步筛选出19种广泛衰老敏感型代谢物,在至少7/15的组织中表现出一致的年龄相关性变化,涉及多不饱和脂肪酸、氨基酸、酰基甘氨酸等,其中丝氨酸、甘氨酸等一碳代谢相关氨基酸水平普遍下降(图6C、D)。
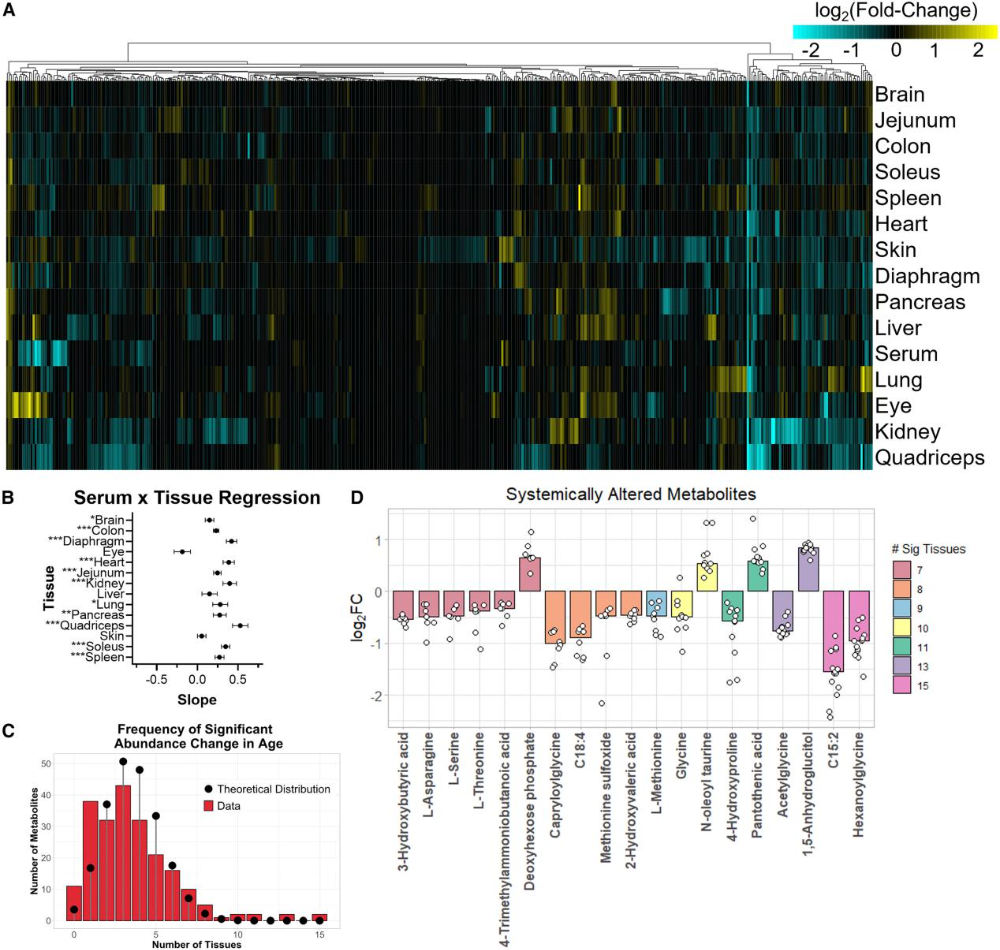
图6. 一部分代谢物在多数组织中发生变化
(七)非核心代谢物的通量与浓度协同变化
与核心代谢物不同,非核心代谢物的通量变化与浓度变化方向一致。例如,4-羟基脯氨酸、己酰甘氨酸和肉豆蔻酰肉碱(C14:0)的浓度在多组织中下降,其循环通量也显著降低;而1,5-脱水葡萄糖醇的浓度升高,通量亦增加(图7A、B)。更重要的是,这些非核心代谢物的通量变化幅度大于其平均丰度变化(图7C),表明核心代谢之外的途径在衰老过程中受到更强烈的调控,可能通过改变信号分子或功能代谢物的水平影响衰老表型。
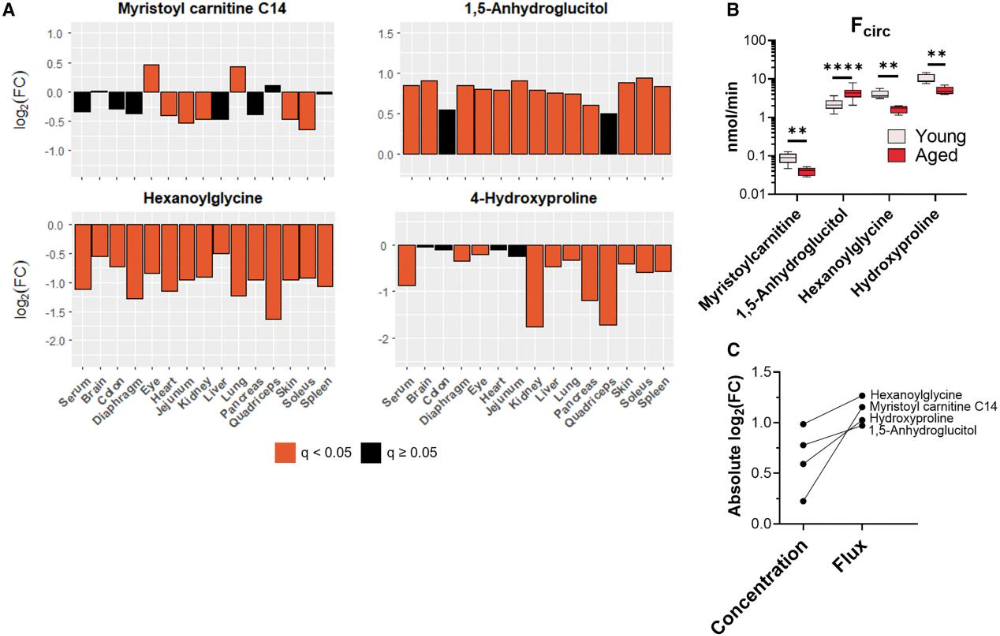
图7. 在多种组织中随年龄发生浓度变化的代谢物显示出相应的循环通量改变
四、结论
此研究通过代谢组学与稳定同位素示踪技术的整合应用,首次系统揭示了衰老过程中代谢系统的“稳健核心-灵活外周”调控模式:核心代谢通量维持稳定以保障基本生命活动,而非核心代谢通路和组织特异性代谢组发生广泛重构以适应年龄相关压力。衰老与肥胖通过不同机制调控代谢通量,谷氨酰胺代谢重构、赖氨酸分解途径转变及非核心代谢物的通量变化可能成为抗衰老干预的关键靶点。这些发现为深入理解衰老的代谢基础提供了重要理论依据,也为开发精准有效的抗衰老策略开辟了新的研究方向。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


