缺血性卒中(IS)作为脑动脉阻塞引发的脑组织缺血性梗死,其病理过程涉及神经胶质细胞与免疫细胞介导的复杂神经炎症和免疫反应。这些细胞在卒中后不同阶段呈现出损伤与修复的双重作用,是决定脑卒中预后的关键因素。本文基于首都医科大学金新春教授团队在《中国药理学报》发表的最新综述,系统阐述缺血性卒中急性期、亚急性期和慢性期神经胶质细胞与免疫细胞的功能动态变化,解析调控神经修复的关键信号通路,并总结中药及天然化合物、干细胞、生物材料等潜在治疗策略,为缺血性脑卒中的基础研究与临床转化提供新视角。

一、缺血性卒中不同时期的神经炎症与免疫介导机制
缺血性卒中的病理进程具有显著的时间依赖性,神经胶质细胞(小胶质细胞、星形胶质细胞、少突胶质细胞等)与免疫细胞(中性粒细胞、巨噬细胞、T细胞、B细胞等)的功能在急性期、亚急性期和慢性期呈现出截然不同的特征,共同构成神经损伤与修复的动态平衡。
(一)急性期:神经炎症驱动的损伤级联反应
卒中急性期(1天内),大脑缺血缺氧引发神经元快速损伤,释放活性氧物质(ROS)和损伤相关分子模式(DAMPs),通过激活小胶质细胞表面的Toll样受体(TLRs)启动先天免疫反应。激活的小胶质细胞大量分泌IL-1α、IL-1β、IL-6、IFN-γ和TNF-α等促炎性细胞因子,直接加剧神经元损伤,并诱导反应性星形胶质细胞产生。这些反应性星形胶质细胞释放可溶性毒素,破坏中枢神经系统神经元和成熟少突胶质细胞,同时炎症因子积累导致血脑屏障(BBB)受损。 外周免疫细胞的浸润进一步放大损伤效应:中性粒细胞通过产生活性氧、基质金属蛋白酶(MMPs)和中性粒细胞外陷阱(NETs)加重脑组织损伤;T细胞和B细胞浸润触发局部炎症级联反应,改变大脑微环境并加剧神经元死亡。此阶段,神经胶质细胞与免疫细胞的协同作用以促炎损伤为主,形成“损伤-炎症-进一步损伤”的恶性循环。
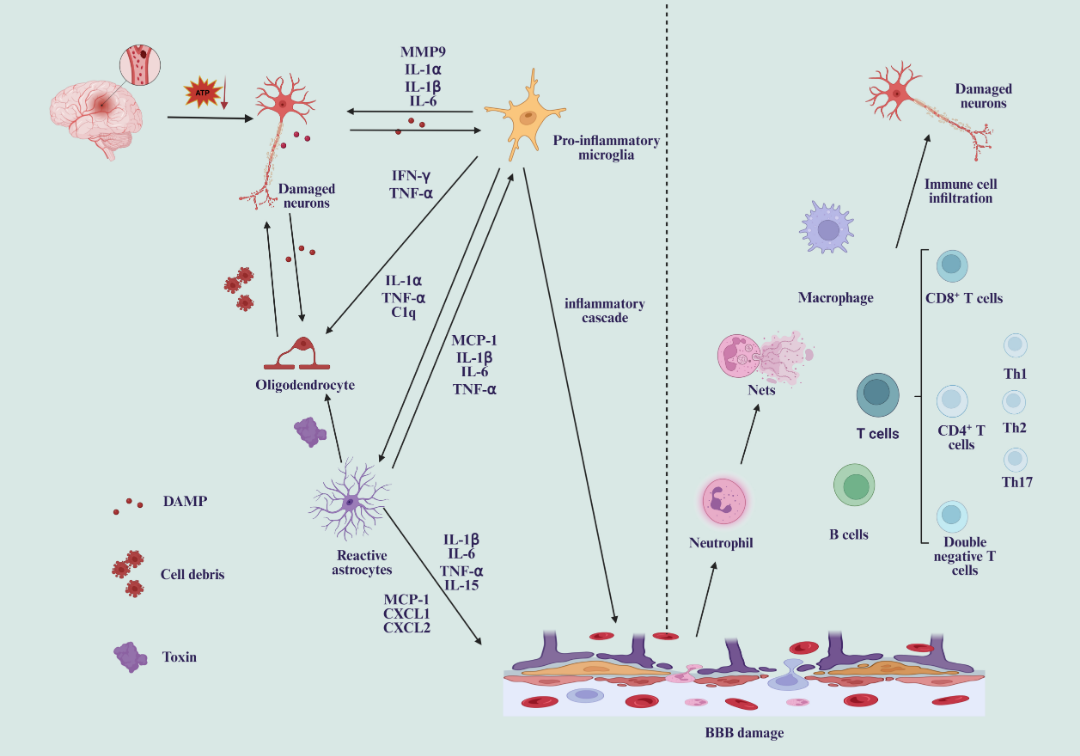
图 1. 缺血性损伤后,不同细胞来源引发的神经炎症和免疫介导的神经损伤
(二)亚急性期:损伤与修复的动态转换
亚急性期(1-7天)病变区域持续扩大,继发性缺血或再灌注损伤仍在进展,但组织修复机制已启动,呈现损伤与修复并存的特征。小胶质细胞作为中枢神经系统主要吞噬细胞,经历从M1型(促炎性)到M2型(抗炎性)的表型转换,通过髓系细胞触发受体2(TREM2)和CD36等分子增强吞噬活性,清除退化神经细胞及碎片,同时分泌抗炎因子促进组织修复。 星形胶质细胞通过反应性增殖形成保护性胶质瘢痕,借助水通道蛋白4(AQP4)调节减轻脑水肿,并分泌脑源性神经营养因子(BDNF)、星形胶质细胞衍生神经营养因子(GDNF)等神经生长因子,构建平衡炎症与修复的微环境。单核细胞/巨噬细胞在卒中后3天浸润达到峰值,部分表现为抗炎表型参与组织修复;调节性T细胞募集则有效抑制过度炎症反应,避免损伤扩大。
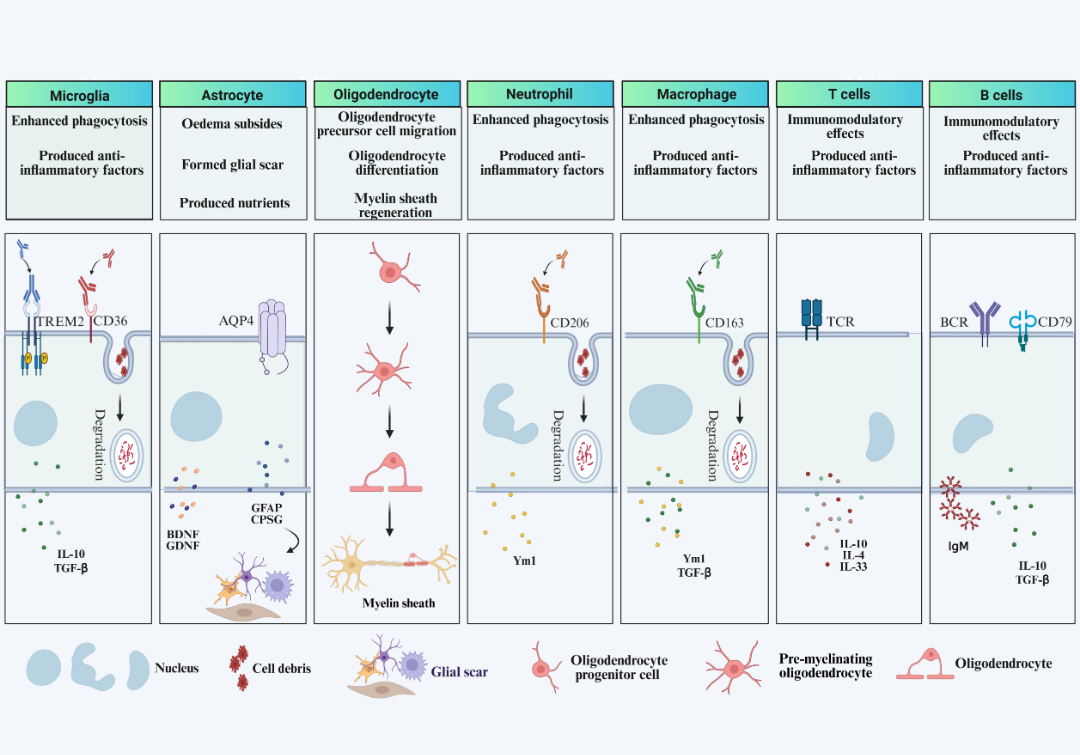
图 2.IS后不同细胞来源的神经炎症和免疫介导的神经修复示意图
(三)慢性期:组织重塑与修复-抑制的矛盾平衡
慢性期(超过7天)进入组织重塑阶段,神经胶质细胞与免疫细胞的功能以修复为主,但存在显著的调控矛盾。小胶质细胞完全极化为M2型,分泌TGF-β和IL-10等抗炎因子抑制慢性炎症,促进突触重塑,但持续激活可能引发持续性神经炎症。星形胶质细胞形成密集胶质瘢痕,通过上调GFAP和CSPGs隔离受损区域、阻止炎症扩散,但过度增殖会阻碍轴突再生和神经回路修复。 少突胶质前体细胞被激活并尝试分化为少突胶质细胞,促进髓鞘再生,其中小胶质细胞中TREM2表达上调对神经保护和白质修复具有关键作用。巨噬细胞以抗炎表型为主,调节性T细胞持续浸润维持免疫平衡,但异常激活的补体系统可能加重慢性损伤,使此阶段呈现“修复潜力与抑制因素共存”的复杂特征。
二、调控神经修复的关键信号通路
神经炎症和免疫反应的双面性由精密的信号通路网络调控,其中PD-1/PD-L、DAPK1和HDAC3-p65-cGAS-STING通路被证实是干预缺血性卒中的核心靶点,其机制解析为治疗策略开发提供了分子基础。
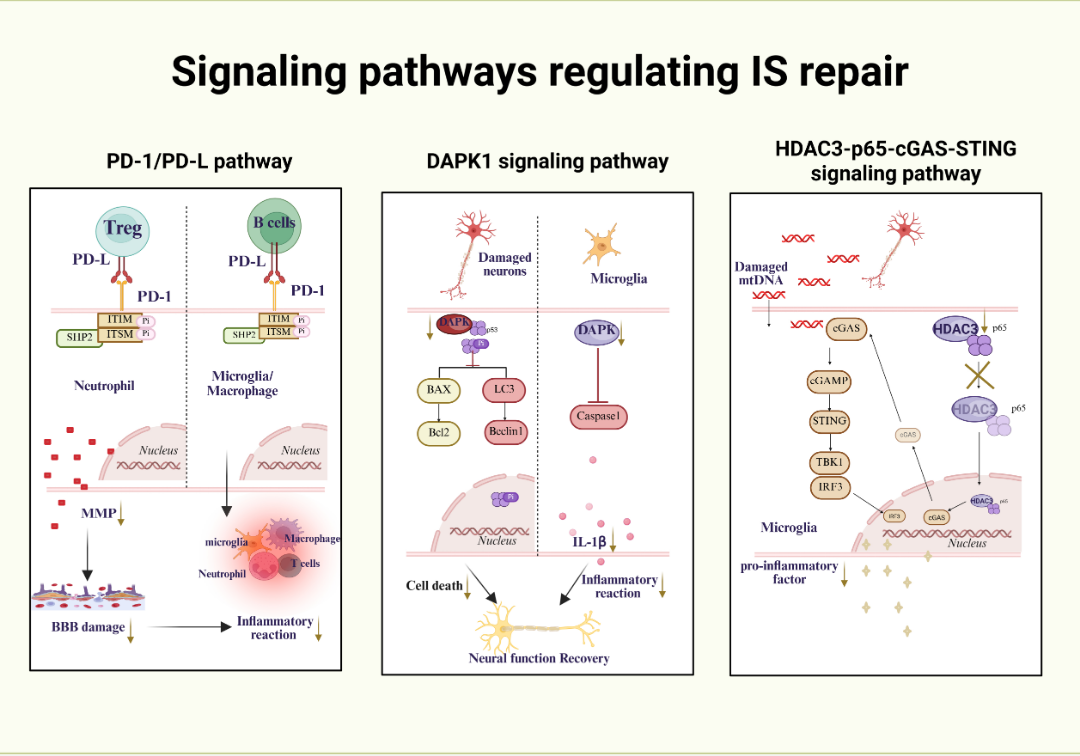
图3 .调节IS修复的信号通路
(一)PD-1/PD-L通路:免疫抑制与屏障保护
PD-1/PD-L通路通过双重机制调控卒中后炎症反应:一方面,炎症发生后PD-L1可诱导调节性T细胞抑制中性粒细胞产生MMP-9,减少血脑屏障损伤和免疫细胞浸润;另一方面,外周B细胞中PD-L1与微胶质细胞/巨噬细胞中PD-1结合,传递抑制信号,限制炎症细胞激活与募集,从而减轻过度炎症对脑组织的损伤。该通路的核心价值在于通过免疫 checkpoint 调控,平衡炎症反应与免疫耐受,避免“免疫过度激活”导致的二次损伤。
(二)DAPK1通路:凋亡与自噬的双重调控
死亡相关蛋白激酶1(DAPK1)在卒中后神经元损伤中发挥关键作用:受损神经元中DAPK1下调可通过抑制BAX/BCL2介导的细胞凋亡和LC3/Beclin1介导的自噬,减少神经元死亡并促进功能恢复;抑制小胶质细胞中DAPK1表达则可降低caspase-1/IL-1β的产生,减轻炎症反应并增强修复能力。该通路将细胞凋亡、自噬与炎症反应整合调控,为多靶点干预提供了可能。
(三)HDAC3-p65-cGAS-STING通路:炎症因子释放的分子开关
卒中后受损神经元释放线粒体DNA(mtDNA),激活小胶质细胞中组蛋白去乙酰化酶3(HDAC3)表达,进而促进环GMP-AMP合成酶(cGAS)表达,并通过调节p65蛋白的乙酰化与核定位激活cGAS-STING通路,最终促进促炎因子释放。抑制HDAC3表达可阻断该通路激活,减轻神经炎症并促进脑损伤修复。该通路揭示了“损伤信号-表观遗传调控-炎症激活”的分子链,为表观遗传干预策略提供了理论依据。
三、缺血性卒中的潜在治疗策略
基于神经胶质细胞与免疫细胞的双重作用及信号通路调控机制,近年来针对卒中后神经炎症和免疫反应的治疗策略取得显著进展,主要包括中药及天然化合物、干细胞疗法和生物材料三大方向。
(一)中药及天然化合物疗法
中医以多层次、多靶点整体调节为优势,通过调节神经炎症、改善微循环发挥作用。安宫牛黄丸可减弱巨噬细胞活性、调节外周免疫细胞亚群比例;丹酚酸 A、天麻素等天然成分能抑制炎症因子释放、减轻细胞凋亡与焦亡。丹参酮 IIA 磺酸盐、川芎嗪联合常规药物及银杏内酯注射液等已进入临床研究阶段,为卒中治疗提供了多元选择。
(二)干细胞疗法
干细胞通过调节炎症反应、修复受损组织发挥作用,间充质干细胞(MSCs)因来源广泛、免疫调节能力强成为研究热点,牙髓干细胞(DPSC)也展现出显著的抗炎和神经保护潜力。目前需解决安全性、给药途径、治疗时间窗口等临床挑战,通过基因编辑、联合疗法等技术优化推动转化应用。
(三)生物材料
生物材料可实现药物靶向递送与微环境重塑:水凝胶作为细胞移植载体,能释放营养物质、调节免疫反应;氧化铈纳米颗粒、磁性纳米微粒等可清除活性氧、调控巨噬细胞表型,减轻脑损伤。未来需基于老年动物模型开展研究,提高临床转化的可靠性。
四、总结与展望
神经胶质细胞与免疫细胞在缺血性卒中后呈现出显著的时间依赖性双重作用:急性期以促炎损伤为主,亚急性期损伤与修复并存,慢性期以组织重塑和修复为主但存在抑制因素。PD-1/PD-L、DAPK1和HDAC3-p65-cGAS-STING通路作为调控神经炎症和免疫反应的核心靶点,为精准干预提供了分子基础。中药及天然化合物、干细胞疗法和生物材料通过调节神经胶质细胞与免疫细胞功能、靶向关键信号通路,展现出良好的治疗潜力。 未来研究需进一步聚焦三个方向:
一是深入解析神经胶质细胞与免疫细胞的相互作用网络,明确不同细胞亚群的特异性功能;
二是优化现有治疗策略,解决干细胞疗法的安全性与靶向性、中药疗效的一致性等关键问题;
三是推动临床转化研究,采用老年动物模型和大样本临床试验,验证治疗策略的有效性与安全性。通过基础研究与临床实践的深度融合,有望实现对缺血性卒中神经损伤的精准调控,为患者提供更有效的治疗方案。
LabEx多款现货Panel支持脑卒中研究,欢迎咨询~
| 官网货号 | Panel | 技术平台 | 检测指标 |
| LXMH10-1 | 人炎症10因子Panel | MSD | IFN-γ,IL-1β,IL-2,IL-4,IL-6,IL-8,IL-10,IL-12p70,IL-13,TNF-α |
| LXLBH10-1 | 人炎症10因子Panel | Luminex | IL-1 β/IL-1F2,IL-2,IL-4,IL-6 ,IL-8/CXCL8,IL-10,IL-12 p70,IL-13,TNF-α,IFN-γ |
| LXMM10-1 | 小鼠炎症10因子Panel | MSD | IFN-γ,IL-1β,IL-2,IL-4,IL-5,IL-6,IL-10,IL-12p70,KC/GRO,TNF-α |
| LXLBM10-1 | 小鼠炎症10因子Panel | Luminex | IL-1 β/IL-1F2,IL-2,IL-4,IL-5,IL-6 ,IL-10,IL-12p70,CXCL1/GRO/α/KC/CINC-1,IFN-γ,TNF-α |
| LXLBR10-1 | 大鼠炎症10因子Panel | Luminex | IL-1 β/IL-1F2,IL-2,IL-4,IL-5,IL-6 ,IL-10,IL-12p70,CXCL1/GRO/α/KC/CINC-1,IFN-γ,TNF-α |
| LXLBM31-1 | 小鼠趋化因子-31因子Panel | Luminex | BCA-1/CXCL13,CTACK/CCL27,ENA-78/CXCL5,Eotaxin/CCL11,Eotaxin-2/CCL24,Fractalkine/CX3CL1,GM-CSF,I-309/CCL1,IFN-γ,IL-1β,IL-2,IL-4,IL-6,IL-10,IL-16,IP-10/CXCL10,I-TAC/CXCL11,KC/CXCL1,MCP-1/CCL2,MCP-3/CCL7,MCP-5/CCL12,MDC/CCL22,MIP-1α/CCL3,MIP-1β/CCL4,MIP-3α/CCL20,MIP-3β/CCL19,RANTES/CCL5,SCYB16/CXCL16,SDF-1α/CXCL12,TARC/CCL17,TNF-α |
| LXLRH46-1 | 人细胞因子-46因子Panel | Luminex | CCL2/JE/MCP-1,CCL3/MIP-1 alpha,CCL4/MIP-1 beta,CCL5/RANTES,CCL11/Eotaxin,CCL19/MIP-3 beta,CCL20/MIP-3 alpha,CD40 Ligand/TNFSF5,CXCL1/GRO alpha/KC/CINC-1,CXCL2/GRO beta/MIP-2/CINC-3,CXCL10/IP-10/CRG-2,EGF,FGF basic/FGF2/bFGF,Flt-3 Ligand/FLT3L,G-CSF,GM-CSF,Granzyme B,IFN-alpha 2/IFNA2,IFN-beta,IFN-gamma,IL-1 alpha/IL-1F1,IL-1 beta/IL-1F2,IL-1ra/IL-1F3,IL-2,IL-3,IL-4,IL-5,IL-6,IL-7,IL-8/CXCL8,IL-9,IL-10,IL-12 p70,IL-13,IL-15,IL-17/IL-17A,IL-17E/IL-25,IL-33,Lymphotoxin-alpha/TNF-beta,PD-L1/B7-H1,PDGF-AA,PDGF-AB/BB,TGF-alpha,TNF-alpha,TRAIL/TNFSF10,VEGF |
| LXLBH48-1 | 人细胞因子-48因子Panel | Luminex | β-NGF,CTACK/CCL27,Eotaxin/CCL11,FGF-basic,G-CSF,GM-CSF,GRO-α (Gro-a/KC/CXCL1),HGF,IFN-α2,IFN-γ,IL-1α,IL-1Rα,IL-2Rα,IL-1β,IL-2,IL-3,IL-4,IL-5,IL-6,IL-7,IL-8/CXCL8,IL-9,IL-10,IL-12(p40),IL-12(p70),IL-13,IL-15,IL-16,IL-17A,IL-18,IP-10/CXCL10,LIF,M-CSF,MCP-1/CCL2,MCP-3/CCL7,MIG,MIP-1α/CCL3,MIP-1β,MIF,PDGF-BB,RANTES,SCF,SCGF-β,SDF-1α,TRAIL,TNF-α,TNF-β,VEGF-A |












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


