一、TRIzol法提取总RNA技术概述
(一) 实验原理
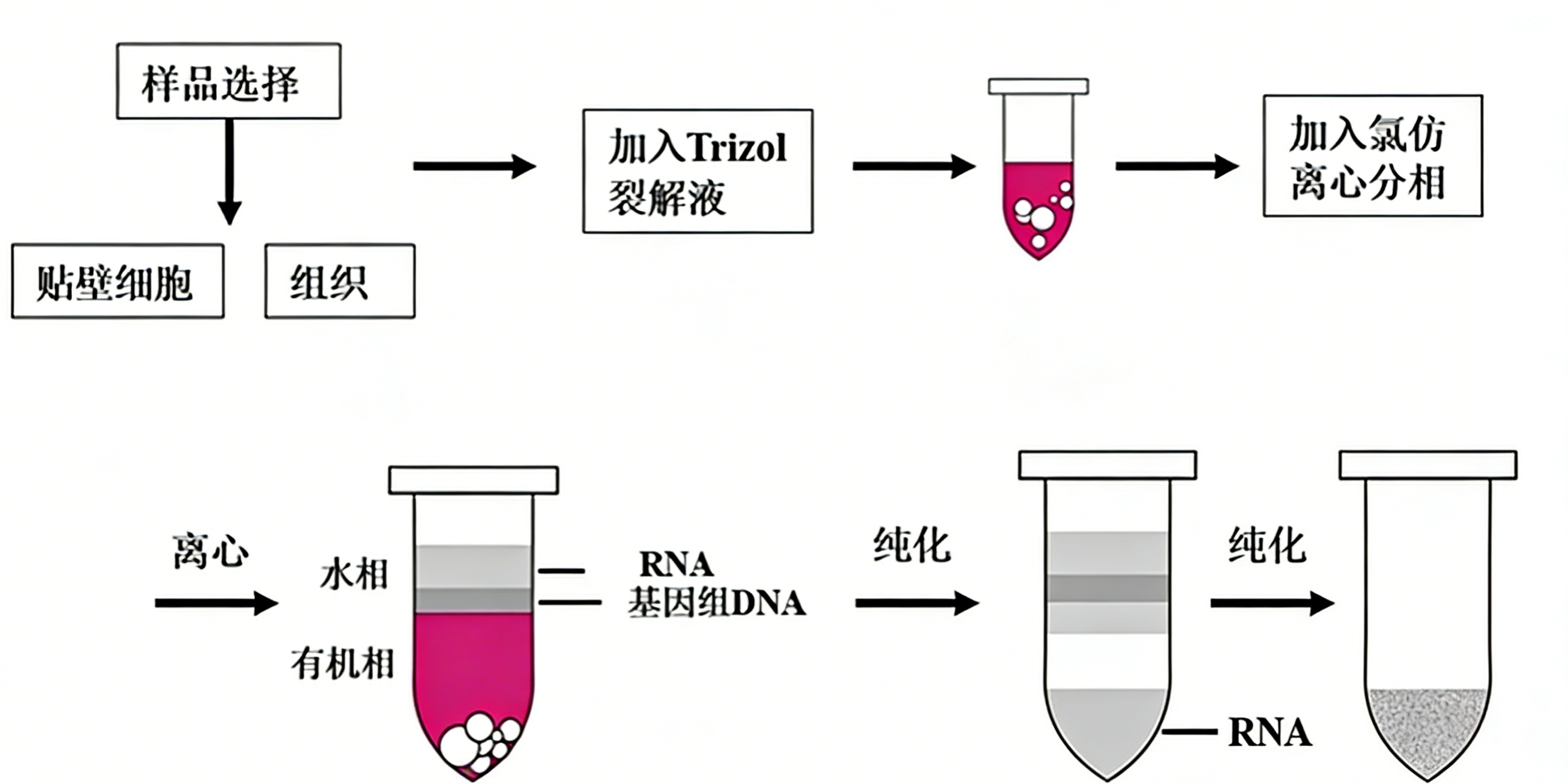
TRIzol法是一种基于相分离原理,可从多种生物样本(如动物组织、培养细胞、植物材料及细菌)中快速、有效提取总RNA的常用方法。其核心试剂为含有异硫氰酸胍、苯酚、β-巯基乙醇及8-羟基喹啉等成分的单一组分裂解液。在匀浆或裂解过程中,该试剂能迅速破坏细胞结构,同时强效抑制内源性及外源性核糖核酸酶(RNase)活性,从而保证RNA在提取过程中的完整性。
加入氯仿并离心后,溶液分为三相:上层为含有RNA的水相;中间层主要为变性的DNA及蛋白质;下层为有机相。通过选择性回收水相,并使用异丙醇沉淀其中的RNA,即可实现RNA与大部分DNA及蛋白质的分离。后续采用乙醇洗涤以去除残留杂质,最终将纯净的RNA沉淀溶解于无RNase水中备用。
(二) 关键试剂及其作用机制
👉异硫氰酸胍:一种强效的蛋白质变性剂和离液剂。它能破坏蛋白质的高级结构,导致细胞裂解,并使核蛋白复合体解离,从而高效释放核酸,同时使蛋白质(包括RNase)变性失活。
👉苯酚与8-羟基喹啉:苯酚是强烈的蛋白质变性剂,能有效促使蛋白质与核酸解离,并进一步使RNase失活。8-羟基喹啉作为抗氧化剂和金属离子螯合剂加入,可与氯仿协同作用,增强对RNase活性的抑制。
👉β-巯基乙醇:作为还原剂,能断裂蛋白质(包括RNase)中的二硫键,辅助破坏其空间构象,增强对RNase活性的抑制效果。
👉氯仿:主要功能是促进相分离,使水相与有机相分层更迅速、界面更清晰。它也有辅助变性蛋白质和去除核酸溶液中微量苯酚的作用。离心后,RNA选择性分配于上层水相。
👉异丙醇:用于沉淀水相中的RNA。其沉淀核酸的选择性与浓度有关,在特定条件下主要沉淀较大分子量的RNA(如rRNA、mRNA),对某些小分子RNA(如5S rRNA、tRNA)沉淀效率可能较低。因此,电泳图谱中5S rRNA条带信号弱,并不一定意味着RNA发生降解。
👉乙醇(75%):主要用于洗涤RNA沉淀,以去除残留的异丙醇、盐离子及其他可溶性杂质,提高RNA纯度。低浓度的乙醇易于挥发,不会干扰后续实验。
(三) 方法特点
该方法具有操作简便、适用范围广、提取快速等优点。实验前需确保准备好关键试剂(TRIzol试剂、氯仿、异丙醇、75%乙醇、无RNase水)及经无RNase处理的耗材(如离心管、枪头等),以避免RNA在操作过程中被降解。
二、实验操作流程与质量评估
(一) RNA提取步骤
1、样本裂解与匀浆
✔️培养细胞:收集处于对数生长期的细胞(通常建议细胞汇合度达80%以上)。去除培养基后,每孔加入适量预冷的TRIzol裂解液,并反复吹打以充分裂解细胞。裂解产物可在室温静置5分钟,以确保核酸与蛋白质复合物充分分离。若后续无法立即处理,裂解液可置于-80℃条件下长期保存。
✔️组织样本:将适量新鲜或冻存组织置于预冷的匀浆管中,并加入适量TRIzol裂解液。使用组织匀浆仪进行充分匀浆,注意组织体积不应超过裂解液体积的10%,以确保有效的裂解效率。
2、相分离
✔️向上述均质化的裂解产物中加入氯仿,其加入体积约为TRIzol原体积的20%。随后温和地颠倒混匀(避免使用涡旋振荡器,以防基因组DNA发生机械剪切),室温静置2-3分钟。
✔️在4℃条件下,以12,000 × g的离心力离心15分钟。离心后溶液将分为三层:上层为含有RNA的无色水相;中间层为蛋白质与DNA构成的白色界面;下层为苯酚-氯仿有机相。
3、RNA沉淀与洗涤
✔️小心地将上层水相转移至一个新的无RNase离心管中,操作时应严格避免触及中间层。若需同时提取DNA或蛋白质,可保留有机相于4℃暂存。
✔️向含有水相的离心管中加入等体积的异丙醇,温和地上下颠倒混匀,室温静置5-10分钟以沉淀RNA。
✔️在4℃条件下,以12,000 × g的离心力离心10分钟,可见RNA沉淀于管底或管壁。
✔️小心弃去上清液,加入适量预冷的75%乙醇(用无RNase水配制),轻柔吹打或涡旋以洗涤RNA沉淀。
✔️在4℃条件下,以12,000 × g的离心力再次离心5分钟,弃去乙醇上清。
4、RNA溶解
✔️短暂离心并吸除残留的乙醇,将离心管盖打开,置于超净工作台中风干片刻(通常3-5分钟)。注意避免RNA沉淀完全干燥,否则将难以重新溶解。
✔️根据预期的RNA产量,加入适量无RNase水溶解沉淀。
(二) RNA浓度与纯度测定
通常使用微量分光光度计或NanoDrop系统进行测定。其原理基于核酸与杂质在特定波长下的吸光度差异:
RNA在260 nm波长处有最大吸收峰,其浓度计算公式为:浓度 (μg/mL) = OD260 × 稀释倍数 × 40。此公式适用于OD260读数在0.1至1.0的线性范围内。
RNA纯度通过特定波长吸光度比值进行评估:
OD260/OD280比值:理想值为1.9至2.1,表明RNA纯度良好。若比值低于1.9,提示可能存在蛋白质污染;若比值高于2.1,则提示RNA可能发生降解。
OD260/OD230比值:理想值应大于2.0。若比值低于2.0,提示可能存在盐离子、有机溶剂(如胍盐、酚、乙醇)等污染。
(三) RNA完整性评估
常用琼脂糖凝胶电泳进行直观评估。使用非变性或变性琼脂糖凝胶,上样并电泳后,使用核酸染料(如溴化乙锭或更安全的替代染料)进行染色观察。
高质量的总RNA电泳图谱应呈现三条清晰的核糖体RNA条带:真核生物样本通常可见28S、18S和5S rRNA。其中,28S rRNA条带的强度应约为18S rRNA条带的两倍,且所有条带边缘锐利,无明显拖尾现象。
若RNA严重降解,则表现为条带弥散或核糖体RNA特征条带消失。
若在加样孔内或孔附近观察到明亮的荧光条带,则提示可能存在基因组DNA污染。
三、注意事项与常见问题分析
(一)RNA无沉淀或得率低
1、样本处理不充分:组织或细胞匀浆不彻底时,高分子量的基因组DNA会与变性蛋白质结合形成黏稠的絮状复合物,将RNA包裹其中,阻碍其有效释放。同时,若样本起始量过低而裂解液体积相对过大,会导致RNA浓度过度稀释,异丙醇沉淀效率显著下降。
2、样本量与试剂比例失衡:样本量过多会降低匀浆效率,导致单位体积内DNA与蛋白质含量过高,进而影响RNA的释放以及后续的相分离效果,最终降低RNA沉淀得率。此外,TRIzol裂解液用量不足可能使裂解体系pH值偏离酸性范围(理想状态为pH 4.5-5.0),在此条件下DNA可能进入水相而非沉淀于界面,从而竞争性地影响RNA的沉淀效率。因此,需在保证提取量的前提下,确保裂解液足量。
3、操作细节问题:
👉吸取上层水相时若不慎混入中间层或下层有机相,会引入蛋白质、DNA及有机溶剂污染,影响后续沉淀。
👉裂解后室温静置时间不足5分钟,可能导致核蛋白复合物解离不完全。
👉沉淀后的RNA若未能完全溶解,也会导致实测得率偏低。
(二)RNA降解
RNA极易降解,需严格防控核糖核酸酶(RNase)污染并优化操作流程:
1、样本保存与状态:样本采集后应尽快处理,避免细胞生长过度或组织自溶。若无法立即提取,应于-80℃条件下保存。
2、实验环境与耗材:实验全程需佩戴手套,并确保所有接触样本的器材(如离心管、移液器吸头、工作台面等)均经过无RNase处理。
3、试剂污染:需确保所使用的氯仿、异丙醇、乙醇及无RNase水等试剂未被RNase污染。
4、操作过程:建议在低温环境下(如冰上)进行操作,并使用预冷的离心机。吸取水相时应谨慎操作,宁可牺牲少量上清液也要避免触及中间蛋白层,因残留的蛋白质可能含有RNase。使用75%乙醇洗涤RNA沉淀的步骤需执行到位,但洗涤时间不宜过长以减少RNA暴露于潜在风险的时间。
5、RNA保存:溶解后的RNA在溶液中呈酸性,易发生自发水解,应分装后于-70℃或更低温度下保存,并尽可能避免反复冻融。
(三)基因组DNA污染
👉裂解不充分:当裂解液用量不足或样本量过大时,可能导致裂解体系pH值不处于最佳酸性范围,致使部分DNA未能沉淀于界面而残留于水相。
👉操作引入:由于DNA分子量大,常与变性蛋白质结合存在于中间层。在转移水相时,应避免过度吸取,可保留紧邻中间层的少量水相,以最大限度减少DNA的共提取。
(四)RNA提取的技术挑战
1、RNA分子固有的不稳定性:RNA为单链分子,且核糖2‘-羟基的存在使其在化学上比DNA更易发生水解。
2、RNase的普遍性与高稳定性:RNase广泛存在于环境及生物样本中,且耐受高温及变性剂,灭活困难。
3、样本复杂性:某些样本类型中RNA丰度较低,或含有大量多糖、多酚、脂类等次生代谢产物,这些物质会干扰裂解、相分离及沉淀过程,降低RNA的提取效率与纯度。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


