人类大脑皮层作为神经系统的最高级认知功能中心,其结构与功能的复杂性源于约160亿个神经元的精密调控与协同作用。其中,谷氨酸能兴奋性神经元与γ-氨基丁酸能抑制性神经元构成了神经网络的核心平衡体系,后者被形象地称为“大脑的刹车系统”,其数量与比例的动态平衡是维持大脑正常认知、情绪与运动功能的关键。抑制性神经元的发育异常的失衡,是癫痫、自闭症、精神分裂症等多种神经发育疾病的重要诱因。
在生物进化历程中,人类大脑皮层的显著扩张伴随抑制性神经元数量与比例的同步增加,但人类大脑抑制性神经元的有序产生机制、数量扩增的细胞基础,以及其与灵长类大脑进化的关联,长期以来都是神经科学领域亟待解决的核心科学问题。近日,清华大学米达团队联合中国医学科学院北京协和医院朱兰院士团队,在《Science》期刊发表突破性研究成果,综合运用单细胞转录组学、GeoMx DSP数字空间组学、活细胞成像等多维度前沿技术,对人类胎儿内侧神经节隆起(MGE)脑区的发育过程进行系统性解析,首次鉴定出灵长类特有的神经干细胞类型,揭示了人类大脑抑制性神经元发育的关键机制,并提出了阐释人类大脑皮层进化的“双引擎模型”,为神经发育疾病的机制研究与干预策略开发提供了全新的理论基础。

一、研究背景与技术瓶颈
哺乳动物大脑皮层的抑制性神经元主要起源于腹侧端脑的内侧神经节隆起(MGE)脑区,传统研究通过小鼠模型对该脑区的神经发生规律有了初步认知,但灵长类与啮齿类动物的大脑发育存在显著差异,小鼠模型的研究结果难以直接推演至人类。此外,人类胎儿MGE脑区存在直径仅50-200μm的密集神经元巢(DENs),这类微小特化微结构是抑制性神经元发育的关键场所,但传统空间转录组技术分辨率有限,无法实现对这类微小结构的特异性转录组解析,难以建立单细胞分子特征与组织空间功能的关联,成为制约研究深入的核心技术瓶颈。
数字空间组学技术的快速发展为解决上述难题提供了可能,其中GeoMx DSP数字空间多组学分析系统凭借其高分辨率、高特异性的优势,可在保留组织空间结构完整性的基础上,实现对特定细胞亚群或微小结构的全转录组与蛋白的精准定量分析,完美突破了传统技术的局限性,成为本研究解析MGE脑区空间调控机制的关键工具。
二、研究材料与核心技术方法
本研究的顺利开展,首先得益于珍贵的样本支撑与多技术的整合应用。研究团队依托北京协和医院朱兰院士团队构建的标准化人类胎儿生物样本库,成功获取了人类胎儿MGE脑区妊娠9周(GW9)至39周(GW39)的完整发育阶段组织样本,覆盖了抑制性神经元产生的关键时期,为绘制时空发育图谱提供了核心基础。
为实现从单细胞水平到组织空间水平的系统性解析,研究整合了多维度前沿生物技术,形成了完善的研究技术体系:一是单细胞转录组学技术,对MGE脑区细胞进行单细胞测序与精细聚类分析,精准鉴定细胞类型及各类型细胞的分子特征;二是GeoMx DSP数字空间组学技术,通过DCX免疫荧光引导下的感兴趣区域(ROI)精准圈选,对21个DENs进行特异性转录组解析,获取每个微小结构的独立全转录组数据;三是活细胞成像与单细胞克隆谱系追踪技术,直观解析新型神经干细胞的分裂模式与神经发生周期,验证其神经元产生功能;四是跨物种比较分析,对比人类、猕猴与小鼠MGE脑区的细胞类型组成,明确灵长类特有的细胞亚型;五是时空图谱绘制技术,结合分子标记与空间定位信息,构建人类MGE脑区神经发生的完整时空发育图谱。
三、核心研究发现
(一)鉴定灵长类特有神经干细胞SVZ RGC
研究团队通过单细胞转录组与空间转录组的联合分析,首次在人类胎儿MGE脑区鉴定出一类新型神经干细胞——脑室下区放射状胶质细胞(SVZ RGC),该细胞为灵长类特有,在小鼠大脑中未发现同源类型,是人类大脑抑制性神经元数量扩增的关键“生产基地”。
SVZ RGC具有独特的分子特征与空间分布规律,其高表达DACH1、FBLN7、CACNA1E等基因,其中转录因子DACH1是识别该细胞的特异性分子标记;空间上,SVZ RGC主要聚集于MGE脑区的脑室下区(SVZ),在GW13、GW18、GW26等关键发育阶段的胎儿脑切片中,呈环状结构包围在DENs(高密度DCX阳性新生神经元巢)周围,形成特有的“巢状”空间结构,发挥守护新生神经元、调控其发育成熟的作用。功能上,SVZ RGC通过独特的分裂模式与延长的神经发生周期,在人类胎儿期持续稳定地产生皮层及亚皮层GABA能抑制性神经元与神经胶质细胞,为人类大脑抑制性神经元的数量扩增提供了额外的细胞来源,这也是人类大脑皮层相较于其他物种能够实现显著扩张且维持功能平衡的关键原因之一。
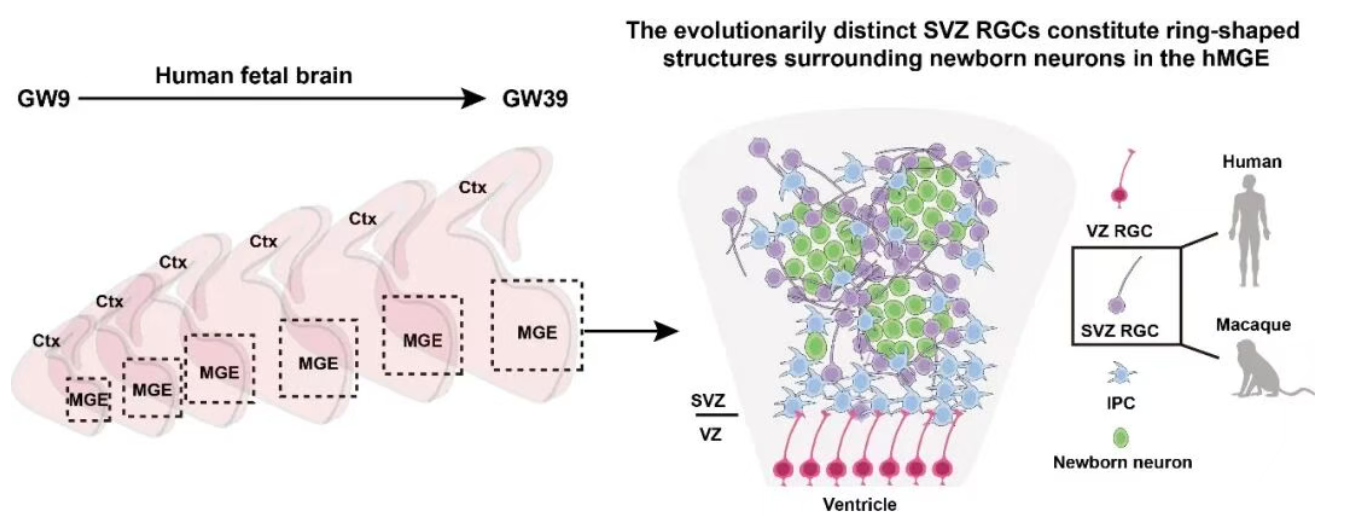
人类内侧神经节隆起中不同细胞类型的鉴定。图中采用不同的形态与颜色标示各异的细胞类型。
Jia L, Li X, et al. Subventricular zone radial glial cells maintain inhibitory neuron production in the human brain. Science. 2026 Jan 15;391(6782):eadw1803.
(二)揭示“空间即命运”的发育调控机制
研究团队通过时空图谱分析,首次在人类MGE中划分出精细的神经祖细胞域,并揭示了抑制性神经元多样性产生的核心机制——“空间即命运”。人类MGE脑区存在高度区隔化的神经祖细胞域,不同祖细胞域与特定抑制性神经元谱系呈一一对应关系,例如LHX8/ISL1+祖细胞域主要产生胆碱性能抑制性神经元,EPHA5/MEF2C+祖细胞域则专门产生皮层GABA能抑制性神经元。
同时,神经发生过程呈现明显的时空有序性:发育早期(GW9/10),脑室区(VZ)的LHX8/ISL1+与NR2F1/NR2F2+祖细胞域是神经发生的主要场所,主要产生亚皮层抑制性神经元;发育后期(GW13至GW39),神经发生的核心逐渐转移至SVZ区的EPHA5/MEF2C+、CRABP1/ANGPT2+与LHX6/NFIA+祖细胞域,重点产生皮层抑制性神经元。这一规律表明,抑制性神经元的类型在祖细胞阶段即已确定,其发育命运受“出生地”(空间位置)与“出生时间”(发育阶段)的双重严格调控,该机制保证了不同类型抑制性神经元按正确比例与时间产生,进而维持神经网络的动态平衡。
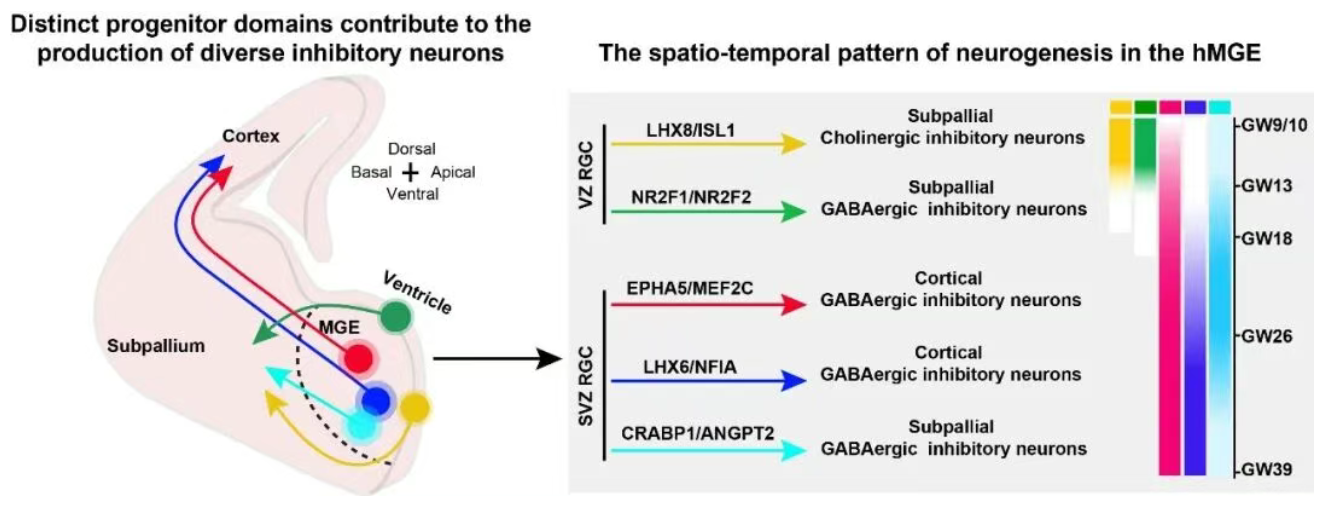
人类内侧神经节隆起神经发生的时空动态。图中不同颜色的圆圈对应不同的祖细胞域,箭头颜色则标示了由此产生的特定神经元谱系。
Jia L, Li X, et al. Subventricular zone radial glial cells maintain inhibitory neuron production in the human brain. Science. 2026 Jan 15;391(6782):eadw1803.
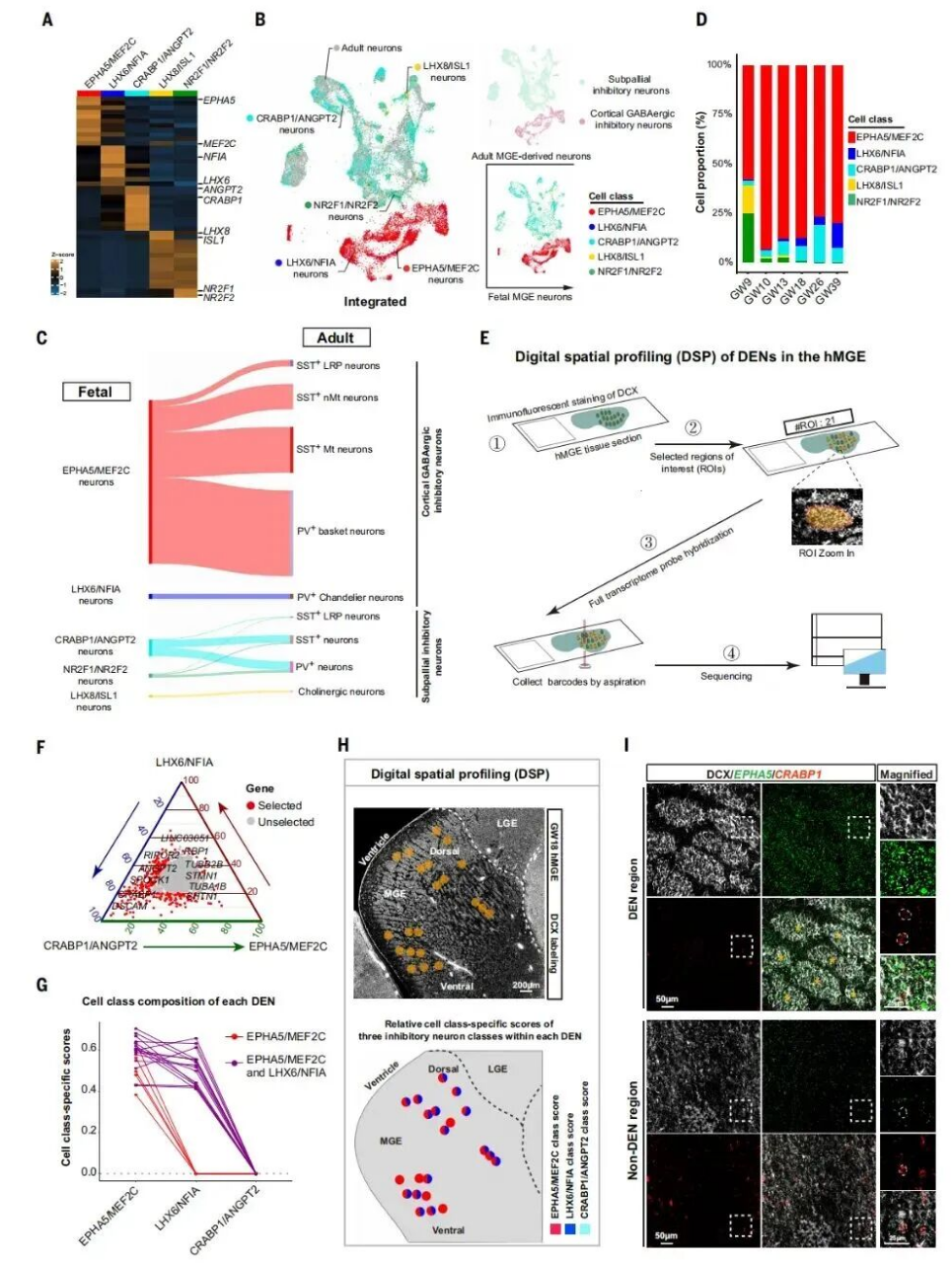
Jia L, Li X, et al. Subventricular zone radial glial cells maintain inhibitory neuron production in the human brain. Science. 2026 Jan 15;391(6782):eadw1803.
(三)提出大脑皮层进化的“双引擎模型”
基于上述研究发现,研究团队提出了阐释人类大脑皮层进化的“双引擎模型”,揭示了人类大脑皮层扩张与功能复杂化的核心进化机制。该模型指出,人类大脑皮层的扩张由两类进化上独特的神经干细胞协同驱动,二者分别调控兴奋性与抑制性神经元的数量扩增,共同维持兴奋-抑制网络的动态平衡。
其中,背侧端脑的外侧放射状胶质细胞(oRG)作为“兴奋性神经元工厂”,主导大脑皮层兴奋性神经元的数量扩增,为皮层体积的显著扩张提供了基础;而腹侧端脑的SVZ RGC作为灵长类特有的神经干细胞,专门驱动抑制性神经元数量与比例的同步增加,确保了扩张后皮层神经网络的功能平衡。这一模型证实,人类大脑无与伦比的结构与功能复杂性,源于进化上特有的神经干细胞类型与精密的发育调控机制,为理解灵长类大脑的进化规律提供了全新的理论框架。
(四)GeoMx DSP技术的核心突破
在本研究中,GeoMx DSP数字空间组学技术发挥了不可替代的关键作用,实现了多项技术突破。传统空间转录组技术无法实现对DENs这类50-200μm微小特化微结构的特异性分析,而GeoMx DSP技术通过免疫荧光引导的ROI精准圈选,首次成功获取了MGE脑区21个DENs的独立全转录组数据,明确证实DENs是皮层定向GABA能神经元的特化微环境,而亚皮层GABA能神经元被排除于DENs之外。
此外,该技术还揭示了人类MGE脑区通过空间区隔化策略同步调控不同命运神经元产生的核心规律,有力证明了空间定位在神经发生调控中的决定性作用,成功实现了单细胞身份与组织结构功能的精准连接。GeoMx DSP技术本身具备兼容FFPE、新鲜冻存等多种样本类型的优势,可同时实现1200+种蛋白与~20000个RNA的空间原位表达谱检测,为复杂神经组织的微环境解析提供了可复制、可推广的技术范式。
四、研究价值与技术支撑
(一)科研意义
本研究成果具有深远科学意义,首次系统绘制人类胎儿MGE脑区神经发生时空图谱,鉴定出灵长类特有的SVZ RGC,填补了人类MGE脑区发育细胞图谱的空白,明确了人类大脑抑制性神经元数量扩增的关键细胞基础。研究提出的“双引擎模型”,更为解析人类大脑皮层的发育与进化规律,提供了核心的细胞与分子证据。
(二)DSP空间多组学分析哪个公司有?
作为成熟的技术服务平台,乐备实(LabEx)已搭建完善的DSP技术体系,可实现组织原位蛋白与RNA共检测,单样本覆盖近20000种RNA与140+种蛋白,提供标准化全转录组检测与定制化研究方案,兼容多种样本类型且能精准圈选任意ROI区域,既能突破传统空间转录组技术局限,为神经科学、肿瘤学等领域的基础与转化研究提供高精准技术支撑,也可凭借高靶点检测和多维度数据分析能力,助力同类神经发育疾病的临床转化探索,以及大脑发育、进化等前沿方向的深入研究。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


