摘要
免疫检查点抑制剂的临床获益依赖于肿瘤抗原特异性T细胞的抗肿瘤作用,目前研究多聚焦于CD8+T细胞,而肿瘤微环境中CD4+T细胞的异质性与功能调控尚未明确。本研究利用BD Rhapsody单细胞多组学结合AbSeq技术,整合单细胞转录组、细胞膜表面蛋白组及TCR测序,系统性解析人类黑色素瘤中肿瘤新抗原特异性CD4+T细胞的表型特征与分化状态。研究发现CXCL13高表达为黑色素瘤抗原特异性CD4+T细胞的核心表型,97%的肿瘤特异性CD4+T细胞富集于CXCL13+PD-1high亚群,且该细胞亚群比例与患者生存率呈正相关,同时与肿瘤微环境中CD8+T细胞、巨噬细胞及B细胞的活化功能密切协同。本研究为肿瘤免疫治疗中CD4+T细胞的研究提供了新的技术框架与分子靶点,也为免疫治疗疗效评估提供了潜在的生物标志物。

一、引言
肿瘤免疫治疗的发展为黑色素瘤等恶性肿瘤的治疗带来了突破性进展,免疫检查点抑制剂通过激活肿瘤抗原特异性T细胞实现抗肿瘤效应,其中CD8+细胞毒性T细胞的作用已得到广泛证实。但肿瘤微环境是复杂的免疫调控网络,CD4+T细胞作为重要的免疫调节细胞,其在肿瘤免疫中的表型异质性、抗原特异性及与其他免疫细胞的协同作用尚未被充分解析。传统研究技术难以在单细胞水平同时实现基因、蛋白及TCR克隆型的联合分析,限制了对CD4+T细胞功能状态的精准刻画。单细胞多组学技术的发展为解决这一问题提供了可能,BD Rhapsody平台结合AbSeq技术可实现单细胞水平转录组与蛋白组的同步检测,结合TCR测序能进一步实现TCR克隆型与细胞表型的精准映射。本研究通过该技术体系解析黑色素瘤浸润CD4+T细胞的特征,旨在挖掘肿瘤抗原特异性CD4+T细胞的分子标志物与功能调控机制,为优化肿瘤免疫治疗策略提供实验依据。
二、材料与方法
(一)研究样本
本研究设置两个研究队列,队列1包含4例黑色素瘤患者(2例肿瘤组织样本X205、X422,2例接受细胞治疗后的血液样本X197、X198),用于筛选肿瘤反应性CD4+T细胞并鉴定TCR克隆型;队列2包含20例人黑色素瘤患者肿瘤样本,用于验证细胞聚类特征及预后相关性。同时利用TCGA数据库中471例黑色素瘤Bulk RNA-Seq数据及乳腺癌单细胞公共数据库数据,进行跨癌种验证分析。
(二)实验技术
采用流式细胞术分选肿瘤浸润CD4+T细胞、CD8+T细胞及髓系细胞;通过Bulk TCRVb测序鉴定肿瘤特异性CD4+T细胞的TCR克隆型序列;利用BD Rhapsody单细胞多组学平台,结合34AbSeq+SMK+TTA+TCR及53AbSeq+SMK+TTA+TCR+BCR技术,分别实现CD4+T细胞及其他免疫细胞的单细胞转录组、表面蛋白组与TCR/BCR测序的联合检测;通过生物信息学分析实现细胞聚类、TCR克隆型与表型的匹配,以及基因/蛋白表达的相关性分析。
(三)数据分析
将单细胞测序数据进行标准化处理后,通过聚类分析划分CD4+T细胞功能亚群,统计各亚群中肿瘤特异性TCR克隆型的分布比例;以CXCL13+CD4+T细胞占总CD4+T细胞的比例中位数为界,将患者分为高比例组与低比例组,进行生存分析;通过相关性分析探究CXCL13+CD4+T细胞与其他免疫细胞功能标志物的表达关联。
三、研究结果
(一)TCRVb测序鉴定肿瘤特异性
CD4+T细胞TCR克隆型 从4例患者样本中分离并筛选出能精准识别肿瘤的CD4+T细胞,通过TCRVb测序检测其免疫标识,成功鉴定出肿瘤新抗原特异性TCR克隆型,其中包括针对BRAF V600E等黑色素瘤特征突变的特异性克隆型。结果显示,肿瘤特异性CD4+T细胞的TCR克隆型在PD-1high表达的细胞中富集,且对肿瘤新抗原肽段具有特异性识别能力,为后续单细胞多组学分析提供了关键的克隆型标记。
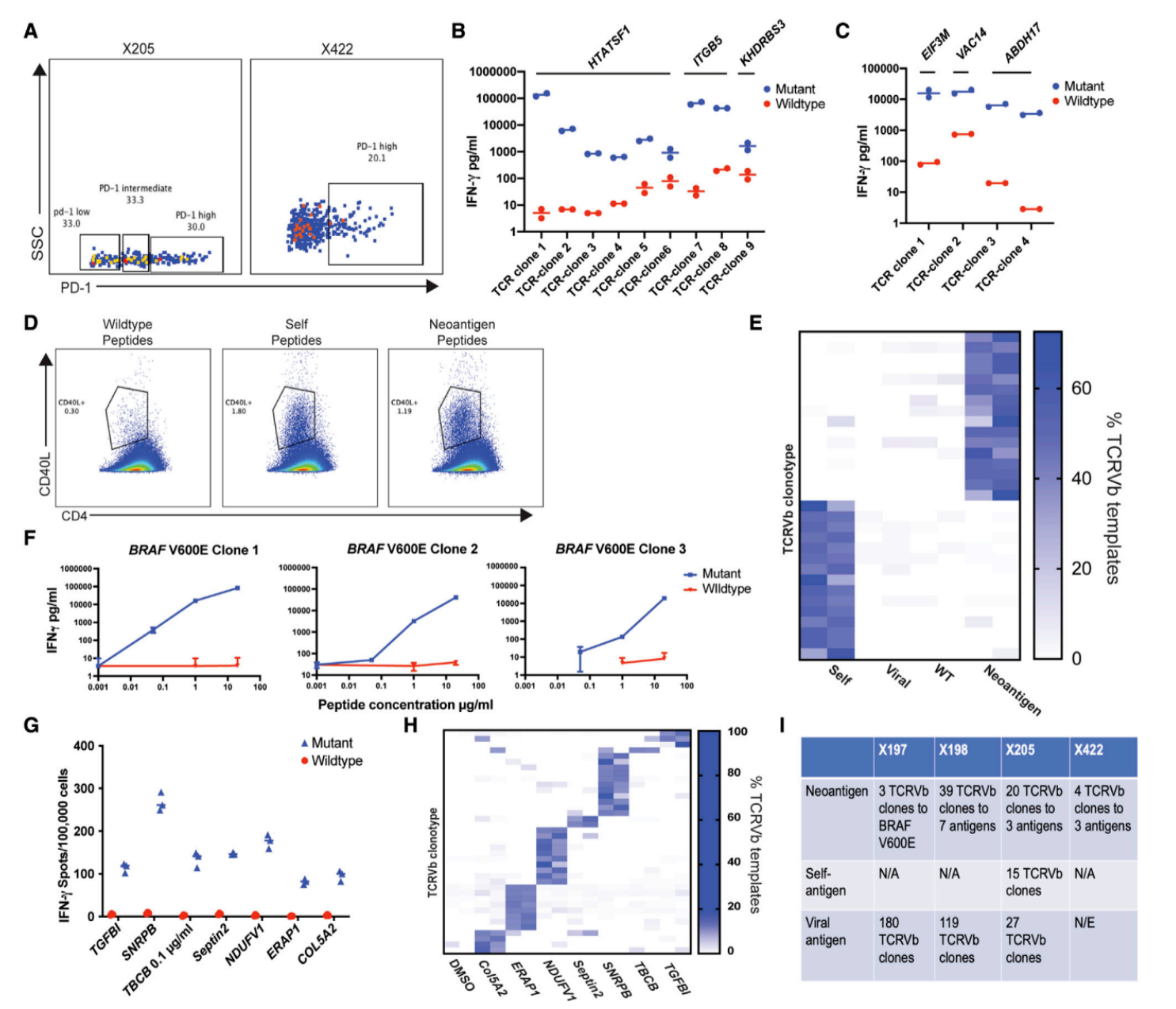
Veatch JR, Lee SM, et al. Neoantigen-specific CD4+ T cells in human melanoma have diverse differentiation states and correlate with CD8+ T cell, macrophage, and B cell function. Cancer Cell. 2022 Apr 11;40(4):393-409.e9.
(二)CXCL13+为黑色素瘤抗原特异性
CD4+T细胞核心表型 对4例患者的10184个CD4+T细胞进行单细胞多组学分析,将其聚类为3个功能亚群:FoxP3+Treg、CXCL13+PD-1+Tconv及CXCL13-IL7R+Tconv。匹配40个已知抗原特异性的TCR克隆型(对应259个细胞)发现,97%的肿瘤特异性CD4+T细胞富集于CXCL13+PD-1+Tconv亚群,且该亚群呈现明显的克隆扩增特征,证实CXCL13+是黑色素瘤抗原特异性CD4+T细胞的核心表型。
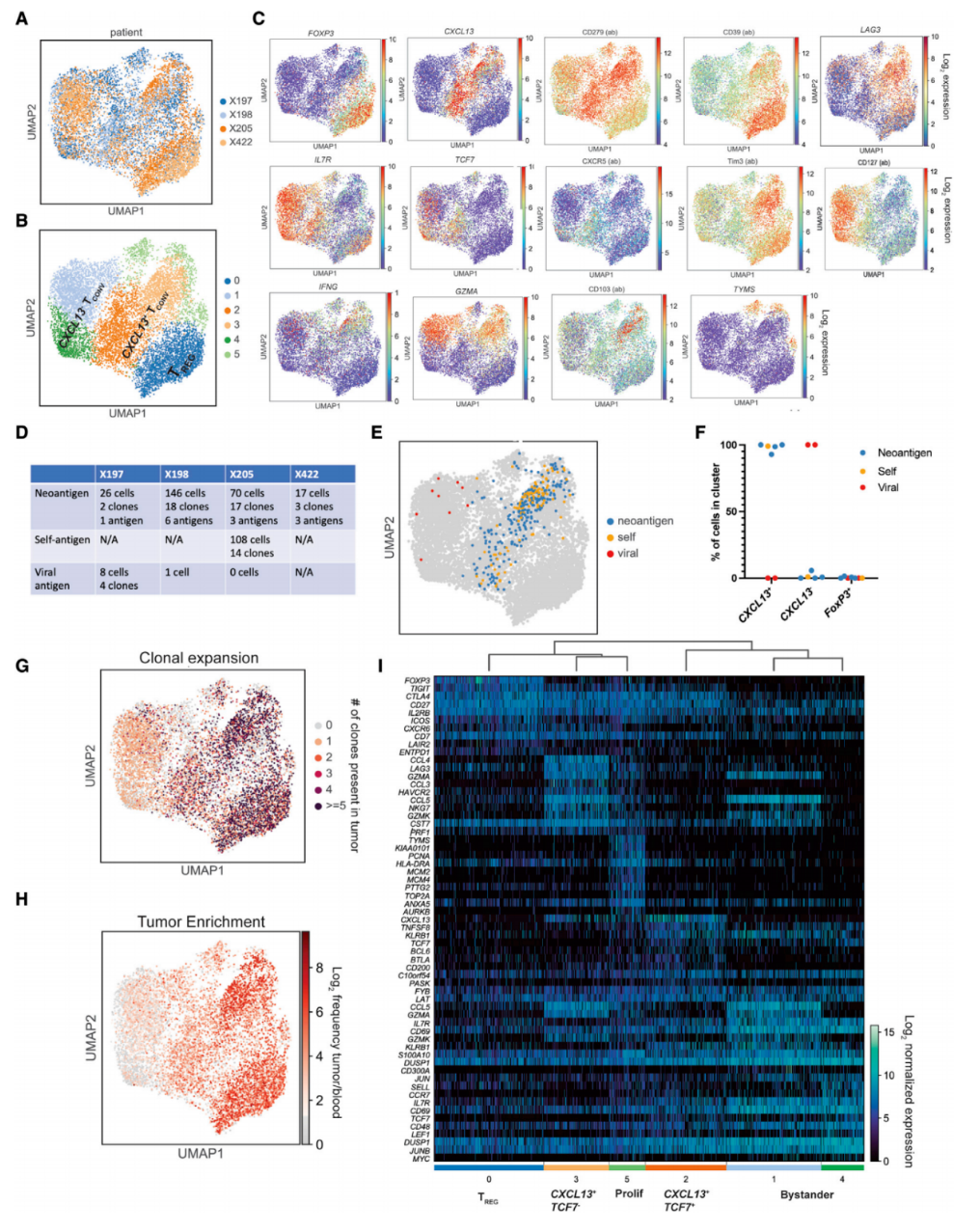
Veatch JR, Lee SM, et al. Neoantigen-specific CD4+ T cells in human melanoma have diverse differentiation states and correlate with CD8+ T cell, macrophage, and B cell function. Cancer Cell. 2022 Apr 11;40(4):393-409.e9.
(三)CXCL13+CD4+T细胞存在三种不同转录分化状态
单细胞多组学分析显示,抗原特异性CXCL13+CD4+T细胞可进一步分为三个转录亚群:TCF7+CXCR5+、TCF7-Tim3+及TCF-TYMS+。将样本量扩展至20例后,对26773个CD4+T细胞的聚类分析重现了该三种亚群特征,验证了结果的可靠性,提示CXCL13+CD4+T细胞具有多样化的分化状态,可能对应不同的功能特征。
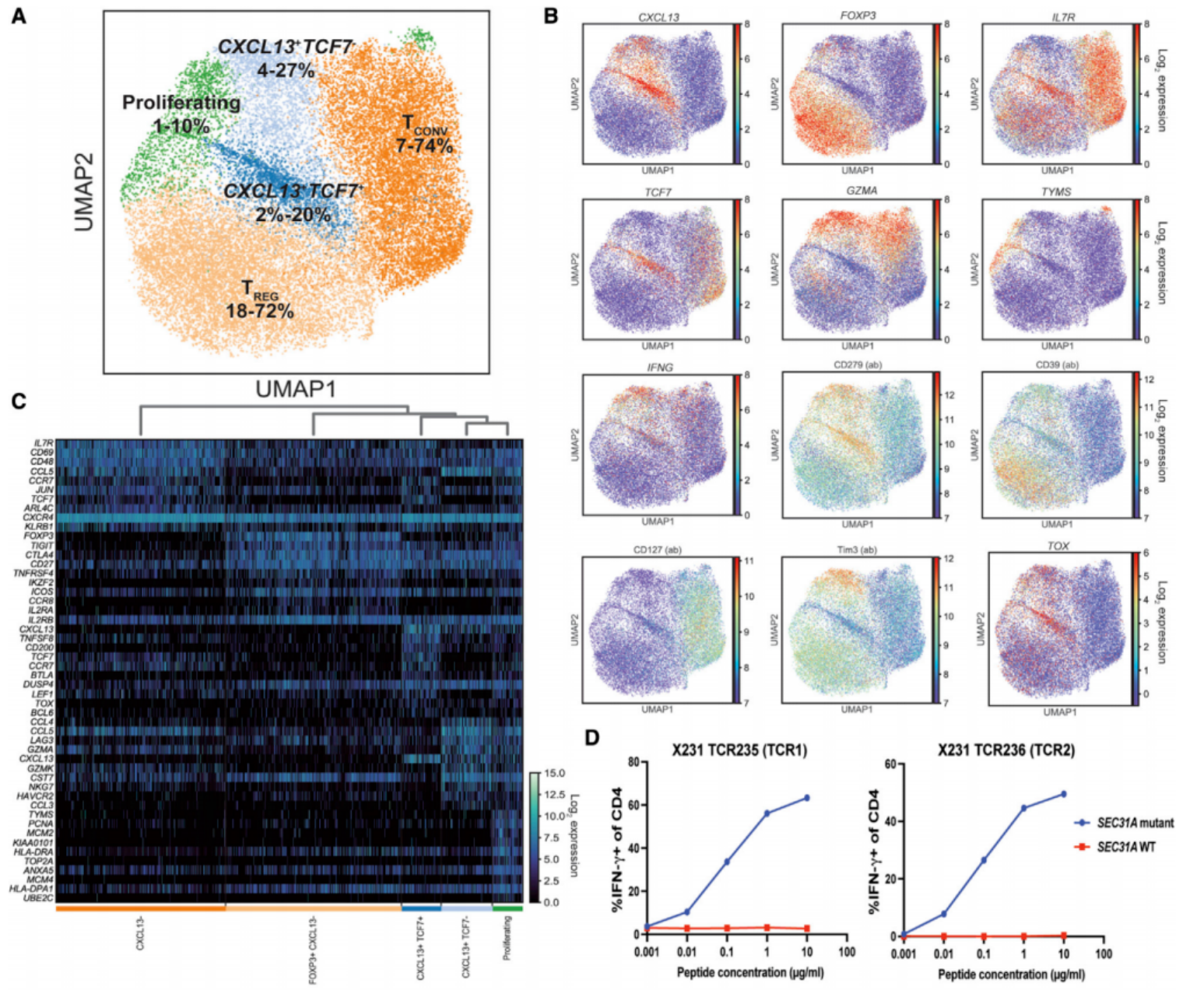
Veatch JR, Lee SM, et al. Neoantigen-specific CD4+ T cells in human melanoma have diverse differentiation states and correlate with CD8+ T cell, macrophage, and B cell function. Cancer Cell. 2022 Apr 11;40(4):393-409.e9.
(四)CXCL13+CD4+T细胞比例可预测黑色素瘤患者生存率
以20例患者中CXCL13+CD4+T细胞/CD4+T细胞比值中位数为界分组后,高比例组患者的存活率显著高于低比例组;利用TCGA数据库471例黑色素瘤数据的验证分析,进一步证实了CXCL13+CD4+T细胞比例与患者预后的正相关性,提示该细胞比例可作为黑色素瘤患者生存预后的潜在生物标志物。
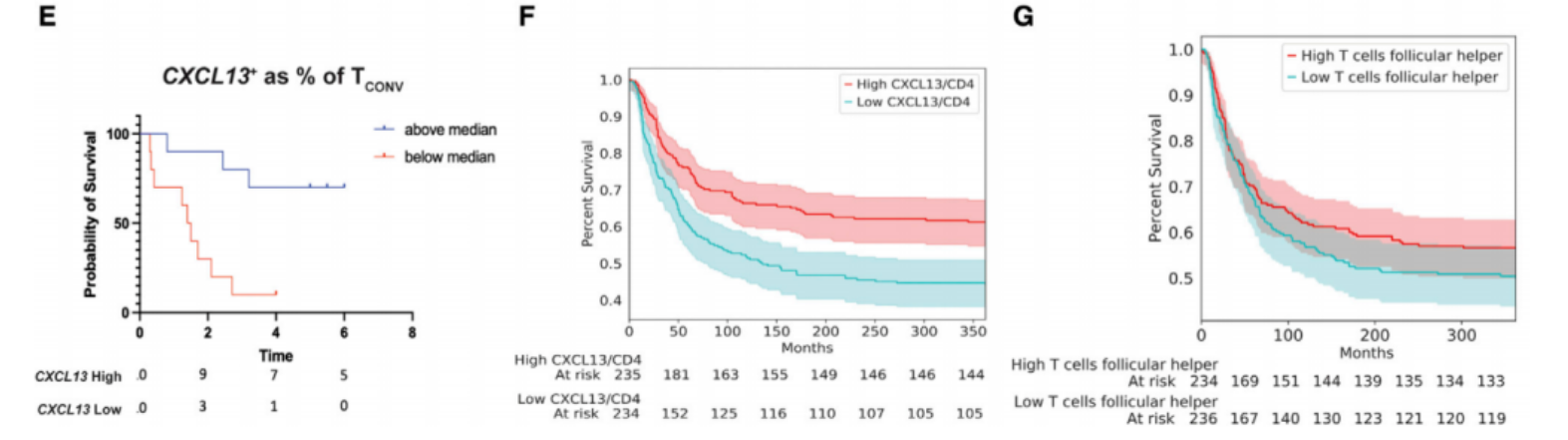
Veatch JR, Lee SM, et al. Neoantigen-specific CD4+ T cells in human melanoma have diverse differentiation states and correlate with CD8+ T cell, macrophage, and B cell function. Cancer Cell. 2022 Apr 11;40(4):393-409.e9.
(五)肿瘤微环境CD8+T细胞与CXCL13+CD4+T细胞表型具有相似性
对15332个肿瘤浸润CD8+T细胞的单细胞多组学分析显示,其可聚类为4个亚群,主要表达PD-1/CD103/CD39,且部分CD8+T细胞同样表达CXCL13,分为TYMS+和TCF+亚型,与CXCL13+CD4+T细胞的亚群特征高度相似,提示二者可能存在相似的分化调控机制。
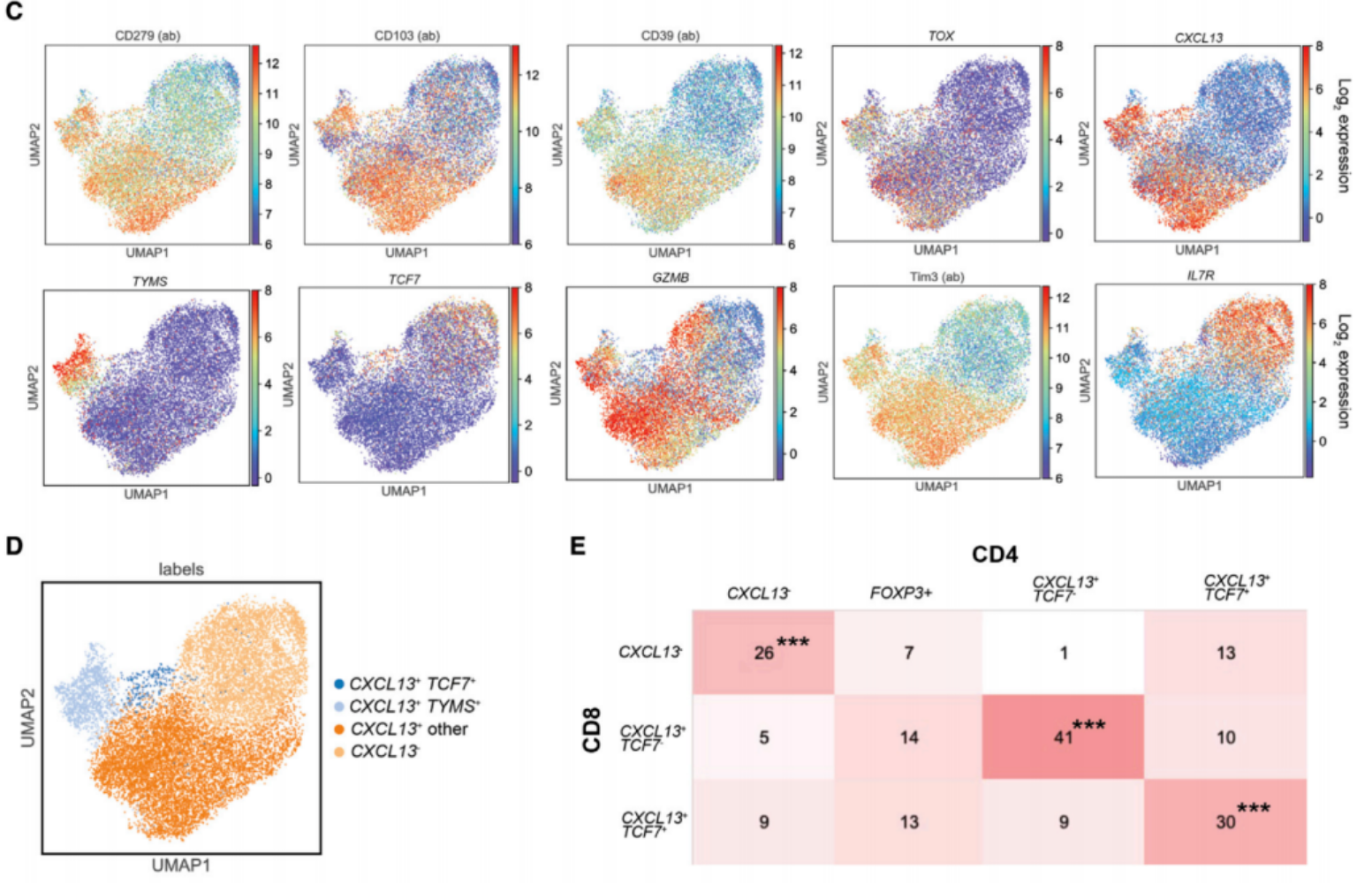
Veatch JR, Lee SM, et al. Neoantigen-specific CD4+ T cells in human melanoma have diverse differentiation states and correlate with CD8+ T cell, macrophage, and B cell function. Cancer Cell. 2022 Apr 11;40(4):393-409.e9.
(六)CXCL13+CD4+T细胞与肿瘤微环境免疫细胞活化正相关
相关性分析证实,黑色素瘤中CXCL13+CD4+T细胞与CD8+T细胞活化亚群(表达PD-1/CD103)呈显著正相关,其标记基因CXCL13/BTLA/IL21与CD8A在471例患者RNA数据中高度相关;同时该细胞群与巨噬细胞及B细胞的活化标志物表达也呈正相关,且该关联性在乳腺癌免疫治疗队列中重现,显示出跨癌种的特征。
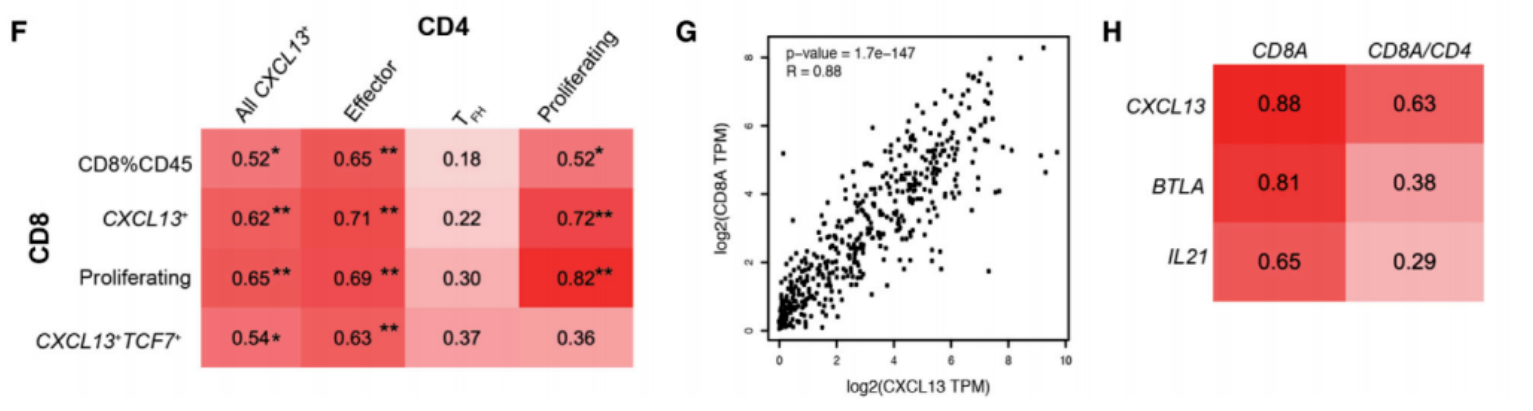
Veatch JR, Lee SM, et al. Neoantigen-specific CD4+ T cells in human melanoma have diverse differentiation states and correlate with CD8+ T cell, macrophage, and B cell function. Cancer Cell. 2022 Apr 11;40(4):393-409.e9.
四、结论
(一)研究价值
本研究通过 BD Rhapsody 单细胞多组学与 AbSeq 技术的整合应用,首次明确了 CXCL13 + 是人类黑色素瘤肿瘤新抗原特异性 CD4+T 细胞的核心表型,实现了肿瘤特异性 CD4+T 细胞从分子标记到分化状态的全面解析。研究发现 97% 的肿瘤特异性 CD4+T 细胞富集于 CXCL13+PD-1high 亚群,确立了 CXCL13 作为肿瘤反应性 T 细胞标志物的价值,弥补了传统研究中 CD4+T 细胞分子标记缺失的不足。
CXCL13+CD4+T 细胞的三种转录分化状态提示其在肿瘤微环境中具有多样化的功能,TCF7+CXCR5 + 亚群可能具有干细胞样特性,TCF7-Tim3 + 亚群可能处于耗竭前状态,而 TYMS + 亚群则表现出增殖特征,不同亚群的功能协同可能共同参与肿瘤免疫调控。同时,CXCL13+CD4+T 细胞比例与患者预后的正相关性,使其成为黑色素瘤预后评估的潜在生物标志物,为临床疗效监测提供了新的靶点。
本研究还发现 CXCL13+CD4+T 细胞与肿瘤微环境中 CD8+T 细胞、巨噬细胞及 B 细胞的活化密切相关,二者不仅表型相似,且功能标志物高度相关,提示 CXCL13+CD4+T 细胞可能作为免疫调控核心,介导不同免疫细胞的协同抗肿瘤作用,其跨癌种的相关性特征也为泛肿瘤免疫治疗研究提供了新的思路。
(二)单细胞多组学分析哪个公司有?
本研究不仅深度挖掘了CD4+T细胞在肿瘤免疫中的关键调控作用,为肿瘤免疫治疗的靶点开发与策略优化开拓了新方向,同时构建的单细胞多组学整合分析策略,也为肿瘤抗原特异性T细胞及肿瘤微环境免疫调控相关研究提供了重要的技术参考与研究范式。乐备实(LabEx)作为深耕多组学/多因子检测分析的专业实验服务专家,依托标准化的实验室操作流程、完善的样本处理体系与专业的数据分析能力,搭建了成熟的单细胞测序技术平台,可精准匹配此类肿瘤免疫研究的全流程技术需求,为科研工作者开展肿瘤免疫领域相关研究提供专业、高效的一站式技术服务,全方位助力科研成果的探索与转化。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


