一、引言
过敏性气道疾病以慢性气道炎症、气道高反应性和气道重塑为主要特征,其中过敏性哮喘是最具代表性的类型,其发病机制复杂且临床治疗仍存在未被满足的需求。15年前ILC2s的发现为过敏性气道疾病的研究开辟了新方向,这类组织驻留型固有免疫细胞广泛分布于肺部等黏膜组织,可快速响应微环境中的多种刺激并启动2型炎症反应。相较于Th2细胞,ILC2s的激活无需抗原提呈过程,成为过敏性气道炎症早期启动的关键环节。近年来,随着对ILC2s免疫生物学特性研究的不断深入,其表型可塑性、微环境调控网络及代谢调节机制逐渐明晰,为靶向ILC2s的过敏性气道疾病治疗提供了新的思路。

二、ILC2s的核心生物学特征及在过敏性气道疾病中的作用
(一)ILC2s的基础功能与效应机制
ILC2s是固有淋巴细胞家族的重要成员,其核心功能为分泌2型细胞因子,其中IL-5和IL-13在过敏性哮喘发病机制中发挥不可替代的作用。IL-5可促进嗜酸性粒细胞的增殖、活化和募集,导致肺部嗜酸性粒细胞浸润,引发气道炎症;IL-13则可诱导气道上皮细胞杯状细胞化生、黏液高分泌及气道平滑肌收缩,直接介导气道高反应性。此外,ILC2s还可分泌IL-4、IL-6、IL-9及粒细胞-巨噬细胞集落刺激因子(GM-CSF)等细胞因子,协同放大2型炎症反应,形成复杂的炎症调控网络。
(二)ILC2s与Th2细胞的功能差异
长期以来,过敏性气道疾病被认为是由Th2细胞驱动的适应性免疫疾病,但近年研究证实,ILC2s在疾病发生中具有独立的调控作用。在适应性免疫系统缺陷的小鼠模型中,ILC2s的激活仍可诱导典型的过敏性气道病理改变,包括气道嗜酸性粒细胞浸润、黏液分泌增加等,表明ILC2s可独立介导过敏性气道炎症的发生。与Th2细胞相比,ILC2s的激活具有快速性和非抗原依赖性,可在过敏原刺激后迅速响应并分泌细胞因子,成为过敏性气道炎症早期启动的关键因素,而Th2细胞则更多参与炎症的持续放大和维持过程。二者协同作用,共同推动过敏性气道疾病的病理进程。
(三)ILC2s的功能可塑性特征
ILC2s并非表型和功能固定的细胞群,而是具有显著的功能可塑性,可在不同细胞因子微环境的诱导下发生表型转变,呈现出类似于1型固有淋巴细胞(ILC1s)和3型固有淋巴细胞(ILC3s)的表型特征,这种可塑性是其适应微环境变化、调控炎症反应的重要机制。
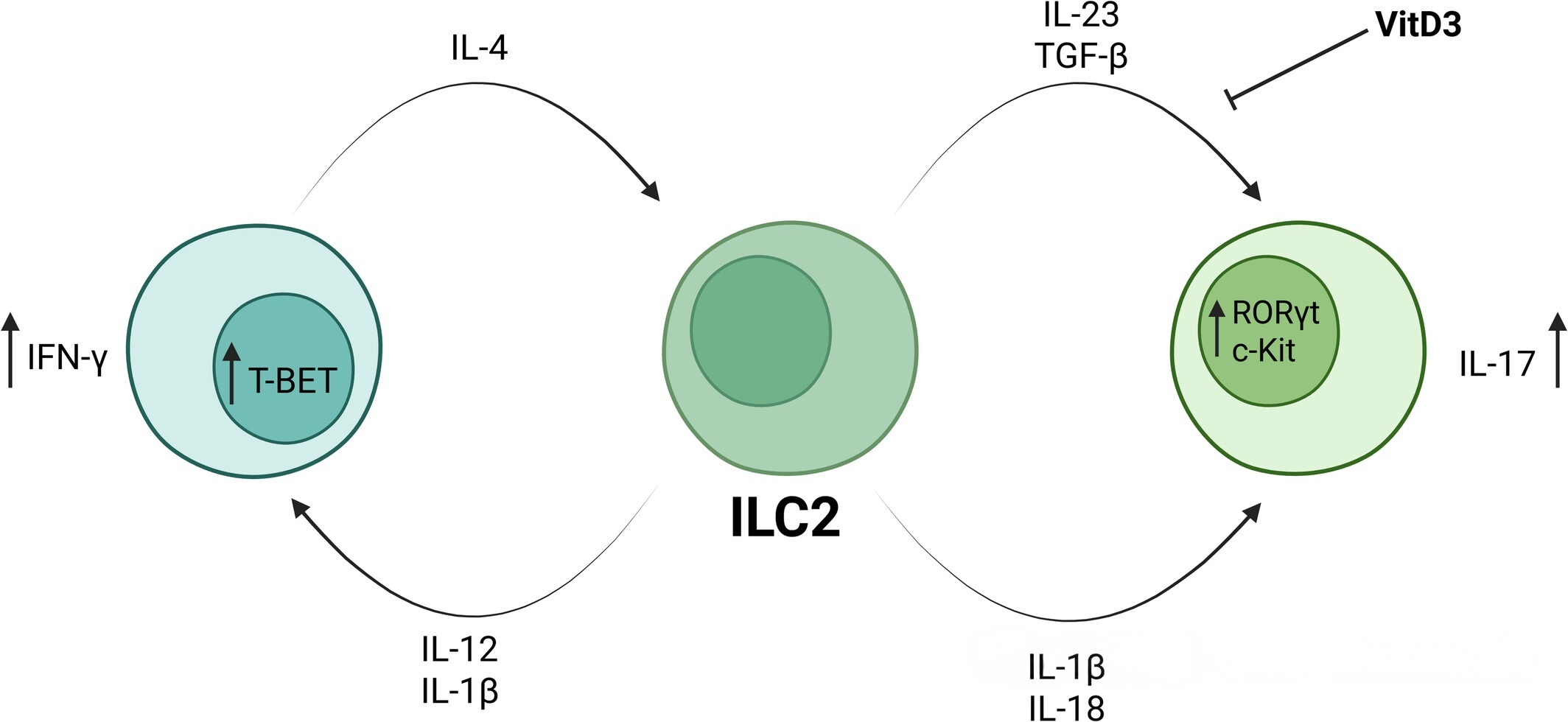
图1.2型固有淋巴细胞(ILC2s)表现出功能可塑性,能够呈现出类似于1型和3型固有淋巴细胞的表型。
Cain J, Hurrell B, et al. The Expanding Role of ILC2s in Allergic Airways Disease. Allergy. 2026 Jan;81(1):11-23.
3.1 向ILC1样表型的转变
在IL-12和IL-1β的共同作用下,ILC2s可发生表型重编程,向ILC1样表型转变,其核心特征为转录因子T-BET的表达上调,并分泌干扰素-γ(IFN-γ)等1型细胞因子。IFN-γ可抑制2型炎症反应,形成炎症调控的负反馈机制,表明ILC2s的这一表型转变可参与过敏性气道炎症的负向调控。值得注意的是,这种表型转变具有可逆性,在嗜酸性粒细胞来源的IL-4作用下,ILC1样表型的ILC2s可恢复为传统的ILC2s表型,重新分泌2型细胞因子,这种可逆性保证了炎症反应的动态调控。
3.2 向ILC3样表型的转变
在IL-23和转化生长因子-β(TGF-β)的诱导下,ILC2s可向ILC3样表型转变,表现为转录因子RORγt的表达激活,并分泌IL-17等3型细胞因子,参与调控炎症反应和组织修复过程。维生素D3可通过抑制RORγt的表达,有效阻断ILC2s向ILC3样表型的转变,维持其固有表型和功能,这一发现揭示了维生素D3在过敏性气道疾病中的潜在保护作用,为膳食干预提供了理论依据。 ILC2s的功能可塑性使其能够根据微环境细胞因子的变化,灵活调整其分泌的细胞因子谱,参与不同类型炎症反应的调控,在过敏性气道疾病的炎症平衡中发挥重要作用。其可塑性的调控机制及生理病理意义仍需进一步深入研究,为理解过敏性气道疾病的复杂炎症调控网络提供新的视角。
(四)ILC2s活性的调控机制
肺部ILC2s定植于复杂的微环境中,其活性受到多种信号通路的精密调控,包括细胞表面共刺激分子的相互作用、神经内分泌系统的信号调控及膳食来源营养素的代谢调节等。这些调控机制相互交织,形成复杂的调控网络,共同调节ILC2s的增殖、活化和细胞因子分泌。
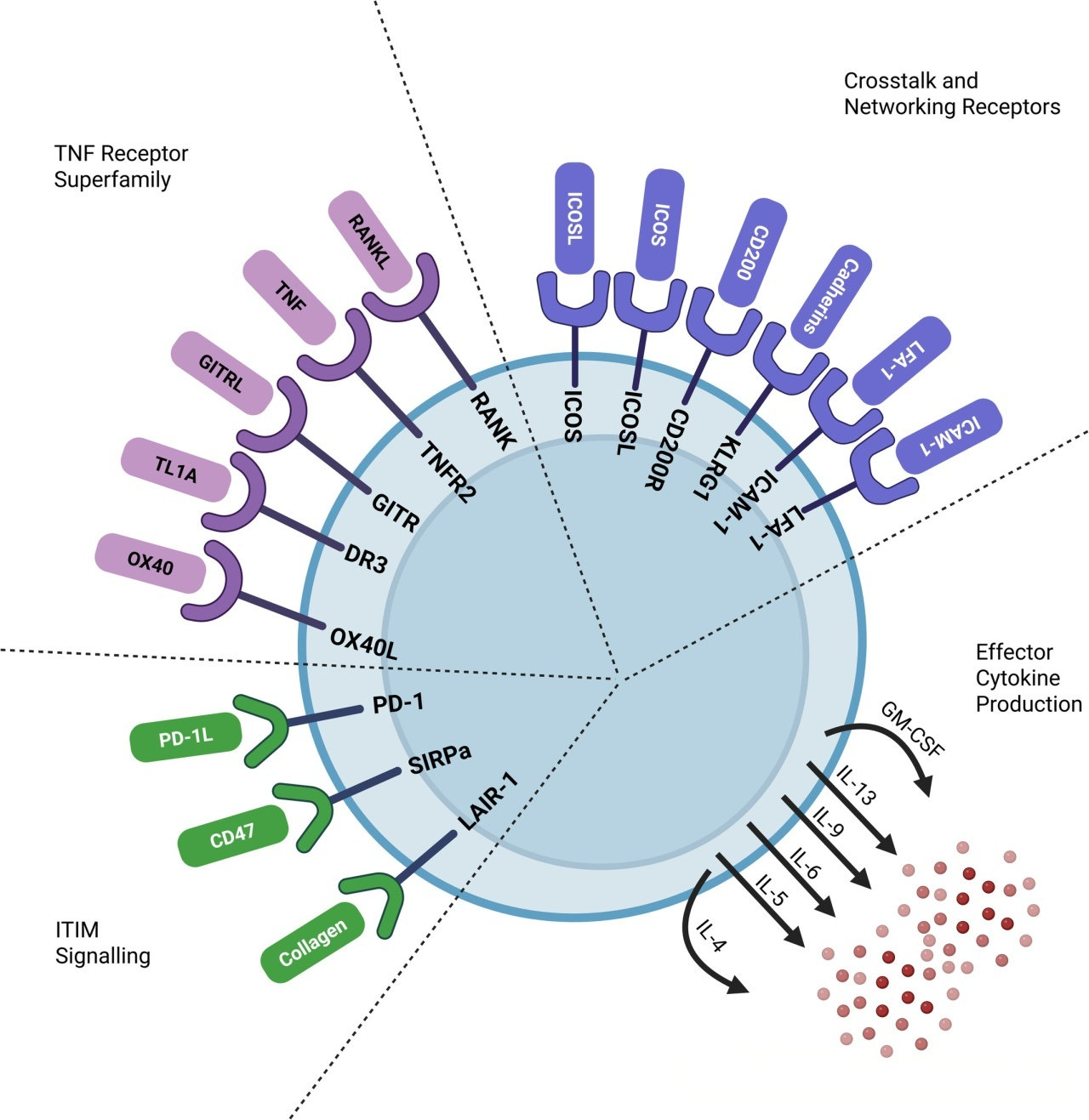
图2. 肺部的ILC2定植于一个依赖多种共刺激分子的复杂微环境中。
Cain J, Hurrell B, et al. The Expanding Role of ILC2s in Allergic Airways Disease. Allergy. 2026 Jan;81(1):11-23.
4.1 共刺激分子的调控作用
肺部ILC2s的表面表达多种共刺激分子受体,这些受体与微环境中其他细胞表达的配体结合,可正向或负向调控ILC2s的活性,其调控作用依赖于ILC2s与气道上皮细胞、内皮细胞、Th2细胞等多种细胞的相互作用。根据功能和结构特征,参与ILC2s调控的表面受体可分为三大类:
1. 肿瘤坏死因子受体超家族:包括RANK、TNFR2、GITR、DR3和OX40L等,这类受体的激活可正向调控ILC2s的增殖和活化,促进其效应细胞因子的分泌,放大2型炎症反应;
2. 具有免疫受体酪氨酸抑制基序(ITIM)的受体:如PD-1、SIRPa和LAIR-1等,这类受体的激活可传递抑制性信号,抑制ILC2s的活化和细胞因子分泌,参与过敏性气道炎症的负向调控;
3. 经典共刺激分子:包括ICOS、ICOSL、CD200R、KLRG1、LFA-1和ICAM-1等,这类分子通过介导细胞间的黏附与信号传递,调控ILC2s的活化状态,维持其生理功能的平衡。 共刺激分子的调控作用具有细胞特异性和微环境依赖性,不同细胞间的相互作用可通过不同的共刺激分子通路调控ILC2s的活性,成为微环境调控ILC2s功能的重要方式。
4.2 神经内分泌信号的调控网络
肺部是高度神经支配的器官,ILC2s所处的微环境具有丰富的神经内分泌信号,交感神经、副交感神经及感觉神经系统均可通过分泌神经递质和神经肽,与ILC2s表面的相应受体结合,实现对ILC2s活性的多层次调控,形成神经-免疫交互作用的重要节点。
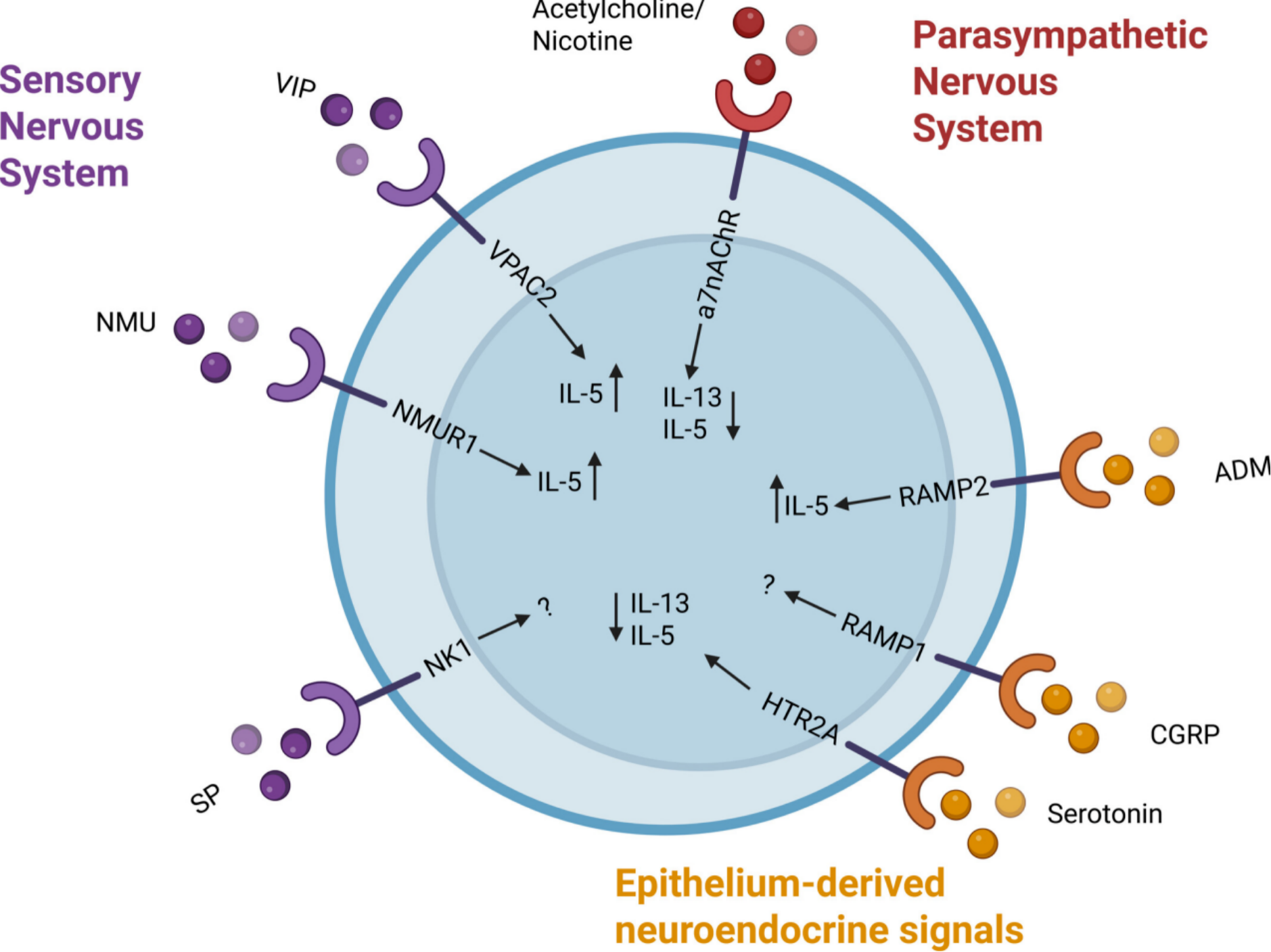
图3. 肺部的ILC2s所处的微环境具有高度神经支配特性,可接受多种形式的神经内分泌刺激。
Cain J, Hurrell B, et al. The Expanding Role of ILC2s in Allergic Airways Disease. Allergy. 2026 Jan;81(1):11-23.
1. 副交感神经的调控:副交感神经通过释放乙酰胆碱,与ILC2s表面的α7烟碱型乙酰胆碱受体(α7nAChR)结合,介导对ILC2s的调控作用,参与气道炎症的神经调节;
2. 感觉神经系统的调控:感觉神经系统释放的血管活性肠肽(VIP)、神经介素U(NMU)和P物质(SP)分别与ILC2s表面的VPAC2、NMUR1和NK1受体结合,调控ILC2s的增殖和细胞因子分泌。其中NMU可显著促进ILC2s分泌IL-5和IL-13,放大2型炎症反应,成为神经-免疫交互作用调控过敏性气道炎症的关键通路;
3. 肺神经内分泌细胞的协同调控:肺神经内分泌细胞(PNEC)和棒状细胞分泌的肾上腺髓质素(ADM)、降钙素基因相关肽(CGRP)及血清素,可通过靶向结合ILC2s表面的RAMP2、RAMP1和5-羟色胺受体2A(HTR2A),协同调控ILC2s的活性,在肺部微环境的免疫调节中发挥重要作用。 神经内分泌信号对ILC2s的调控是过敏性气道疾病神经-免疫交互作用的核心机制,为靶向神经-免疫通路的治疗策略开发提供了新的靶点。
4.3 膳食营养素的代谢调节
膳食来源的营养素和微量组分可通过调控ILC2s的免疫代谢通路,影响其代谢状态和表型特征,成为过敏性气道疾病膳食干预的重要理论基础。不同营养素对ILC2s的活性具有不同的调控作用,主要表现为正向或负向调控两类效应:
1. 负向调控ILC2s活性的营养素:丁酸等短链脂肪酸可通过下调转录因子Gata3的表达,抑制IL-5、IL-13等效应细胞因子的分泌,从而抑制ILC2s的活化;钙离子则通过增强Krüppel样因子2(KLF2)的表达,抑制NF-κB信号通路的激活,实现对ILC2s功能的负向调控;视黄酸(维生素A衍生物)可诱导ILC2s上调抗炎因子IL-10的分泌水平,发挥免疫调节作用,减轻气道炎症。
2. 正向调控ILC2s活性的营养素:锌元素作为ILC2s中促炎基因转录的关键辅助因子,其补充可显著激活MAPK/NF-κB信号轴,增强ILC2s的促炎表型,促进2型炎症反应;
3. 双向调控的代谢因子:细胞内铁离子浓度的动态变化可通过HIF-1α通路调控ILC2s的代谢重编程,当铁可用度增高时,HIF-1α信号传导受抑,进而削弱ILC2s的促炎表型,而铁缺乏则可增强其促炎活性,表明铁离子的代谢平衡对ILC2s的功能调控具有重要意义。 膳食营养素通过调控ILC2s的免疫代谢通路,实现对其活性的精准调节,这一发现为过敏性气道疾病的膳食干预提供了新的思路,通过合理的膳食搭配调节体内营养素水平,可成为辅助治疗过敏性气道疾病的重要手段。
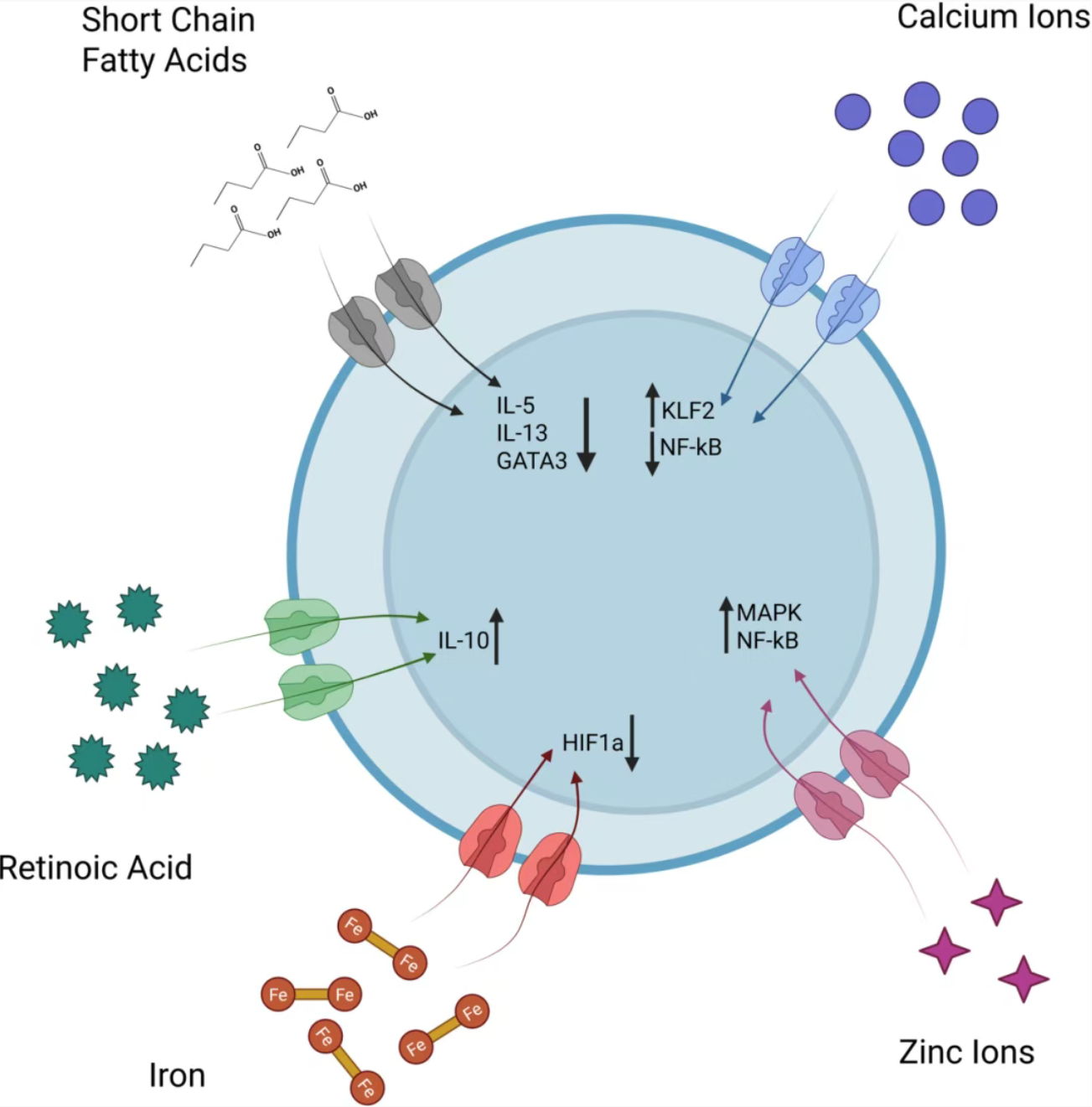
图4. ILC2细胞依赖于膳食来源的营养素及微量营养素信号调节其代谢状态与表型特征。
Cain J, Hurrell B, et al. The Expanding Role of ILC2s in Allergic Airways Disease. Allergy. 2026 Jan;81(1):11-23.
五、总结
(一)研究价值
ILC2s作为过敏性气道疾病发病机制中的核心调控细胞,其非抗原依赖的激活方式、独立的炎症介导能力及复杂的微环境调控网络,使其成为过敏性气道疾病治疗的潜在重要靶点。近年来,关于ILC2s功能可塑性、共刺激分子调控、神经内分泌信号交互及膳食代谢调节的研究取得了显著进展,揭示了ILC2s在过敏性气道炎症中的复杂调控机制,为新型治疗策略的开发提供了丰富的理论依据。
(二)外包实验服务公司有哪些?
乐备实(LabEx)将凭借一站式的多因子检测及多组学分析服务能力,结合流式检测、蛋白芯片、抗体芯片等技术平台,为 ILC2s 相关研究提供从分子、细胞到组织水平的全方位检测分析支持,助力研究者深入解析 ILC2s 的调控网络,携手推动过敏性气道疾病临床治疗的新突破。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


