一、研究背景
经典免疫学认知中,淋巴结呈现高度分区化的静态结构:外周区域介导先天免疫以阻止病原体扩散,内部T细胞区为适应性免疫启动提供相对稳定的微环境,而DCs仅作为“桥梁细胞”负责捕获并向初始T细胞呈递抗原,启动适应性免疫应答。然而,近年来研究发现,中性粒细胞、单核细胞、自然杀伤(NK)细胞等先天免疫细胞可在感染后浸润淋巴结T细胞区,且过度的先天免疫反应可能抑制T、B细胞的活化,提示淋巴结内先天与适应性免疫的相互作用存在精细的调控机制,但其核心调控者与分子通路尚未明确。 在此背景下,华盛顿大学医学院Jessica Y. Huang与Michael Y. Gerner团队通过细菌感染与疫苗免疫模型,揭示了DCs作为淋巴结先天-适应性免疫平衡“总调度员”的核心功能,阐明了DCs介导淋巴结动态结构重塑的分子机制,为理解免疫反应的时空调控规律提供了全新视角。

Huang JY, Gerner MY. Dendritic cells regulate the innate-adaptive balance in lymph nodes for optimal host defense. Cell. 2026 Jan 22;189(2):548-568.e19.
二、核心研究发现
(一)感染后淋巴结的快速结构重编程
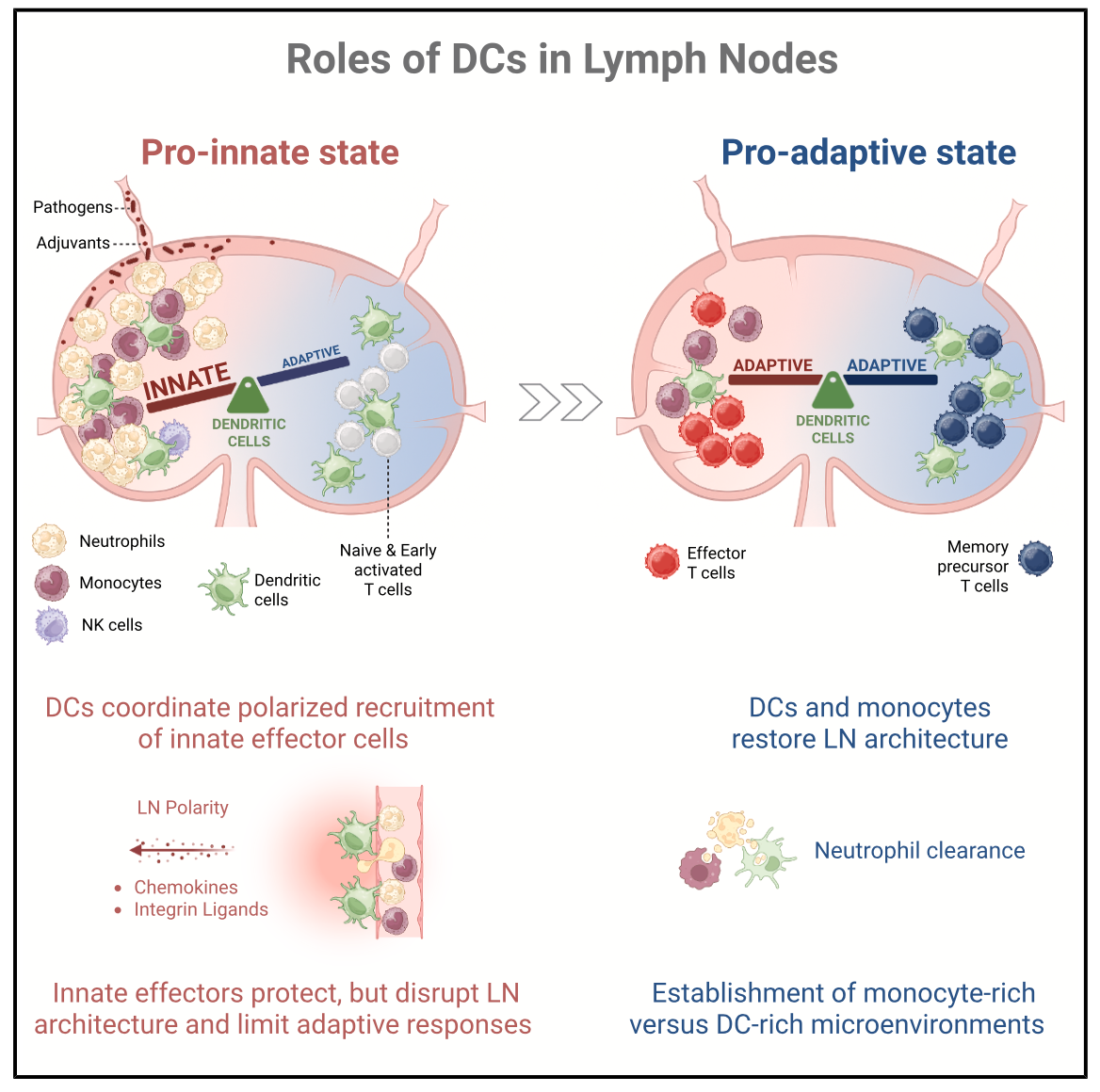
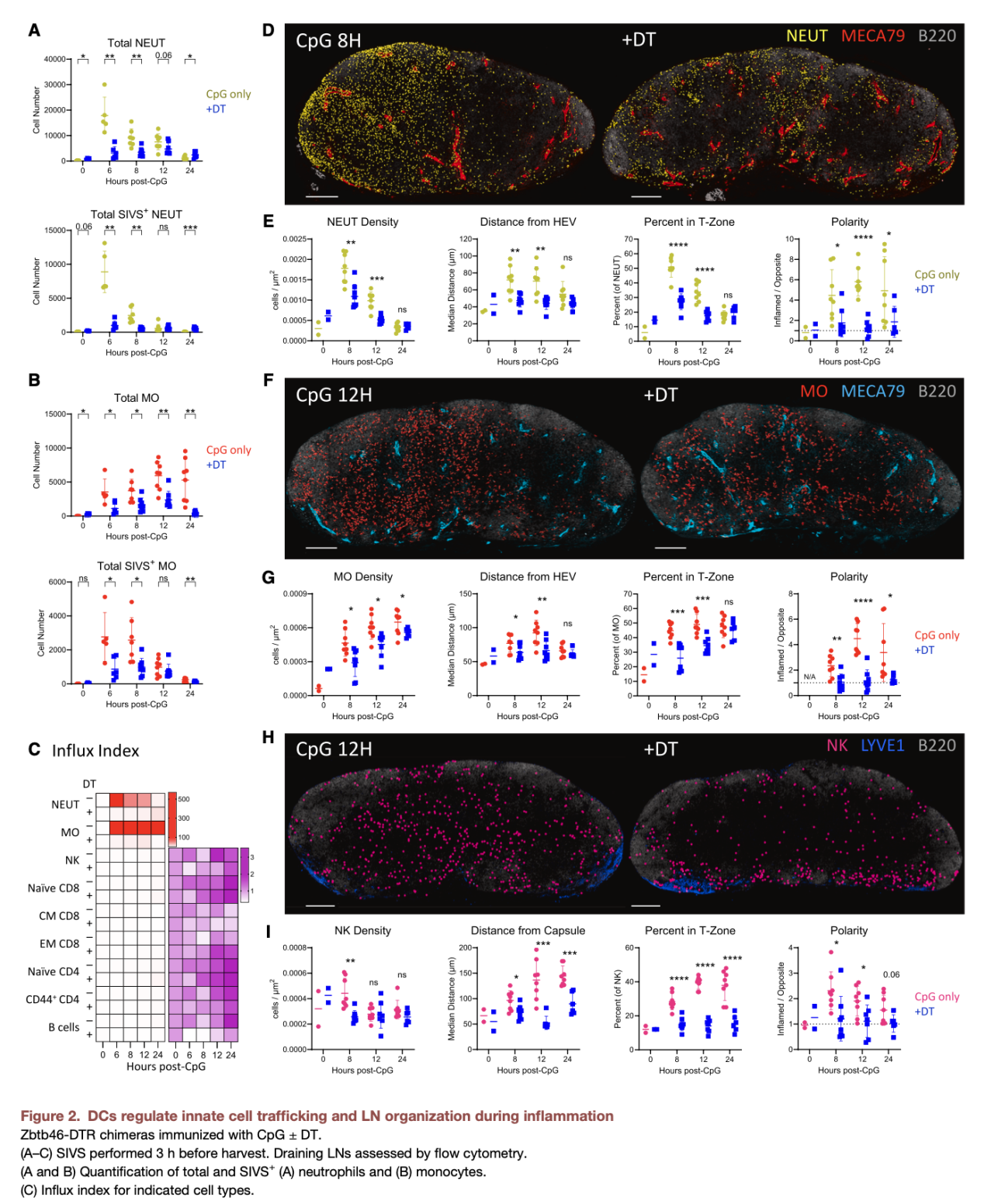
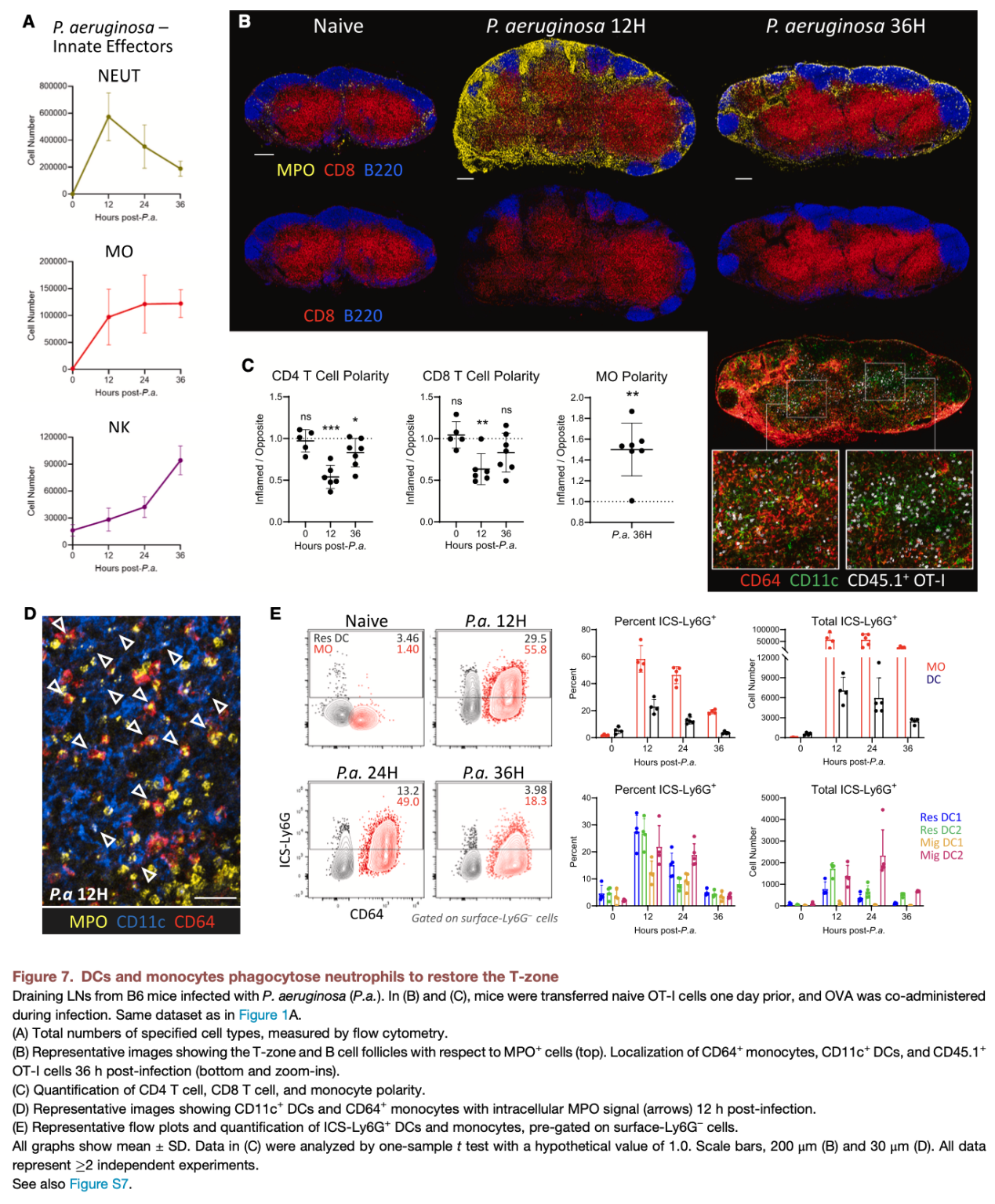
在铜绿假单胞菌感染或CpG佐剂免疫刺激下,淋巴结在短时间内发生显著的结构性重塑,表现为:中性粒细胞、单核细胞通过高内皮微静脉(HEVs)大规模、极化性募集进入淋巴结,且并非局限于外周区域,而是深入核心T细胞区;NK细胞在淋巴结内部发生空间重定位,形成高度极化的细胞分布格局。该结果证实,感染状态下的淋巴结并非静态的分区化器官,而是高度动态、可重构的免疫微环境,其结构重塑为先天免疫防御提供了结构基础。
Huang JY, Gerner MY. Dendritic cells regulate the innate-adaptive balance in lymph nodes for optimal host defense. Cell. 2026 Jan 22;189(2):548-568.e19.
(二)DCs是先天免疫细胞募集与组织的核心驱动者
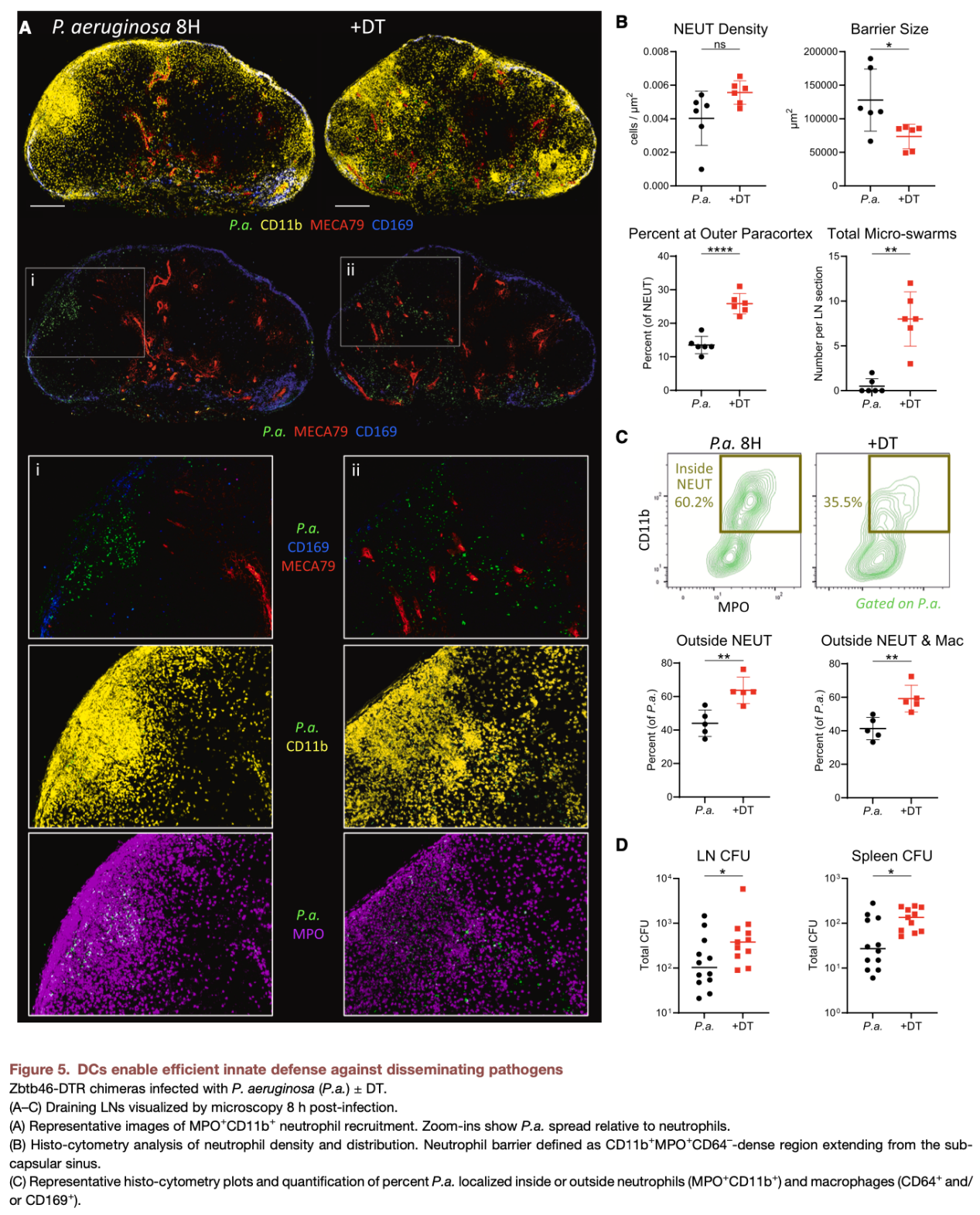
先天免疫细胞的极化性浸润并非自发过程,而是由成熟并向T区迁移的DCs主动驱动。机制上,DCs在活化过程中高表达多种炎症趋化因子,同时上调ICAM-1等整合素配体,这些分子在淋巴结内形成“趋附性通道(haptotactic scaffold)”,为先天免疫细胞的迁移提供了分子“路线”。该通路可促进中性粒细胞、单核细胞、NK细胞从HEVs高效进入淋巴结,并向感染相关区域定向迁移,实现先天免疫细胞的极化性组织,从而快速构建抗病原体的先天免疫防线。
Huang JY, Gerner MY. Dendritic cells regulate the innate-adaptive balance in lymph nodes for optimal host defense. Cell. 2026 Jan 22;189(2):548-568.e19.
(三)先天免疫激活对适应性免疫的早期抑制效应
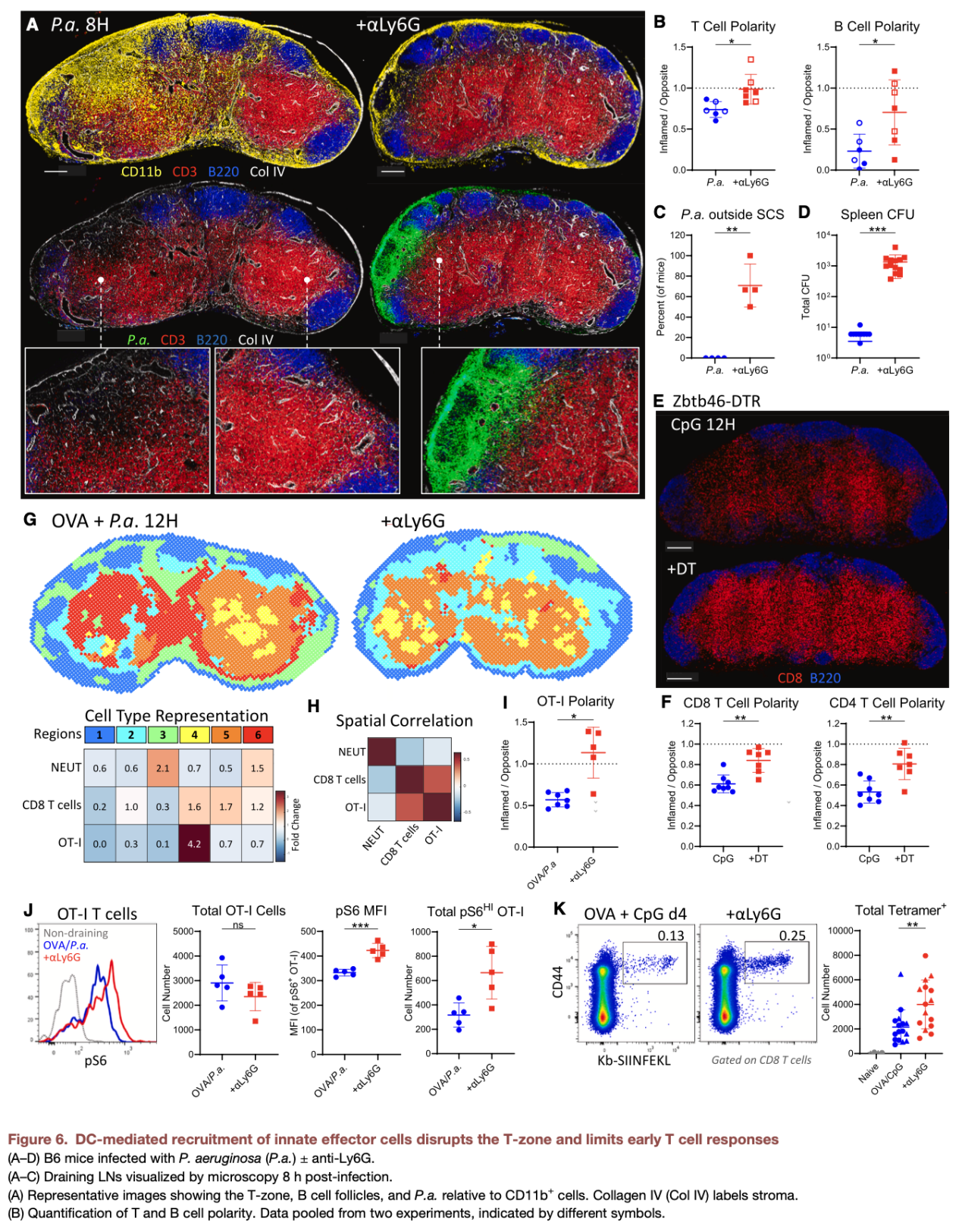
本研究发现了一个反直觉的生理现象:DCs介导的先天免疫激活虽能有效限制病原体扩散,但会在早期暂时抑制适应性免疫反应。大量中性粒细胞浸润T细胞区后,会挤占淋巴结有效空间、排斥淋巴细胞,导致T细胞区结构被打散,B细胞滤泡位置偏移,HEVs功能受损,初始T细胞仅能在炎症较轻的区域完成活化,最终显著限制早期T细胞免疫的强度。这一现象是免疫系统的生理性“权衡”策略——当面临病原体快速扩散的威胁时,淋巴结优先启动先天免疫以阻断病原体传播,而非追求适应性免疫的完美启动。
Huang JY, Gerner MY. Dendritic cells regulate the innate-adaptive balance in lymph nodes for optimal host defense. Cell. 2026 Jan 22;189(2):548-568.e19.
(四)DCs介导淋巴结结构恢复与适应性免疫的后续激活
淋巴结的结构破坏与适应性免疫抑制并非永久性状态。当病原体被先天免疫防线控制后,完成效应功能的中性粒细胞发生凋亡,此时DCs与其前期募集的单核细胞共同发挥“清道夫”功能,通过吞噬凋亡的中性粒细胞,启动淋巴结结构的修复程序:T细胞区重新成形,B细胞滤泡归位,HEVs功能恢复,最终重建有利于适应性免疫激活的微环境。同时,DCs会在淋巴结内形成单核细胞富集与DC富集的极化区域,为效应T细胞活化、记忆性T细胞形成提供条件,实现从先天免疫向适应性免疫的平稳过渡。
Huang JY, Gerner MY. Dendritic cells regulate the innate-adaptive balance in lymph nodes for optimal host defense. Cell. 2026 Jan 22;189(2):548-568.e19.
三、DCs调控先天-适应性免疫平衡的分子机制与时空特征
DCs对淋巴结先天-适应性免疫平衡的调控具有显著的时序性与空间性特征,可分为两个核心阶段,且两个阶段均由DCs主导调控,实现了免疫反应的动态切换。
(一)先天免疫激活阶段:募集与组织
感染初期,DCs作为“炎症启动者”,通过趋化因子-整合素配体通路,驱动先天免疫细胞极化性浸润淋巴结并深入T细胞区,快速构建先天免疫防线,其核心功能是限制病原体扩散,此阶段的关键特征是“先天免疫优先,适应性免疫受抑”,为宿主争取抗病原体的关键时间窗口。
(二)适应性免疫激活阶段:清除与重建
病原体被控制后,DCs切换为“炎症消解者”与“结构重建者”,通过与单核细胞协同吞噬凋亡中性粒细胞,清除炎症细胞并恢复淋巴结正常结构,同时构建极化的免疫微环境,为适应性免疫的高效启动提供保障,此阶段的核心功能是启动特异性适应性免疫,实现对病原体的长期清除与免疫记忆形成。 综上,DCs通过在不同阶段的功能切换,实现了对先天免疫与适应性免疫的时序性调控,其本质是通过调控先天免疫细胞的空间组织与动态清除,平衡淋巴结的先天防御与适应性免疫启动功能,因此被定义为淋巴结先天-适应性免疫平衡的“调节器”。
四、研究的科学意义与创新点
(一)打破DCs的传统认知,拓展其免疫调控功能
本研究彻底突破了“DCs仅作为抗原呈递细胞”的狭义认知,明确DCs兼具多重核心功能:淋巴结空间结构的组织者、先天-适应性免疫的时序协调者、免疫反应强弱的物理限制因素。研究证实,免疫反应不仅是细胞内信号通路的调控过程,更是免疫细胞在组织微环境中空间分布与动态调度的结果,为免疫学研究提供了“空间调控”的全新视角。
(二)阐明了淋巴结先天-适应性免疫平衡的核心调控机制
本研究首次明确DCs是淋巴结内协调先天与适应性免疫相互作用的核心细胞,揭示了“DCs-先天免疫细胞-淋巴结结构”的调控轴,解释了为何先天免疫激活有时会抑制适应性免疫的关键科学问题,完善了免疫系统对病原体的防御调控网络,为理解感染免疫的基本规律提供了新的理论框架。
(三)为免疫工程策略的优化提供全新思路
本研究为疫苗设计、肿瘤免疫治疗等应用研究提供了重要的理论警示与方向指导:并非越强的先天免疫激活效果越好,过度的中性粒细胞、单核细胞动员可能因挤占T细胞区而削弱适应性免疫反应。因此,后续免疫工程策略的设计需以**调控DCs功能**为核心,实现“先天免疫有效激活”与“适应性免疫不受过度抑制”的双重目标,例如在佐剂设计中,需筛选可定向调控DCs趋化因子表达的分子,避免先天免疫细胞的过度浸润;在肿瘤疫苗研发中,可通过调控DCs的时空功能,实现肿瘤微环境中先天免疫与适应性免疫的协同激活。
五、结论
(一)研究展望
本研究虽明确了DCs调控淋巴结先天-适应性免疫平衡的核心机制,但仍存在有待深入探索的科学问题:其一,DCs不同亚群(如Res DC1、Res DC2、Mig DC1、Mig DC2)在先天免疫细胞募集、淋巴结结构重建中的特异性功能与分子差异尚未明确;其二,DCs表达的趋化因子与整合素配体的上游调控通路,以及感染后DCs功能切换的信号开关仍需进一步解析;其三,该调控机制在病毒感染、自身免疫病、肿瘤等不同免疫场景中的适用性与调控差异有待验证。 在应用层面,基于本研究成果,后续可围绕DCs的定向调控开展免疫工程策略的研发:例如筛选可特异性调控DCs趋化因子表达的小分子化合物,优化疫苗佐剂体系;开发靶向DCs整合素配体的生物制剂,实现肿瘤微环境中先天与适应性免疫的协同激活;探索DCs介导的淋巴结结构重塑在自身免疫病中的作用,为自身免疫病的治疗提供新的靶点。 总之,本研究揭示了DCs在免疫系统中的核心调控功能,为理解先天-适应性免疫的相互作用规律提供了全新视角,其成果不仅完善了感染免疫的理论体系,更为疫苗设计、肿瘤免疫治疗等领域的研究提供了重要的理论依据与技术方向,具有重要的科学价值与临床转化潜力。
(二)DC细胞研究实验服务哪个公司有?
LabEx 作为专业的生物检测实验服务平台,凭借标准化操作、完善的数据体系、全维度技术布局与专业的数据分析能力,可成为该领域后续研究与转化的核心技术合作伙伴,从基础科学问题解析到药物制剂筛选验证,再到生物标志物发现,均可提供一站式高效实验服务,助力科研工作者加速研究进程,推动免疫领域研究成果的临床转化与生命科学发展。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


