摘要:蛋白检测是生命科学研究与临床诊断的核心环节,其特异性和灵敏度高度依赖于所使用的诊断抗体。本文系统阐述了基于诊断抗体开发的关键蛋白检测技术,重点分析了抗体制备与表征、检测体系构建以及技术应用逻辑,并对未来发展趋势进行展望,以期为相关研究提供理论参考。
一、诊断抗体的制备与表征
诊断抗体的性能是决定蛋白检测成败的基础。其开发通常始于特定抗原表位的选择与设计。理想的免疫原应具备良好的免疫原性与特异性,通常选取目标蛋白的独特线性或构象性表位。多克隆抗体通过免疫动物获得,其优势在于制备相对简便、对抗原亲和力高,但批次间差异性较大。单克隆抗体技术则通过杂交瘤细胞系生产,能提供无限量、高均一性的抗体,是大多数高精度诊断试剂的核心原料。近年来,重组抗体技术,特别是噬菌体展示技术,允许在体外进行高通量筛选与工程化改造,能够获得高亲和力、高特异性且易于生产的抗体变体,代表了重要的发展方向。
抗体表征是开发过程中不可或缺的步骤。其核心指标包括亲和力、特异性和灵敏度。亲和力常通过表面等离子共振(SPR)或酶联免疫吸附测定(ELISA)进行评估,确保抗体与目标蛋白结合牢固。特异性验证则需通过Western Blot、免疫组化或交叉反应实验,确认抗体仅与目标蛋白结合,而不与非靶标蛋白发生交叉反应。灵敏度决定了可检测的目标蛋白最低浓度,需在预期的检测基质(如血清、组织裂解液)中进行验证。
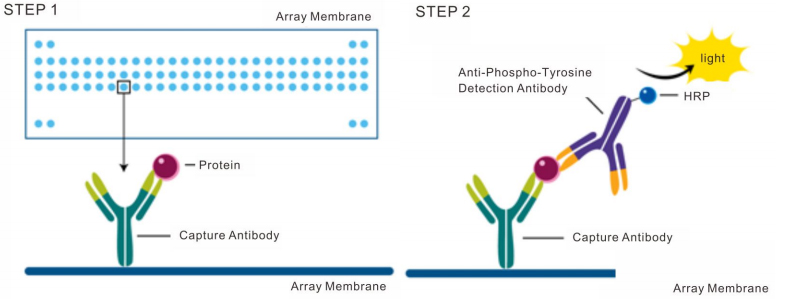
二、核心蛋白检测技术的原理与构建
基于诊断抗体的蛋白检测技术主要分为非均相与均相两大类,其构建逻辑各异。
(一)非均相检测技术
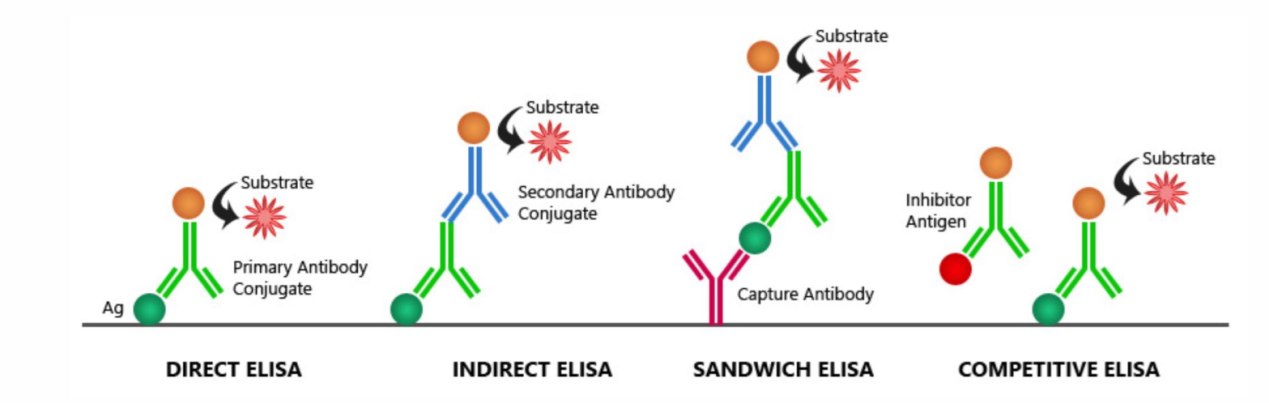
此类技术通常涉及分离与洗涤步骤,以降低背景信号。酶联免疫吸附测定(ELISA) 是其中最经典和应用最广泛的形式。其构建基于固相载体(如微孔板)包被的捕获抗体与样本中目标蛋白结合,再通过酶标记的检测抗体形成“三明治”复合物,最终通过酶催化底物产生信号。ELISA的成功构建依赖于配对抗体(捕获抗体与检测抗体)针对目标蛋白不同表位且无相互干扰。免疫层析试纸条(如侧向流免疫层析)则将抗体固定于硝酸纤维素膜的特定区域,通过毛细作用驱动样本流动,实现快速、现场检测,其构建关键在于控制抗体的标记与固定化工艺,以平衡灵敏度与检测速度。
(二)均相检测技术
此类技术无需分离步骤,操作更简便,适用于高通量筛选。均相时间分辨荧光免疫分析 利用镧系元素螯合物的长荧光寿命特性,通过能量转移或偏振原理,在溶液均相中直接检测抗体-抗原结合事件,有效消除短寿命背景荧光的干扰。化学发光免疫分析 则依赖于化学反应产生的光信号,具有极高的灵敏度与宽动态范围,其体系构建重点在于优化发光体系与免疫反应的兼容性,以及信号放大策略。
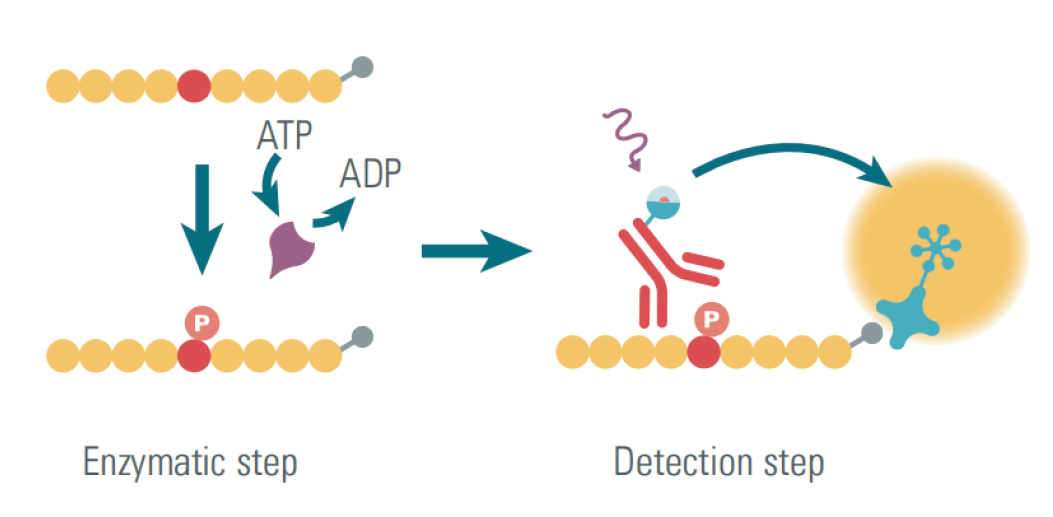
三、检测体系的关键性能参数与优化策略
一个稳健的蛋白检测体系需通过系统优化以达到临床应用或研究要求。核心性能参数包括:
1、检测限与定量限:指能够可靠检测或定量的最低蛋白浓度。优化策略包括使用高亲和力抗体、改进信号放大系统(如生物素-链霉亲和素系统)、以及降低非特异性吸附。
2、检测范围:指信号与浓度呈线性关系的区间。通过调整抗体浓度、反应时间或采用多点校准曲线进行优化。
3、精密度与准确度:分别指重复测量的一致性与测得值与真值的接近程度。需对试剂配方、操作流程及校准品进行标准化。
4、特异性与抗干扰能力:在复杂生物样本(如全血、血浆)中,样本基质可能引起干扰。可通过样本前处理、使用特异性更强的抗体或添加阻断剂来提升抗干扰能力。
四、技术挑战与发展趋势
尽管诊断抗体与蛋白检测技术已取得长足进步,但仍面临诸多挑战。首先,对于低丰度蛋白或高度同源的蛋白家族,开发具有绝对特异性的抗体仍非易事。其次,在多重蛋白检测中,不同抗体对之间的交叉干扰是技术难点。此外,实现快速、低成本、适合基层应用的超高灵敏度检测仍需突破。
未来发展趋势呈现以下几个方向:一是新型抗体开发,如纳米抗体因其体积小、稳定性高、易于穿透组织等优势,在诊断领域潜力巨大。二是多重检测技术,借助微流控芯片或编码微球平台,实现在单一样本中同时检测数十种乃至上百种蛋白标志物。三是无标记检测技术,如基于表面增强拉曼散射或生物传感器的技术,能够实时、动态监测分子相互作用。四是与人工智能结合,利用算法优化抗体设计、预测交叉反应性,并辅助分析复杂多维的检测数据,从而提升诊断的智能化与精准化水平。
五、结论:
诊断抗体的开发是蛋白检测技术的基石,其质量直接决定了检测体系的性能。从抗体的理性设计与筛选,到检测方法的科学构建与优化,是一个环环相扣的系统工程。随着分子生物学、材料科学及信息技术的交叉融合,蛋白检测技术正朝着更高灵敏度、更强特异性、更快速便捷及更高通量的方向持续演进,必将在疾病早期诊断、预后评估及基础生命科学研究中发挥愈发关键的作用。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


