癌症的发展与特定的肿瘤微环境 (TME) 高度相关,其中包括基质成纤维细胞、浸润性免疫细胞、血液或淋巴管网络以及细胞外基质。TME 中的正常细胞可以被癌细胞吸收或修饰,以产生多种生长因子、趋化因子和基质降解酶,从而增强癌细胞的增殖和侵袭。IL-6 是 TME 中常见的细胞因子,肿瘤相关巨噬细胞、粒细胞、成纤维细胞和癌细胞都是 IL-6 的主要来源. IL-6 直接作用于癌细胞以触发 STAT3 靶基因的表达,其编码的蛋白质然后驱动癌细胞增殖和存活,促进血管生成、侵袭性、转移和免疫抑制。
自噬是一种细胞内溶酶体依赖性降解系统,通常吞噬和消化受损细胞器和长寿命蛋白质,为细胞生存提供营养或 ATP,以响应细胞外和细胞内应激。自噬在多种细胞功能中起着至关重要的作用,其失调与肿瘤发生、肿瘤-基质相互作用和对癌症治疗的抵抗力有关。
一项针对性研究提出了 IL-6 如何以自噬依赖性方式调节癌症化疗耐药性:IL-6 诱导 JAK2 和 BECN1 之间的相互作用,而JAK2 直接磷酸化 Y333 的 BECN1导致 BECN1-VPS34 相互作用和自噬增强。

结果
通过不依赖 STAT3 的途径触发细胞自噬
用 IL-6 处理细胞并通过检查 LC3B-II 的积累来测量自噬水平。
1、 IL-6 以剂量和时间依赖性方式诱导 LC3B-II 的积累;
2、用 IL-6 处理稳定表达 GFP-LC3B 的细胞后,我们观察到在 IL-6 处理下绿色荧光点的数量显著增加。
结果提示: IL-6 促进自噬体形成的启动并增强 CRC 中的自噬通量。
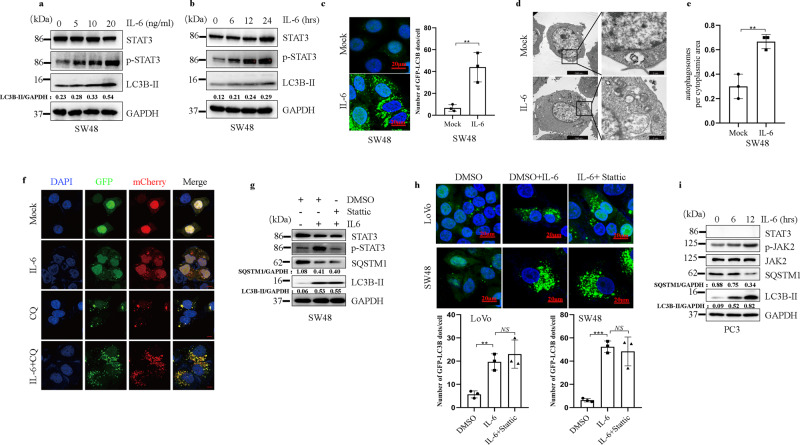
以JAK2信号依赖的方式促进细胞自噬
使用了一种 JAK2 激酶的小分子抑制剂 CHZ868评估 JAK2 是否参与 IL-6 诱导的自噬。
1、 CHZ868 在 IL-6 处理后减少了 LC3B-II 的积累并抑制了 SQSTM1 在 CRC 细胞中的降解;
2、通过药理学抑制 JAK2 激酶活性,IL-6 诱导的绿色 LC3B-II 斑点的数量增加显著减少;
3、JAK2 过表达增强了 IL-6 处理后 CRC 细胞中自噬体的形成和自噬通量。
结果提示: IL-6 以 JAK2 信号依赖的方式诱导自噬。
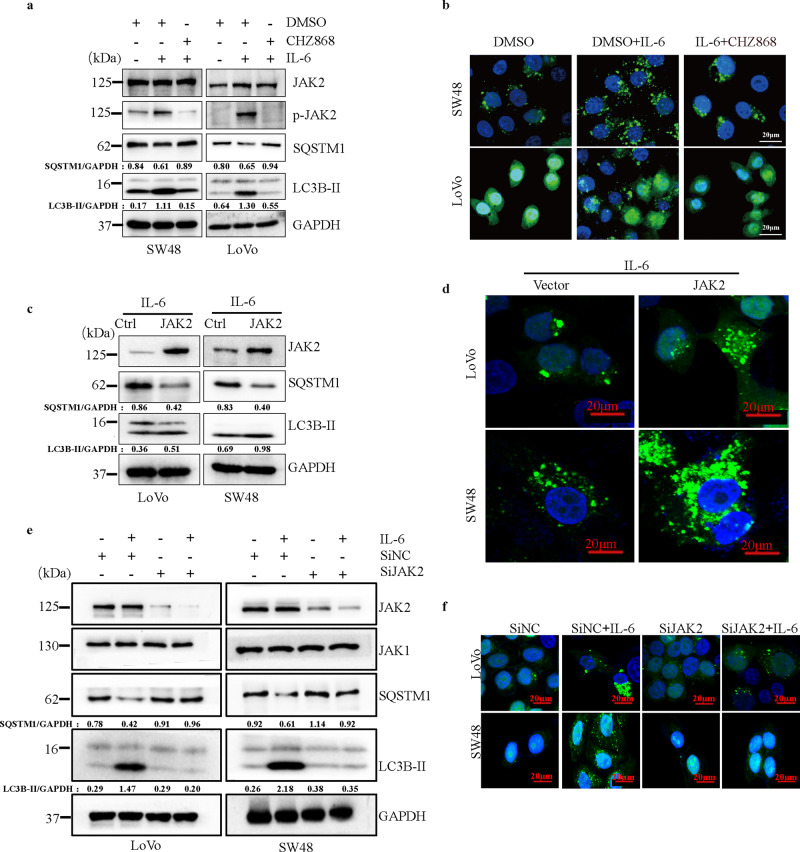
JAK2 与 Y333 处的 BECN1 相互作用并使其磷酸化
构建了一系列 JAK2 和 BECN1 突变体并转染到 293T 细胞中。
1、IL-6 治疗诱导的 BECN1 磷酸化和 JAK2 敲低在 IL-6 刺激后损害了 BECN1 酪氨酸磷酸化水平的增加;
2、与野生型 JAK2 相比,激酶失活的 JAK2 突变体和 BECN1 之间的相互作用增加;
3、JAK2 敲低显著消除了在 SW48 和 LoVo 细胞中由 IL-6 刺激诱导 p-BECN1 (Y333) 水平升高。
结果提示: IL-6 通过调节 JAK2-BECN1 相互作用和 Y333 处的 BECN1 酪氨酸磷酸化在 CRC 中发挥其前自噬功能。
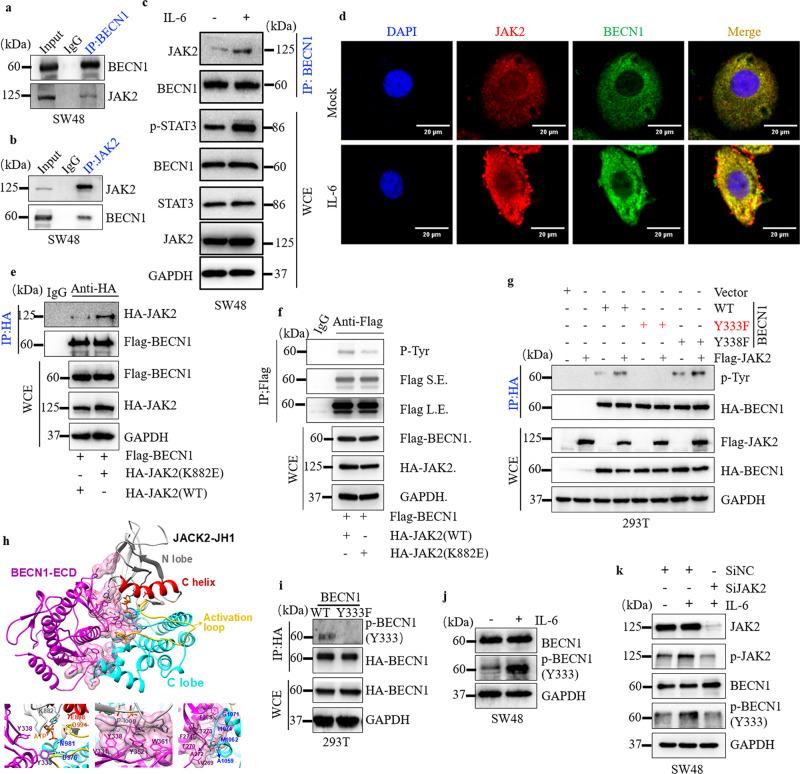
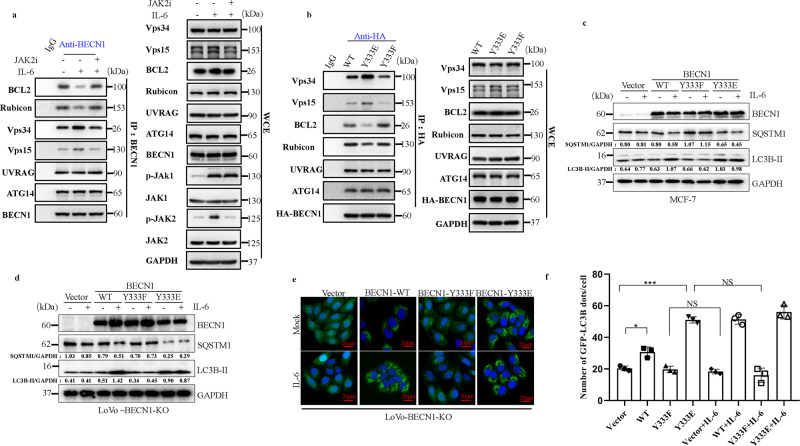
需要 BECN1 Y333 磷酸化
使用包括负调节剂( BCL-2 和 Rubicon),及正调节剂(VPS34和 VPS15)评估 IL-6 诱导的 BECN1 Y333 磷酸化的生理作用。
1、内源性 BECN1 与 VPS34 或 VPS15 之间的相互作用在 IL-6 刺激下增强,而 BECN1 与 BCL-2 或 Rubicon 之间的相互作用被消除;
2、JAK2的药理抑制显著消除了内源性BECN1与VPS34或VPS15之间的相互作用,并促进了BECN1与BCL-2或Rubicon之间的相互作用;
3、BECN1 Y333E 突变体转染的 KO-BECN1-LoVo 细胞显示出高水平的自噬;
结果提示: IL-6 诱导 JAK2 介导的 BECN1 磷酸化并通过调节 BECN1 相互作用促进自噬。
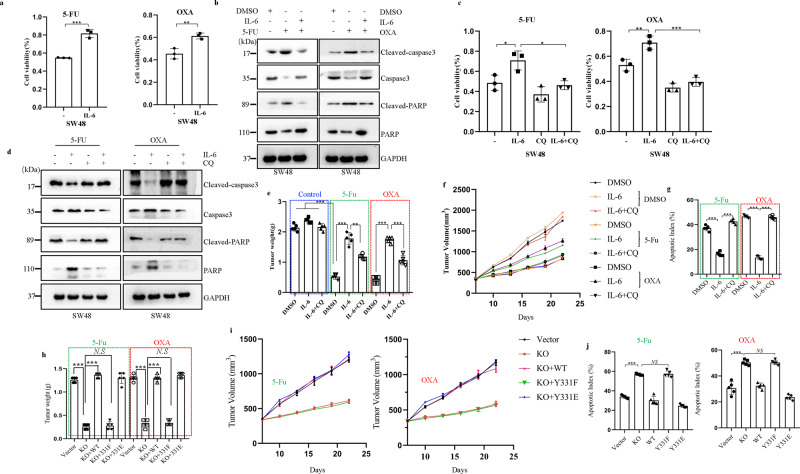
BECN1 Y333磷酸化促进化疗耐药
使用 CRC 模型并评估了 IL-6 在 CRC 化疗耐药中的潜在作用。
1、IL-6 刺激显著消除了由奥沙利铂 (OXA) 和 5-氟尿嘧啶 (5-Fu) 诱导的细胞活力降低;
2、CQ 处理再次增强了对 IL-6 诱导的 caspase-3/PARP 凋亡信号传导的抑制;
将 CT26 细胞皮下注射到 BALB/c 小鼠中以生成 CRC 异种移植模型。在用 IL-6、CQ 和化疗药物治疗后:
1、化疗药物显著抑制肿瘤的生长速度和重量,而 IL-6 治疗消除了化疗药物的抑制作用;
2、CQ 治疗阻断了 IL-6 诱导的与肿瘤生长速度和重量相关的化疗耐药性;
3、IL-6 抑制 caspase-3/PARP 凋亡信号通路的激活,并且 CQ 治疗可能逆转 IL-6 在凋亡信号通路中的保护作用。
结果提示:IL-6 通过激活自噬途径促进化疗耐药, p-BECN1 (Y333) 在 IL-6 诱导的 CRC 化疗耐药中起重要作用。
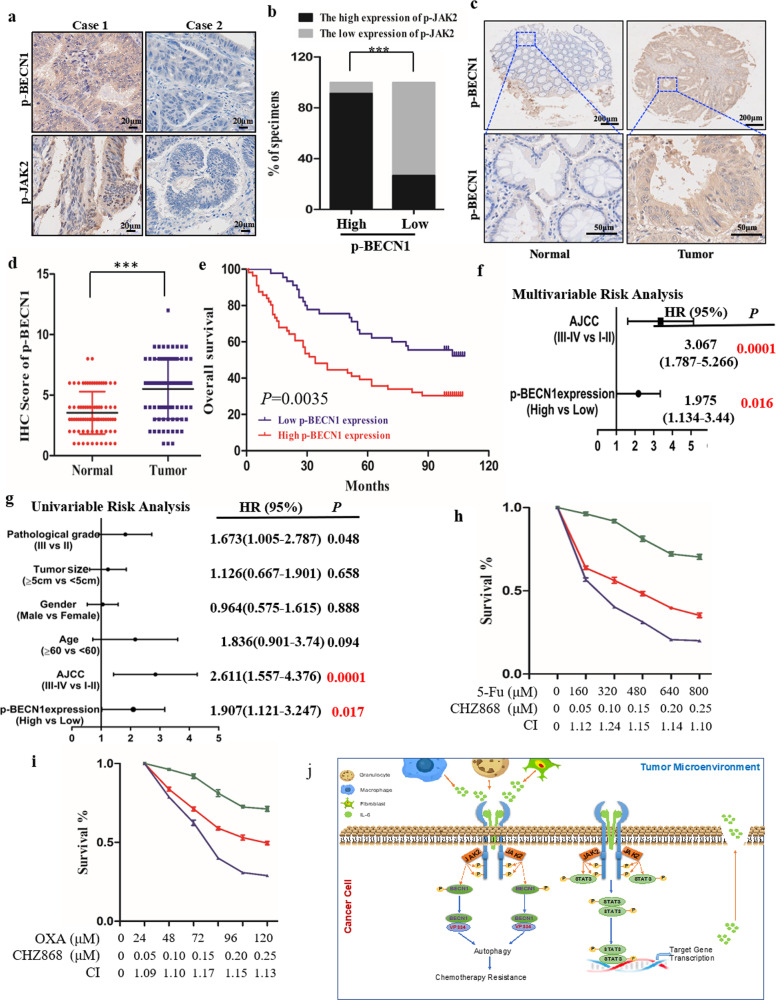
BECN1 Y333可作为预后不良及耐药标志物
评估患者 JAK2 诱导的 BECN1 Y333 磷酸化的临床价值
1、高 p-BECN1 (Y333) 水平与较差的 CRC 结果(总生存期,OS)呈正相关;
2、p-BECN1(Y333)水平是 CRC 结果的独立预测因子,在Cohort-2中具有显著的风险比;
3. JAK2抑制剂CHZ868 显著降低了5-Fu 的半数最大抑制浓度(IC50),OXA 与 JAK2 抑制剂联合使用时,结果亦然。
结果提示:JAK2/BECN1 复合物在 CRC 化疗耐药性中起重要作用,并且 p-BECN1 (Y333) 是 CRC 结果和化疗耐药性的潜在预测因子。
结论
IL-6 诱导的自噬有助于结直肠癌化疗药物反应的有效性,并且与自噬抑制剂或靶向 IL-6/JAK2/BECN1 信号通路的药物联合使用可能代表一种潜在的临床治疗策略。此外,BECN1 Y333 磷酸化可用作 CRC 预后不良的预测标志物,以及结直肠癌化疗的潜在益处和早期识别化疗耐药性的标志物。
讨论
JAK2抑制剂对实体瘤患者疗效的临床研究仍然有限。在一项涉及转移性胰腺癌成人的 II 期研究中,一种 JAK2 特异性抑制剂 Ruxolitinib 被证明具有良好的耐受性,并可能与卡培他滨联合使用可改善生存结果。在本研究中,学者发现 JAK2 抑制剂联合化疗治疗 CRC 比单独化疗更有效。尽管所提供的细胞系研究数据有限,但这一结果可能表明对 JAK2 抑制剂和化疗联合使用的 CRC 患者进行 II 期研究的可行性,尤其是在 BECN1 Y333 低磷酸化的患者中。
多平台多组学的技术应用仍是肿瘤免疫研究的主要方向。如何合理利用不同免疫治疗剂的组合以靶向多种免疫途径,并恢复免疫稳态以成功地对癌症产生适当的免疫反应仍需更多的研究。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


