|
之前的文章主要侧重在不同研究的一些进展以及研究的要点,那这次的软文就带大家一起学习一下怎样安排一篇科研性的论文。这周我们选的文献是一篇关于卵巢癌以及EMT相关机制的文章,发表在《cell death & disease》杂志中,名为《Melatonin suppresses chronic restraint stress-mediated metastasis of epithelial ovarian cancer via NE/AKT/β-catenin/SLUG axis》。 本篇文章的目的是揭示儿茶酚胺介导的卵巢癌促转移作用机制,并评价MLT是否对应激性卵巢癌裸鼠具有潜在的抗癌作用。
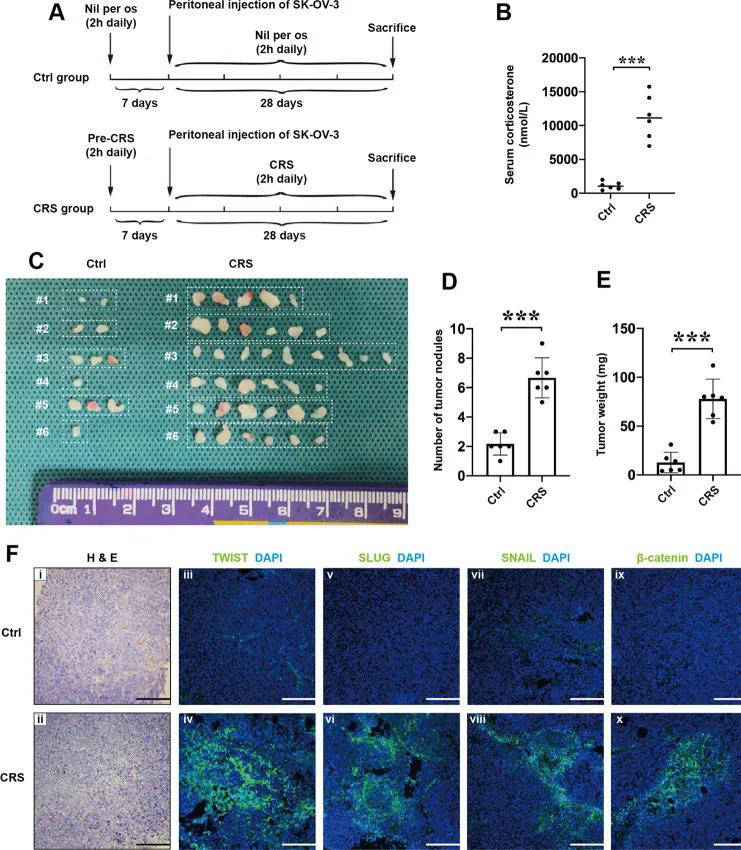
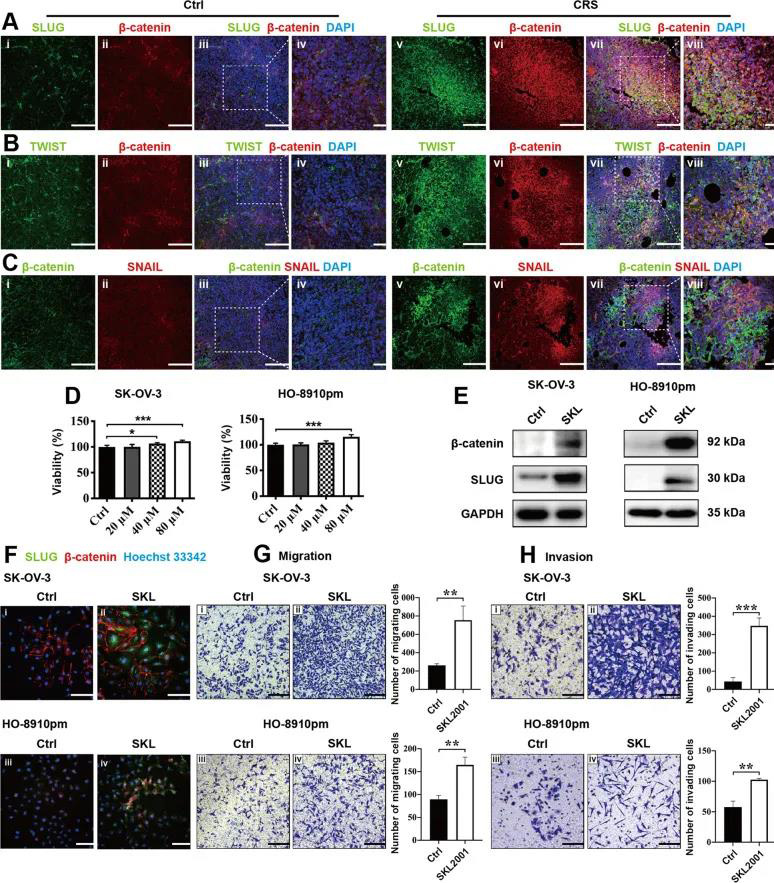
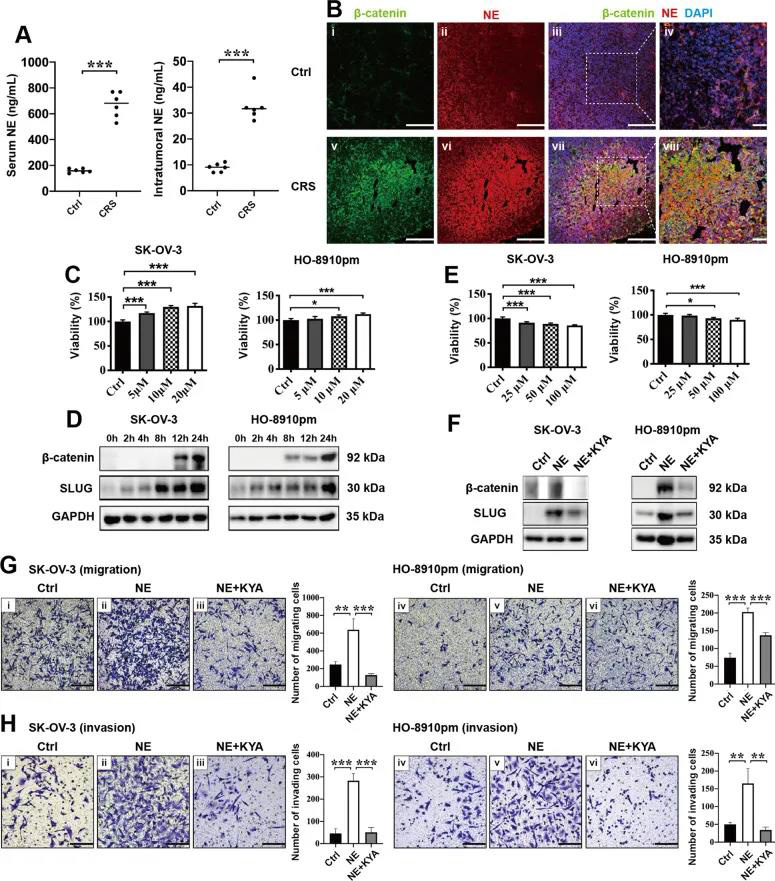
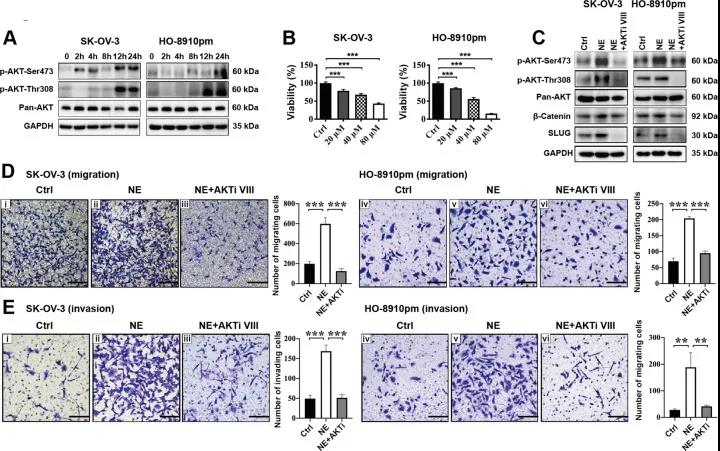
首先作者通过向裸鼠内腹膜内注射SK-OV-3细胞以及物理约束建立动物模型,分为对照组与CRS组。通过一系列实验发现CRS组的小鼠血清皮质酮浓度、肿瘤结节数量以及EMT相关转录因子(包括TWIST,SLUG,SNAIL和β-catenin)表达较对照组明显增加(图1)。 02、CRS在裸鼠模型和体外激活β-catenin/ SLUG轴 WNT /GSK-3β/β-catenin轴与EMT相关分子关系密切。作者通过免疫双染发现TWIST,SLUG和SNAIL与β-catenin的共表达在CRS组明显多于对照组(图2A-C)。结果表明,CRS可以促进EMT相关分子的表达,β-catenin可能直接调节SLUG的表达。为了进一步评估β-catenin是否调节SLUG表达,使用了β-catenin激动剂(SKL2001,SKL)。SKL在细胞实验中提高了EOC细胞的存活力(图2D),也增加了SK-OV-3和HO-8910pm细胞中β-catenin和SLUG的表达(图2E-F)。并且SKL使SK-OV-3和HO-8910pm细胞的迁移和侵袭能力增加(图2G-H)。这些结果说明,EOC细胞中的β-catenin活化促进了SLUG的表达并增加了EOC细胞的体外运动性。 03、CRS相关的NE通过裸鼠模型和体外的β-catenin/ SLUG轴促进EOC细胞的运动 慢性应激可以通过神经内分泌调节网络(例如通过NE和Epi)促进卵巢癌的进展。CRS组小鼠中血清及肿瘤裂解物中的NE浓度高于对照组(图3A),NE和β-catenin共表达结果显示CRS组的NE和β-catenin的表达增多且共表达增多(图3B)。NE使EOC细胞活力增加(图3C),促进SK-OV-3和HO-8910pm细胞β-catenin和SLUG的表达(图3 D)。β-catenin抑制剂KYA1797K (KYA)下调了β-catenin的表达。发现KYA抑制了体外EOC细胞的增殖(图3E),并降低了NE诱导的β-catenin和SLUG表达的上调(图3F)。此外,25μM KYA在体外显著抑制NE介导的EOC细胞促迁移(图3G)和入侵(图3H)作用。综上所述,这些数据表明,CRS相关的NE通过β-catenin/SLUG轴促进EOC细胞的运动。 04、NE对SK-OV-3卵巢癌细胞中各种磷酸激酶的磷酸化有上调作用 β-catenin是WNT信号通路的重要组成部分。其蛋白质的稳定性和降解是由泛素化、磷酸化或其他类型的复杂机制调控的。为了阐明NE是否通过磷酸化激酶介导的β-catenin稳定化调控β-catenin/SLUG轴和癌症运动,研究人员利用人磷酸化激酶阵列(antibody array)来发现NE如何影响SK-OV-3细胞中肿瘤前激酶的表达谱。NE使阵列中的位点上调了50%(图4A)。作者利用多个生物信息学数据库对SK-OV-3细胞中NE上调前20个蛋白进行蛋白互作(protein protein interaction, PPI)、基因本体(Gene Ontology, GO)、pathway、蛋白结构域分析,发现NE显著上调激酶相关结构域。这些结果表明NE对SK-OV-3细胞中各种磷酸化激酶的磷酸化具有巨大的影响,AKT信号通路可能在NE介导的β-catenin的稳定中发挥重要作用(图4B-K)。 05、NE通过体外磷酸化AKT激活β-catenin/ SLUG轴 接下来作者分析了AKT是否参与EOC细胞中NE介导的β-catenin/ SLUG轴的激活。NE增加SK-OV-3和HO-8910pm细胞中Ser473和Thr308残基的磷酸化水平(图5A)。AKT抑制剂(AKTi VIII)抑制EOC细胞的活力(图5B),降低了EOC细胞中Ser473和Thr308残基的磷酸化水平(图5C),减少了EOC细胞中NE介导的β-catenin/ SLUG轴的上调(图5C),同时减少了细胞的迁移和入侵(图5E)。这些数据表明AKT磷酸化参与NE诱导EOC细胞中β-catenin/ SLUG轴的激活。 06、NE和β-catenin的表达与卵巢癌临床分期有关 为了进一步研究NE和β-catenin在卵巢癌中的表达并分析其临床病理意义,作者在88例患者的癌组织中检测了NE和为β-catenin的表达。结果显示β-catenin在癌细胞中表达最多,肿瘤基质中很少表达(图6A);癌组织中的表达多余癌旁组织(图6C);且随卵巢浆液性癌的恶变程度而增加(图6B)。但是,在I–II期卵巢癌的各种亚型中,β-catenin的表达没有意义(图6D)。而NE的表达位于癌细胞和肿瘤基质中(图6E),与β-catenin的表达一致(图6F-J)。作者进一步研究了β-catenin和NE在卵巢良性肿瘤和卵巢浆液性肿瘤中的相关性,结果显示NE的表达与β-catenin在卵巢良性肿瘤和恶性肿瘤中的表达均有显著相关性。 07、褪黑素通过下调裸鼠模型和体外NE / AKT /β-catenin/ SLUG轴来抑制CRS介导的对EOC细胞的转移促进作用 接下来作者对褪黑素(MLT)在CRS模型中对EOC细胞发挥的作用进行了研究。首先作者做了动物实验,将动物分为Ctrl + PBS、Ctrl + MLT、CRS + PBS、CRS + MLT四组(每只小鼠2*106个细胞)。结果显示与pbs注射组相比,Ctrl组和CRS组MLT注射组小鼠的肿瘤大小、重量、腹部肿瘤结节数均明显减少(图7A-B)。注射MLT后,小鼠血清和肿瘤组织中MLT的浓度均明显高于PBS注射小鼠(图7C)。通过IF染色,作者发现MLT显著抑制CRS诱导的NE、β-catenin、SLUG在肿瘤组织中的上调(图7D-F)。体外实验发现MLT抑制了EOC细胞的活力,减少NE诱导的AKT磷酸化,β-catenin表达和SLUG表达的上调;细胞的迁移和入侵减少(图7G-J)。这些结果表明,MLT通过下调NE / AKT /β-catenin/ SLUG轴对CRS或NE介导的对裸鼠卵巢癌细胞的促转移作用产生抑制作用。 08、褪黑素抑制EOC细胞中β-catenin介导的SLUG表达的转录调控 作者接下来评估了β-catenin是否转录调节NE处理的EOC细胞中SLUG的表达。IF结果显示,NE显着增加了SK-OV-3和HO-8910pm细胞中β-catenin和SLUG的表达,并且其表达被KT抑制剂,β-catenin抑制剂和MLT下调(A-H)。此外,作者评估了EOC细胞中β-catenin介导的SLUG转录调控。结果表明,NE显着促进了EOC细胞中SLUG启动子的激活,而AKTi,KYA和MLT则降低了NEC启动子的激活(图8 I)。结合蛋白质印迹和IF染色的数据,这些结果表明NE通过改善EOC细胞中β-catenin的核定位和转录功能来促进SLUG表达。 本文总结 1. 首次报道了一种新的分子机制,即NE介导的AKT/β-catenin/SLUG轴的激活促进CRS诱导的卵巢癌转移,这部分提示了对卵巢癌患者的负面情绪进行心理、行为、药物干预的必要性。 2. MLT抑制了NE诱导的卵巢前转移作用,这支持了MLT在卵巢癌治疗中的潜在临床应用。 3. 进一步的研究将集中于直接调控NE如何激活AKT激酶,以及β-catenin中的哪些磷酸化残基对NE/AKT信号通路起作用。
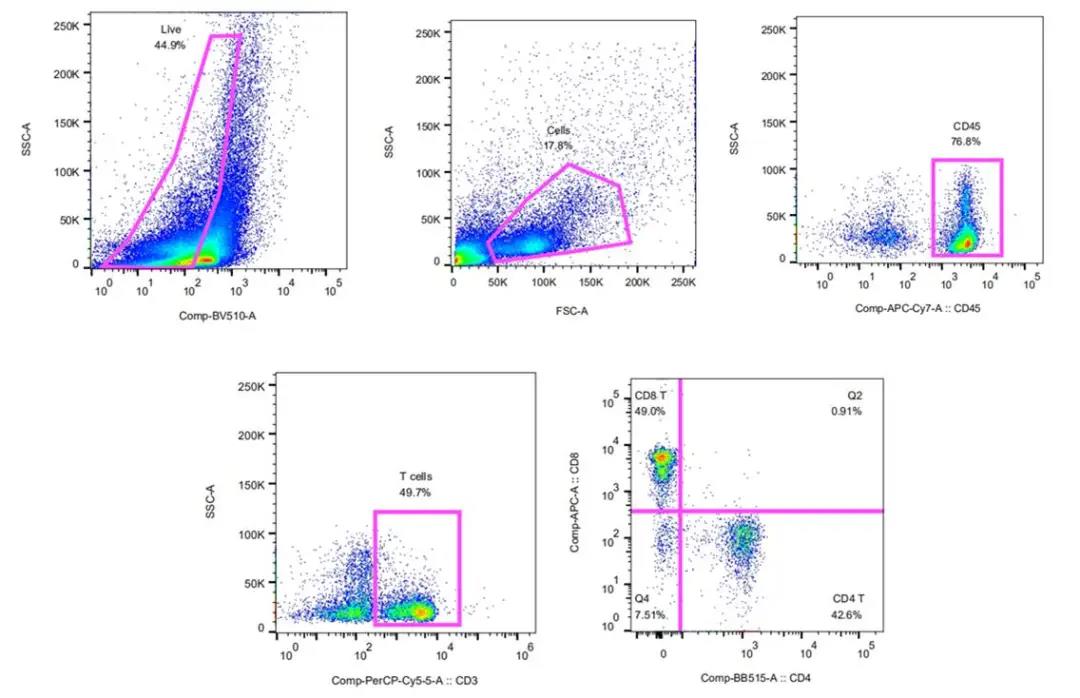
本文涉及技术: 流式检测分析 本文涉及技术: 免疫组化 |













 沪公网安备31011502400759号
沪公网安备31011502400759号
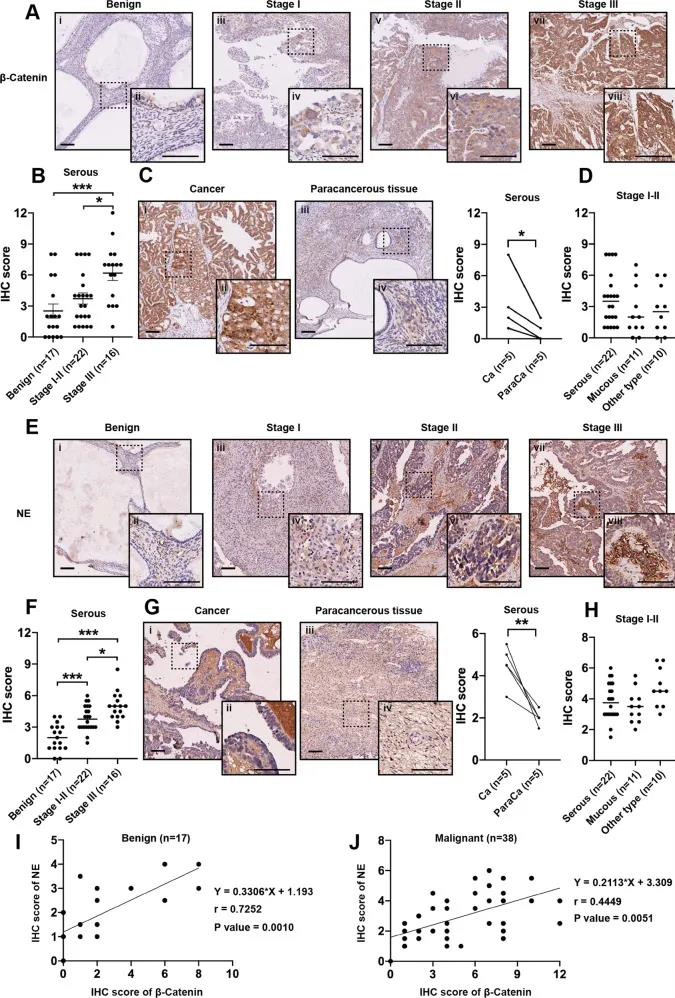
 营业执照(三证合一)
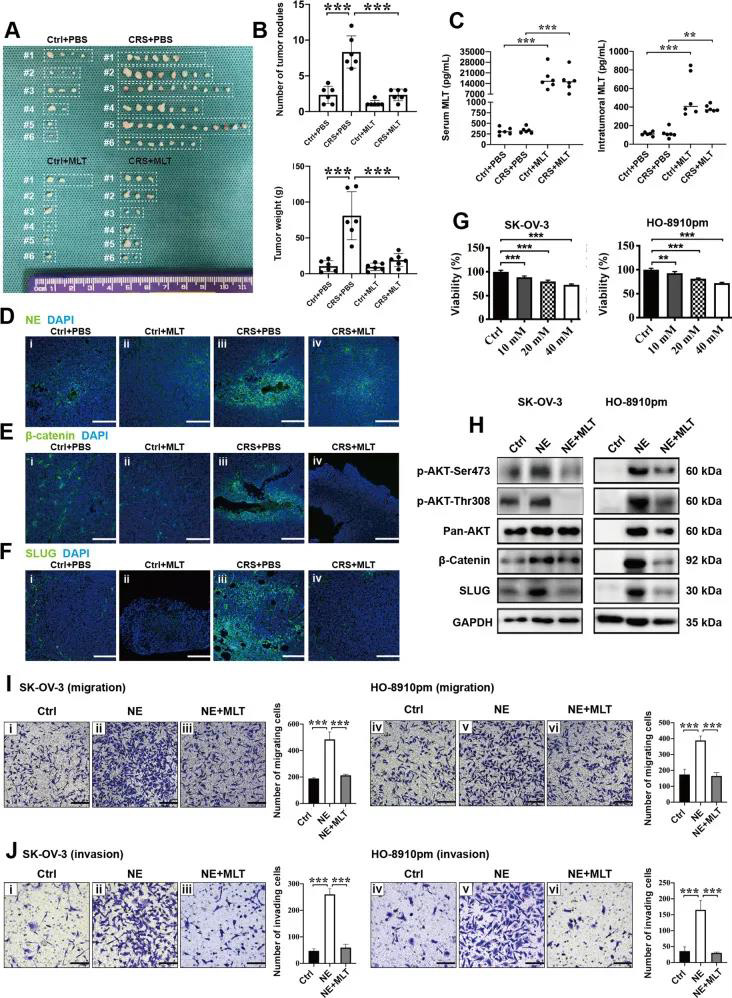
营业执照(三证合一)


