Hello,各位小伙伴,秋高气爽,十月以来实验顺利否呀?上期我们讲到单细胞在非模式物种中的应用,这次回到单细胞多组学研究,和大家聊一聊转录组+免疫组在多组学中的分析思路和方法。
今天和大家分享的是2024年6月发表于《Glioblastoma-Infiltrating CD8+ T Cells Are Predominantly a Clonally Expanded GZMK+ Effector Population》。这篇论文总结了在胶质母细胞瘤(GBM)患者中,T细胞免疫治疗的效果有限的原因。研究团队对来自15名高等级胶质瘤患者(包括GBM和IDH突变的4级星形胶质瘤)的肿瘤浸润淋巴细胞(TIL)进行了单细胞转录组V(D)J测序。研究发现,与匹配的外周血相比,肿瘤中的CD8+ TIL表现出GZMK+效应T细胞的克隆扩增。此外,将这些数据与其他癌症类型进行整合时,发现GBM TIL中缺乏典型的耗竭CD8+ T细胞群体。结果表明,GZMK+效应T细胞在GBM微环境中代表了一个重要的T细胞亚群,并可能具有潜在的治疗意义。
一:初级和复发性高等级胶质瘤中浸润了多样化的T细胞状态,明显缺乏耗竭状态
为了表征胶质母细胞瘤(GBM)中的肿瘤浸润T细胞状态和克隆多样性,以更好地理解为何这些肿瘤中的T细胞可能无法通过检查点抑制免疫疗法获得激活,作者对一组高等级胶质瘤(HGG)患者样本进行了单细胞转录组CITE-seq加V(D)J测序。该样本组包括9例IDH野生型GBM和1例IDH突变的4级星形胶质瘤(G4A),其中包括7例初级GBM、2例复发性GBM和1例复发性G4A,以及5例匹配的外周血单核细胞(PBMC)样本( 3例与初级肿瘤匹配,2例与复发性肿瘤匹配)。在引用与其他疾病分开的具体诊断时,作者将“胶质母细胞瘤,IDH 野生型”称为“GBM”,将“星形细胞瘤,IDH 突变型,4级”称为“G4A”。但在将这两种诊断作为一个队列进行讨论时,使用术语高级别胶质瘤 (HGG)。CITE-seq和V(D)J测序的应用使我们能够在单细胞基础上交叉分析转录组、克隆和蛋白质组信息。具体来说,T细胞通过CD3表达富集,采用荧光激活细胞分选,使用TotalSeq抗体进行染色,随后通过CITE-seq进行表征(图1A)。对32,320个T细胞进行UMAP降维,基于基因和蛋白质表达识别了T细胞状态(图1B和1C)。检测到的T细胞状态包括:CD4+初始(TN)、中心记忆(TCM)、效应记忆(TEM)、活化、GZMK+效应(TEff)、重新表达CD45RA的效应记忆T细胞(TEMRA)和调节性T细胞(Treg);CD8+初始(TN)、NR4A2低/高GZMK+效应(TEff)、细胞毒性驻留记忆(TRM)、重新表达CD45RA的效应记忆(TEMRA)和MAIT样T细胞;以及增殖和应激特征的T细胞(图1C和1D)。在某些情况下,蛋白质的高表达与RNA表达相关。在其他情况下,虽然蛋白质高度表达,但与RNA表达无关(例如,CD4和CD45RA)。最后,一些蛋白质的表达中等,且与RNA的相关性较差(例如,CD27)。来自HGG的TIL主要由效应T细胞组成,例如CD4+ TEM、CD4+和CD8+ GZMK+ T细胞、细胞毒性TRM和TEMRA,而来自匹配PBMC样本的T细胞主要属于TN或TEMRA细胞状态(图1E和1F)。
为了评估高等级胶质瘤(HGG)肿瘤浸润T细胞(TIL)的表型,作者分析了几种细胞表面蛋白的共刺激和共抑制标记。多个激活和细胞毒性T细胞群体表达了高水平的CD69和CD278/ICOS(图1G)。然而,几种常见的共刺激表面受体,如CD137/4-1BB、CD357/GITR和CD134/OX40的表达并不明显。最后,CD244/2B4(也由T细胞表达的NK细胞受体)在多个CD8+ T细胞群体中高度表达,包括GZMK+、细胞毒性TRM、TEMRA和MAIT亚群。虽然PD-1在几个亚群中表达,但其他与耗竭相关的标记(如TIGIT、LAG-3、BTLA和CTLA-4)水平显著较低(图1H)。为了确定这些表达PD-1的群体是否呈现耗竭的转录状态,作者应用了来自黑色素瘤TIL的28基因表达基础耗竭特征到HGG TIL队列。通过对每个细胞的这一特征表达进行了评分,观察到CD8+ NR4A2hi GZMK+ TEff(C10)和调节性T细胞(C14)群体的表达略高(图1I和1J),而CD8+ NR4A2lo GZMK+ TEff(C9)的该特征表达则较低。对于每个T细胞群体,PBMC和TIL样本之间的评分相似。在使用不同技术(如SmartSeq和10X 3’测序)生成的其他GBM单细胞数据集中,也有类似的发现,表明GBM浸润的CD8+ T细胞表现出弱的与耗竭相关的共抑制受体表达特征(包括PDCD1、CTLA4、HAVCR2、LAG3和TIGIT)。当使用与这些研究相似的抑制特征(PDCD1、CTLA4、HAVCR2、LAG3、TIGIT和BTLA)时,作者发现多个亚群中抑制特征的相对高表达,尤其是在Tregs(C14)群体中。总体而言,这些抑制受体的转录和配对蛋白表达表明,HGG TIL中缺乏典型的耗竭T细胞亚群。
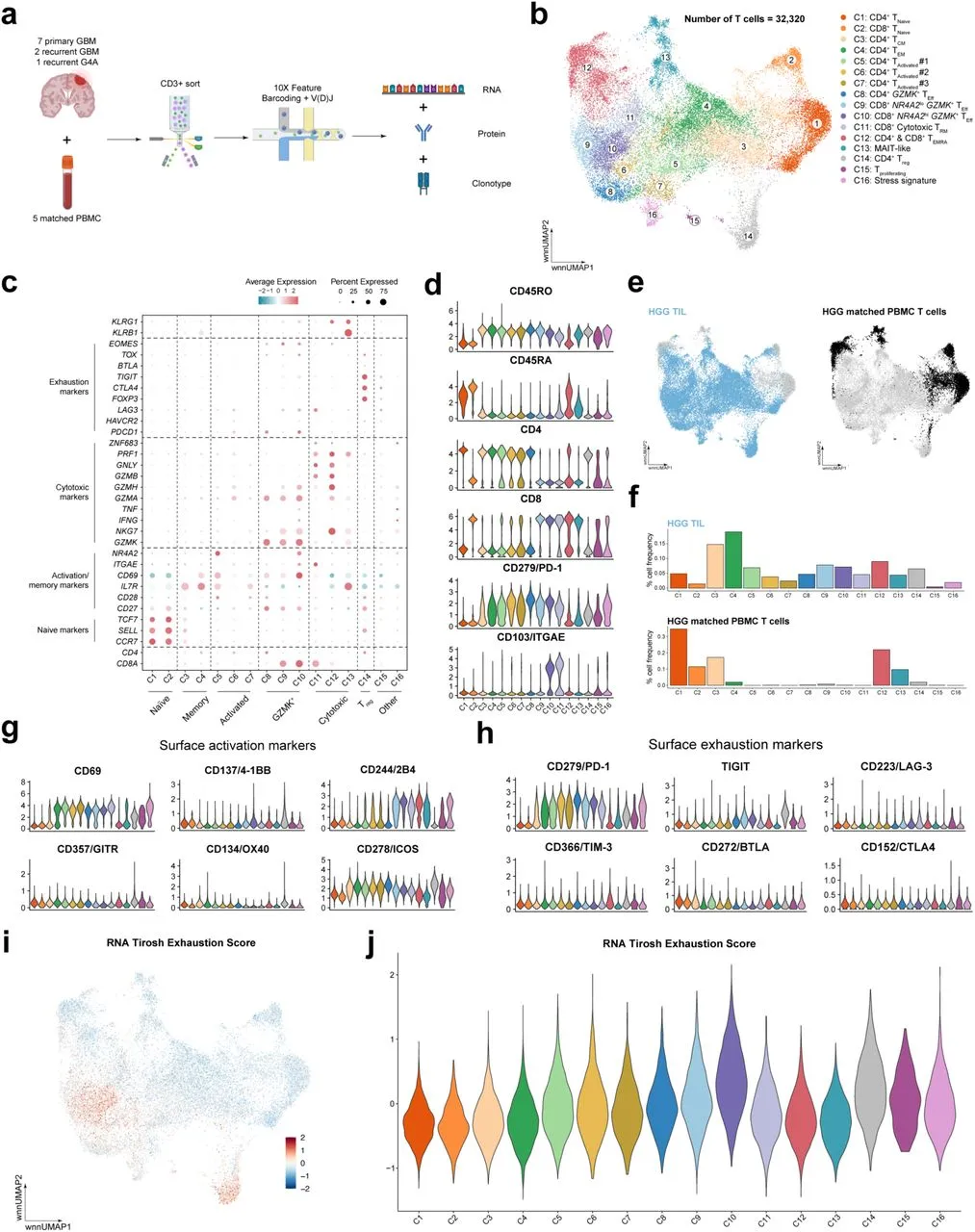 图1:单细胞制备和测序显示了 HGG 中多样化的 TIL特征
图1:单细胞制备和测序显示了 HGG 中多样化的 TIL特征
二:大部分GBM TIL中的CD8+ T细胞是GZMK+,且可能与TEMRA细胞独立发育
对10,749个CD8+ T细胞进行重分群和UMAP降维之后观察到HGG CD8+ TIL中更多地由GZMK+ T细胞(分别为NR4A2lo或NR4A2hi,C9和C10)组成,而不是细胞毒性CD8+ TRM(C11)和TEMRA(C12)。在PBMC中,GZMK+ TEff(C9)也存在,但TN、TEMRA和MAIT样细胞状态是最常见的细胞类型(图2B和2C)。与Mogilenko等人在老龄小鼠中观察到的GZMK+ T细胞类似,CD8+ GZMK+ T细胞表达高水平的CD45RO、CD27、CD28和PD-1,而IL7R的蛋白水平较低(图2D)。在转录上,这些细胞中TOX和EOMES的水平适中,而TCF7的水平较低,这也在Mogilenko等人的老龄小鼠GZMK+ T细胞群体中观察到。值得注意的是,这些T细胞表达高水平的GZMK和GZMH,但经典细胞毒性标记如GZMB、IFNG和PRF1的表达水平较低。为了验证GZMK在TIL与PBMC之间的蛋白水平上是否上调,作者对收集的GBM患者样本中的TIL和PBMC进行了流式分析(图2E和2F)。针对MAIT TCR-CD45RO+ CD8+ T细胞,因为MAIT T细胞同时表达GZMK和GZMB,作者发现GZMK+GZMB-和GZMK+GZMB+ T细胞群体在TIL中比在PBMC中更丰富(分别为20.900 +/- 4.763% vs. 7.212 +/- 5.749%,49.167 +/- 11.133% vs 18.688 +/- 12.760%,p<0.05,Mann-Whitney U检验)。与此同时,GZMK-GZMB+ T细胞在PBMC中相较于TIL更为丰富(59.500 +/- 21.318% vs. 19.167 +/- 7.920%,p<0.05,Mann-Whitney U检验)。在作者单细胞数据中未观察到GZMK+GZMB+ MAIT- T细胞,作者认为只是单细胞RNA测序的局限性,该方法并不一定代表所分析细胞的真实蛋白水平表型。在类风湿性关节炎患者中也观察到了类似的现象,在转录水平观察到两个主要的CD8+ T细胞亚群,一个具有高GZMK+表达,另一个具有高GZMB+表达,而在蛋白水平上则观察到了三个群体(GZMK+GZMB-、GZMK+GZMB+和GZMK-GZMB+)。
为了更深入地了解GZMK+ T细胞的发展与其他效应亚群的关系,使用monocle2对选定的CD8+ T细胞簇进行了拟时序分析。该分析揭示了几个细胞状态和分支点,起始于TN(分支状态5),随后发展为NR4A2lo GZMK+ TEff和细胞毒性TRM,这两者在多个分支中均匀分布。从这些T细胞状态中,CD8+ T细胞分裂为TEMRA(分支状态4)或NR4A2hi GZMK+ T细胞(分支状态1)(图2G和2H)。这些结果表明,NR4A2lo GZMK+和细胞毒性TRM可能代表一个细胞群,从中可以发展出终末分化的T细胞。在对沿伪时间轴绘制的200个差异表达基因进行层次聚类后,作者识别出几个独特的基因特征。首先,与naïve T细胞状态相关的基因,如CCR7和SELL,在轨迹的起始阶段高度表达。相反,经典的细胞毒性基因,如GNLY、PRF1和GZMB,在轨迹的中间阶段高度表达,而与GZMK相关的基因,如CCL4和CCL5,则在最后阶段一起高度表达。高度表达于NR4A2hi GZMK+ Teff亚群的基因,如与TCR激活相关的JUNB和FOS,在轨迹的最后阶段单独聚类并高度表达(图2I)。这些结果结合GZMK蛋白的验证数据,提示NR4A2lo GZMK+ TEff细胞可能起源于经典的细胞毒性T细胞(仅表达GZMB),经历GZMK+GZMB+细胞状态的过渡,并最终分化为NR4A2hi GZMK+ TEff。
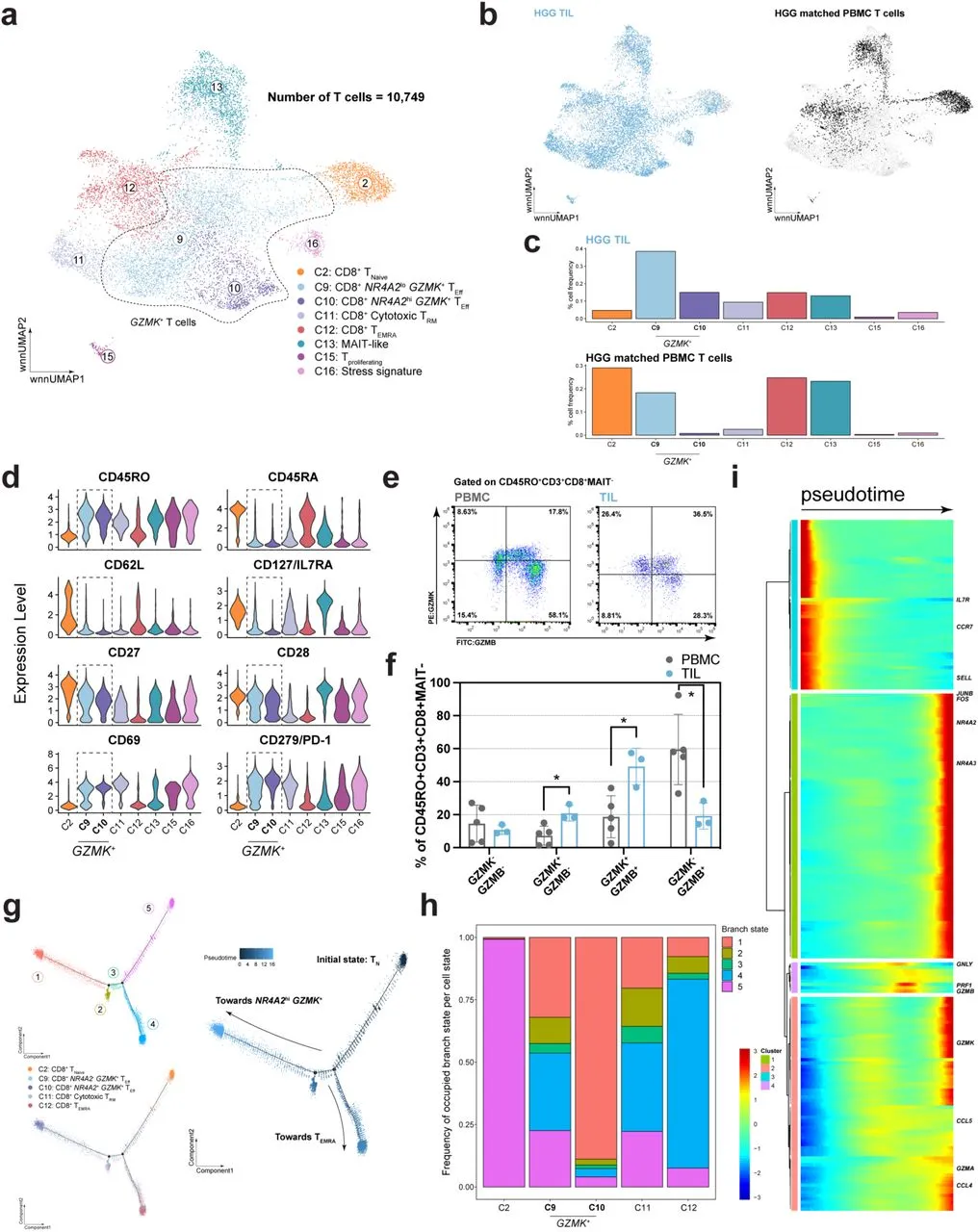 图2:GZMK 效应 T 细胞代表 CD8 TIL 的很大一部分,且可能与TEMRA细胞独立发育
图2:GZMK 效应 T 细胞代表 CD8 TIL 的很大一部分,且可能与TEMRA细胞独立发育
三:原发性和继发性脑癌的TIL中富含GZMK+ T细胞
为了进一步验证作者的发现并探索GZMK+ T细胞是否在其他脑恶性肿瘤中富集,作者使用scRNA-seq对另外一个恶性脑肿瘤患者样本队列的T细胞进行了特征分析,该样本包括4个GBM样本(4个原发性GBM)、2个G4A样本(1个原发性和1个复发性),以及5个具有不同组织学的脑转移样本。这些样本与最初的GBM样本的scRNA-seq数据进行了整合,并将初始队列中衍生的T细胞状态应用于整合数据集(图3A)。值得注意的是,观察到几种新的细胞状态,特别是耗竭的CD4+ T细胞,它们表达高水平的PDCD1、LAG3、HAVCR2和EOMES(C12),而其他细胞状态,如NR4A2lo/hi GZMK+ CD8+ T细胞的区别,仅在进一步分群后发现(图3B-3C)。这些耗竭的CD4+ T细胞主要来源于BrMet027,这是一个源自乳腺癌的脑转移。该簇中的细胞在Tirosh RNA耗竭标记和RNA抑制标记中得分均很高(图3D和3E)。
这些发现支持了之前的观察,即虽然GZMK+ T细胞表现出低水平的耗竭和抑制基因表达,但它们并不符合经典的耗竭T细胞的传统转录组特征。与最初的scRNA-seq数据集相比,增加这些新HGG样本后,NR4A2lo/hi GZMK+ T细胞的比例相似(分别占总T细胞的16.5%和15.0%),进一步支持了HGG中GZMK+ T细胞的存在。有趣的是,BrMet样本中GZMK+ T细胞的比例也相似地很高(13.7%),这表明GZMK+ T细胞的存在并不限于HGG,还可以在其他脑恶性肿瘤中发现(图3B和3C)。通过进一步分析CD8+ T细胞,可以区分了NR4A2hi和NR4A2lo GZMK+ T细胞,并明确了BrMet样本中GZMK+ T细胞的富集,GZMK+ T细胞占据了CD8+ T细胞整体的30%以上(图3F和)。鉴于HGG和脑转移中GZMK+ T细胞的总体高频率,作者接下来旨在定义特定于CD8+ GZMK+ T细胞的基因特征。为此,识别了NR4A2lo/hi GZMK+ T细胞中前25个差异表达基因(DEGs),并进行了功能富集分析。相关的生物通路包括“主要组织相容性复合体II类蛋白组装”,富集基因如HLA-DRA,以及“淋巴细胞介导的免疫”,富集基因如CD27。鉴于HLA-DRA表达与T细胞激活相关,这些通路表明GZMK+ T细胞是被激活和经历过抗原的。因此,这些数据支持在GBM和BrMet CD8+ TIL中GZMK+ T细胞的高占比,并且它们富集于T细胞激活和之前抗原暴露相关的通路。
 图3:BrMet样品显示GZMK+ 效应 T 细胞的耗竭特征
图3:BrMet样品显示GZMK+ 效应 T 细胞的耗竭特征
四:GZMK+ TIL在癌症类型中广泛存在
鉴于GZMK+ T细胞不仅在GBM中占据了CD8+ TIL的较大比例,而且在异质性的脑转移(BrMets)中也同样如此,作者探索了GZMK+ T细胞是否存在于中枢神经系统以外的癌症中。为此,作者将来自HGG和BrMet数据集的CD8+ T细胞与包括1)全癌症TIL数据集、2)黑色素瘤数据集、3)GBM数据集和4)胰腺导管腺癌(PDAC)数据集共计20种不同的癌症类型。观察发现,按照作者的基因特征定义并得到原始注释支持的GZMK+ TIL在多种肿瘤类型中存在,并且同样分为两个不同的簇:NR4A2hi GZMK+和NR4A2lo GZMK+(图4A和4B)。NR4A2hi GZMK+ TEff高度表达与TCR激活相关的多个基因,如CD74、CRTAM和JUNB。与此同时,NR4A2lo GZMK+ T细胞未表达这些特定基因,表明这些T细胞没有最近被抗原刺激激活。在非小细胞肺癌(NSCLC)患者样本中也观察到了GZMK+ T细胞的类似分离,支持了作者的观察,即NR4A2表达可能划分不同的激活特征。与本文数据集相比,独立的GBM数据集中NR4A2lo GZMK+ TIL的频率较高,而NR4A2hi GZMK+ TIL的水平相似,表明作者的发现可以推广到不同的队列、处理协议和分析流程。通过比较不同癌症类型中GZMK+ T细胞的频率,作者发现HGG肿瘤拥有一群频率最高的GZMK+ T细胞,无论NR4A2的表达如何。使用规范基因标记和原始注释鉴定了耗竭T细胞群,并与GZMK+ T细胞分开聚类,作者对耗竭T细胞和GZMK+ T细胞的耗竭转录水平进行了比较。与之前的观察一致,GZMK+ T细胞(无论是NR4A2hi还是NR4A2lo)(C3和C4)表达的RNA抑制和Tirosh耗竭标记的水平低于耗竭T细胞(C8)(p<2.2e-16,Mann-Whitney U检验)。此外,GBM/HGG数据集在分析的20种癌症类型中拥有最低频率的耗竭T细胞(本文数据集中为7.67%,已发布的GBM数据集为7.93%)(图4C)。十三种癌症类型(图4C中的红色条),包括作者的BrMet样本,相比于作者的数据集具有显著更高的耗竭TIL频率,其中黑色素瘤TIL的频率最高(27.6%,p<0.05)。仅有两种癌症类型(图4C中的蓝色条),结直肠癌(CRC)和胰腺导管腺癌(PDAC),其耗竭TIL的频率显著低于本文的队列数据集。在耗竭的T细胞群体中,GBM/HGG来源的TIL在RNA抑制和Tirosh耗竭标记的表达水平最低。与所有其他肿瘤类型相比,这些水平在统计上显著更低(p<2.2e-16,Mann-Whitney U检验)。这一观察支持并扩展了Naulaerts等人的最近结论,即与高水平经典耗竭的肿瘤类型(如黑色素瘤)相比,GBM中表达耗竭标记的T细胞较少。
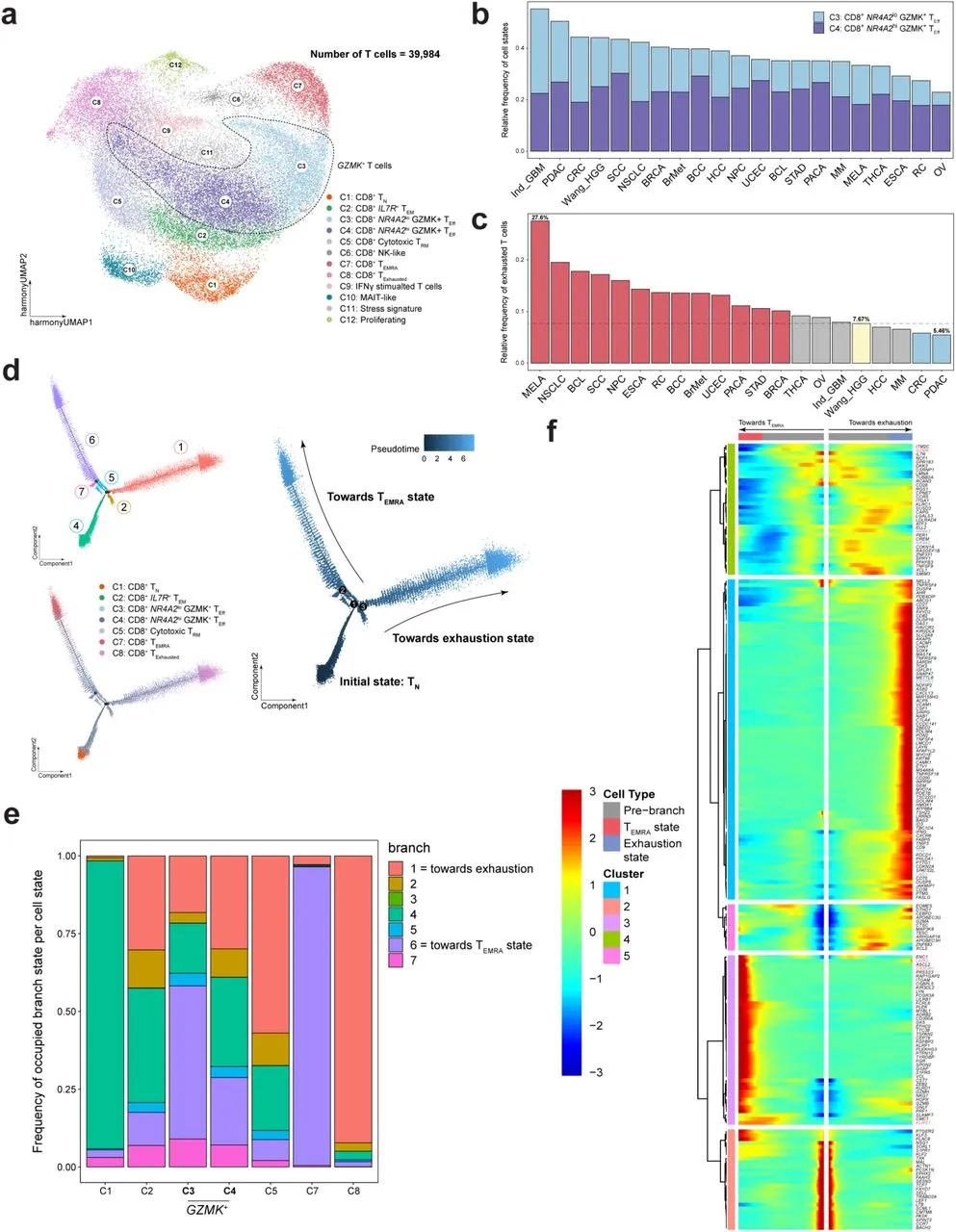 图4:GZMK+ T 细胞在多种癌症类型中富集,并与耗竭的T细胞分开聚集。
图4:GZMK+ T 细胞在多种癌症类型中富集,并与耗竭的T细胞分开聚集。
五:肿瘤微环境中的GZMK+ T细胞的克隆扩增
在完成了亚群分析之后,确定了GZMK+ T细胞作为研究目标,并且进一步在泛癌中揭示了其广泛性之后,作者在最后利用了免疫组信息来进行了克隆扩展的分析来进一步刻画GZMK+ T这类细胞的特征。
之前的几项研究已经证明,GBM中的T细胞亚群是克隆扩增的。因此,作者使用单细胞V(D)J测序研究了GZMK表达与克隆型多样性和扩增之间的关系。在18,650个测序的CD8+ T细胞中,11,360个T细胞(60.9%)含有成对的αβ TCR(图5A)。T细胞扩增状态定义如下:计数为1的TCR标记为单克隆,计数为2的标记为双克隆,计数大于2但小于或等于50的标记为扩增,计数大于50的标记为超扩增。在所有T细胞状态中,正如预期,TN(C0)主要是单克隆,而约50%的NR4A2lo GZMK+(C9)、NR4A2hi GZMK+(C20)和细胞毒性TRM(C10)簇,以及多达75%的TEMRA簇(C12)是扩增或超扩增的(图5B)。在调查每种样本类型的前50个克隆扩增TCR的相关T细胞状态时,在PBMC和HGG样本中,前3最扩增的TCR中有2个是不可变的MAIT TCR。在与这些克隆扩增TCR相关的细胞总数中,PBMC和HGG中与MAIT T细胞状态相关的比例分别为34.1%和11.9%。在PBMC中,TEMRA除了MAIT T细胞扩增的占比最多(35.1%)。NR4A2lo GZMK+、NR4A2hi GZMK+和细胞毒性TRM仅占总扩增T细胞的9.80%、11.6%和8.97%,而在HGG TIL中,GZMK+ T细胞的克隆扩增最多,NR4A2lo和NR4A2hi GZMK+ T细胞的比例相对均等(分别为24.4%和29.1%),并且与PBMC中的相应群体相比显著富集(分别为9.80%和11.6%,p<0.05,Fisher检验)。同时,细胞毒性TRM和TEMRA在HGG样本中的克隆扩增T细胞中仅占9.86%和20.4%。最后,在BrMet样本中,细胞毒性TRM占据了克隆扩增T细胞的最大比例(29.2%),其次是NR4A2lo和NR4A2hi GZMK T细胞(分别为18.2%和28.4%)(图5C)。这些结果表明,与脑肿瘤微环境中的其他T细胞亚群相比,GZMK+ T细胞与最扩增的TCR相关。更重要的是,这些富集的克隆型在NR4A2hi和NR4A2lo GZMK+ T细胞中共享,支持了作者的假设,即NR4A2hi GZMK+ T细胞可能源自NR4A2lo GZMK+ T细胞。有趣的是,在不同肿瘤类型之间,GZMK+ T细胞在HGG中占据了更大的T细胞比例,而细胞毒性TRM在后者中更为丰富。
为了确定GZMK+ TEff所表达的扩增TCR是否与其他T细胞状态共享,作者分析了与GZMK+ TEff相关的前10个扩增非MAIT TCR的克隆型计数、分布和相关T细胞状态。在两名患者的自体匹配PBMC和TIL上进行了成对分析(图5D),就 GBM106 而言,GBM106 PBMC中与GZMK+ T相关的前10克隆扩增 TCR 的扩增程度最低,只有一个 TCR 被检测到多次。这个TCR在总共六个与PBMC相关的T细胞中检测到:五个GZMK+ T细胞和一个TEMRA细胞。总体而言,这10个TCR在TIL中要么未出现,要么仅检测到一次。相比之下,在GBM106 TIL中,与GZMK+ T细胞状态相关的前10个扩增TCR的检测频率明显更高。例如,最高度扩增的TIL克隆在47个细胞中被检测到,其中17个和27个分别与NR4A2lo或NR4A2hi GZMK+ T细胞状态相关。值得注意的是,所有TCR大多与NR4A2lo/hi GZMK+ T细胞状态相关,或者与细胞毒性TRM状态共享。在TIL中,这些扩增的TCR在匹配的PBMC样本中要么未检测到,要么仅检测到一次。在G4A112_Re PBMC的情况下,与GZMK+ T细胞状态相关的前10个扩增TCR的检测频率高于GBM106 PBMC中的TCR。然而,这些扩增的TCR大多与TEMRA状态相关,正如前两个扩增最明显的TCR所示。这些TCR在TIL中被检测到,或仅由TEMRA状态独占表达,或与NR4Ahi/lo GZMK+ T细胞状态共享,这表明TEMRA和GZMK+ T细胞状态可能也共享发展轨迹。鉴于这些扩增TCR在PBMC和TIL中的存在,它们可能反映了非肿瘤特异性的旁观者T细胞的浸润。同时,与GZMK+ T细胞状态相关的G4A112_Re TIL中的前10个扩增TCR主要在TIL中高度扩增,而在匹配的PBMC样本中未检测到。类似地,这些TCR在NR4A2lo/hi GZMK+ T细胞状态中特异,尽管某些TCR(尤其是扩增最显著的)也被细胞毒性TRM共享。然而,在TIL中,未检测到TEMRA和GZMK+ T细胞之间特定TCR的共享表达。GZMK+ TCR在TIL中选择性扩增而非PBMC,代表了所有匹配样本的一般克隆型特征,因为成对的TIL和PBMC样本之间重叠较低(图5E)。考虑到相同TCR的T细胞源自相同的祖细胞,这些结果总体上支持了拟时序分析,表明细胞毒性TRM和NR4A2lo/hi GZMK+ T细胞位于肿瘤微环境中的同一发展轨迹上。
为了确定GZMK+ T细胞的扩增是否特异于脑肿瘤,作者调查了整合的肿瘤数据集中TCR扩增状态。在检查的20种肿瘤类型中,有13种包含V(D)J数据,可以量化扩增状态。值得注意的是,作者观察到,在整合的肿瘤数据集中,NR4A2lo和NR4A2hi GZMK+ T细胞(C3和C4)均为扩增,且超过60%的细胞处于扩增或超扩增状态(图5F)。
基于这些结果,可以得出结论,与匹配的血液样本相比,扩增的GZMK+ TCR在肿瘤环境中特异扩增;在肿瘤微环境中,它们主要由GZMK+ T细胞或细胞毒性TRM表达。此外,GZMK+ T细胞的扩增并非特异于脑肿瘤,而是在多种不同癌症类型中发生,涉及不同的解剖部位。
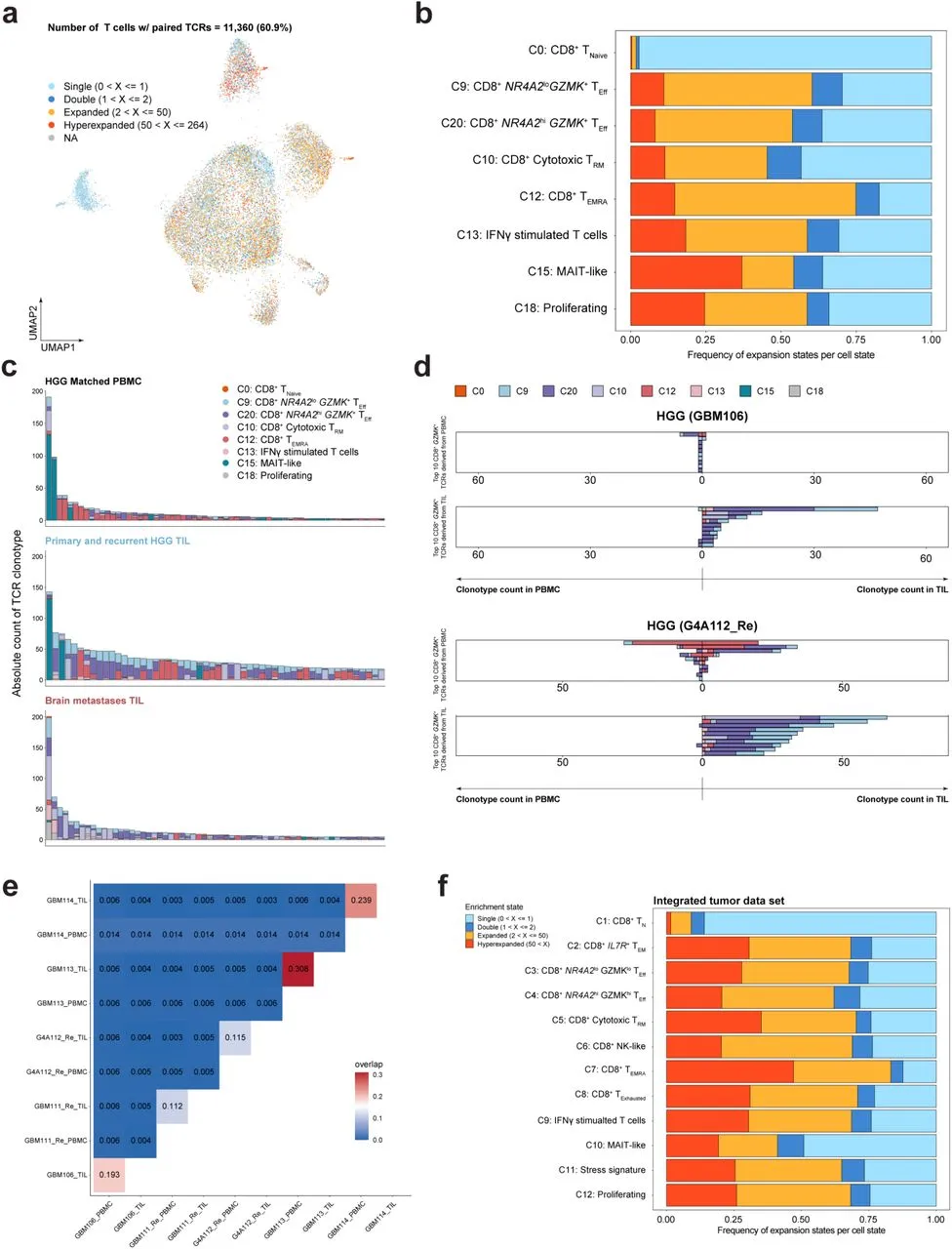 图5:扩增的 GZMK T 细胞富含 HGG TIL,并且对肿瘤部位具有特异性,与外周血不匹配。
图5:扩增的 GZMK T 细胞富含 HGG TIL,并且对肿瘤部位具有特异性,与外周血不匹配。
六:CD8+ GZMK+ TCR在体外扩增后不可检测
自体细胞转移的体外扩增肿瘤浸润淋巴细胞(TIL)已被证明在多种癌症类型中是一种有前景的免疫疗法。由于抗原特异性T细胞在肿瘤微环境中富集,分离的肿瘤标本成为这些免疫疗法理想的肿瘤特异性效应T细胞来源。然而,由于许多终末分化的T细胞状态失去自我更新能力,因此不清楚哪些效应T细胞状态确实是从这些体外技术扩增而来的。最近,来自胰腺导管腺癌(PDAC)患者样本的GZMK+ TIL相关的TCR在体外培养后保持类似频率,表明GZMK+ TIL保留了增殖潜力。因此,作者评估了这些来自HGG患者的克隆扩增的CD8+ NR4A2lo/hi GZMK+ TEff是否同样能够进行体外扩增,以便考虑潜在的治疗应用。为此,来自6名不同HGG患者样本的TIL在气体渗透快速扩增(G-Rex)培养系统中扩增,随后通过免疫SEQ平台进行大规模TCR CDR3β链测序(图6A)。在所有配对样本中,作者观察到体外培养后总体克隆扩增增加,表现为扩增的TCRβ链占据的谱系比例增大(图6B)。然而,在分析每种样本类型的TCR谱系时,作者发现培养的TIL TCR克隆型并未代表D0 TIL或D0 PBMC。结果通过来自患者样本GBM111_Re的D0 TIL、D25培养TIL和D0 PBMC样本的前20个TCRβ链的代表性桑基图展示。当特别分析D0 TIL的前20个TCRβ链时,观察到D25培养TIL中这些TCRβ链的富集程度极小,而在D0 PBMC中则有一定的富集。对D25培养TIL的前20个TCRβ链进行分析时则观察到相反的结果。这些结果通过Morisita重叠注释来汇总,该指数衡量不同数据集之间的重叠,类似的结果先前已有报告。专门分析与CD8+ GZMK+ T细胞相关的TCR扩增状态时,通过将大规模TCRβ链与单细胞TCR数据集中CD8+ GZMK+ T细胞的TCR链进行匹配。在两个代表性样本GBM111_Re和GBM113中,观察到这些匹配的TCRβ链在D0 TIL中存在,但在培养的TIL中未检测到或未扩增,除了一个在培养的GBM113 TIL中扩增的TCRβ链(图6C和6D)。总体而言,这些结果表明,使用常规扩增条件,初始 HGG 微环境中存在的克隆扩增 GZMK+ TIL 的离体扩增潜力有限。这种潜在的增殖能力丧失,由低 TCF7 表达支持,并且可能是HGG特异的,因为来自PDAC患者样本的扩增GZMK+ TIL已被证明在体外持续扩增。
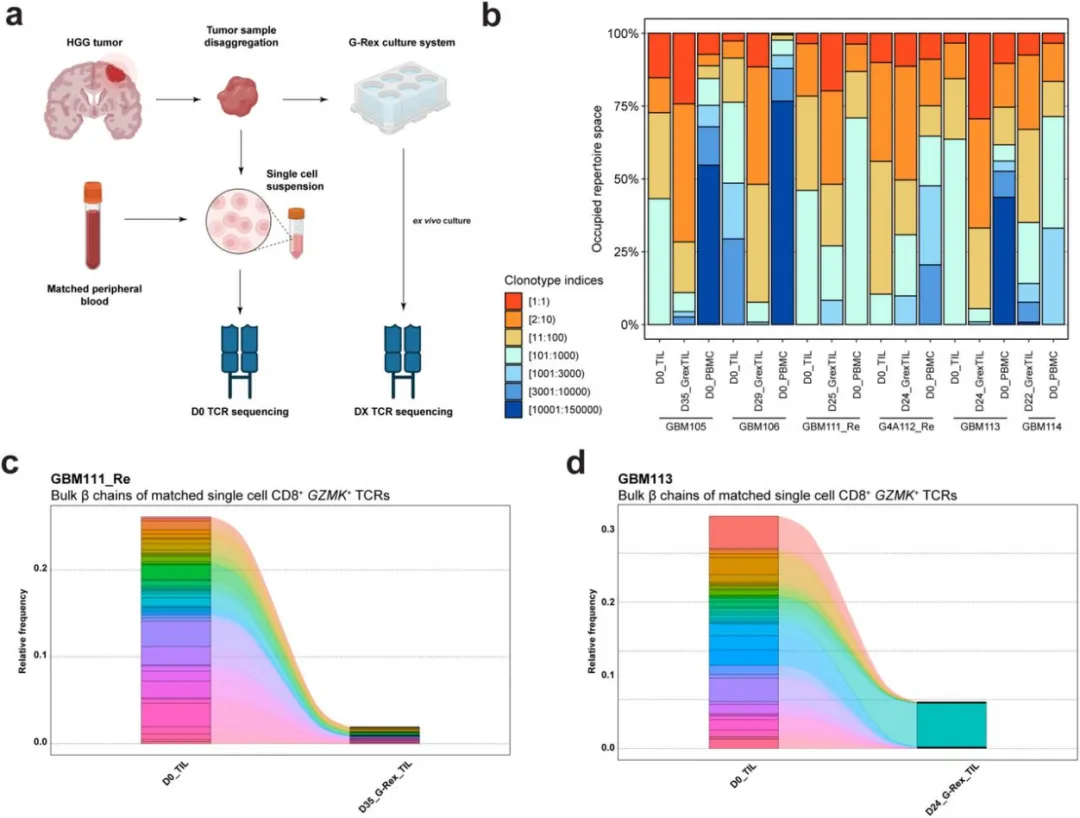 图6:TIL 离体扩增并不代表最初的 TCR 状态。
图6:TIL 离体扩增并不代表最初的 TCR 状态。
结语
结论:至此整篇文章介绍完毕,可以看到结合TCR部分的研究占据了后面两张主图的篇幅,通过TCR研究了特定细胞的扩增特征,并且比较了在不同组间不同细胞亚型克隆扩增的差异。既可以支持前面拟时序等分析的结果,又可以有新的发现,效果还是非常好的。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、蛋白芯片、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


