肺癌作为全球范围内致死率居高不下的恶性肿瘤,其导致的死亡人数在癌症相关死亡病例中占比接近五分之一。近年来,PD - 1/PD - L1 等免疫检查点抑制剂的问世,为肺癌治疗带来了颠覆性的变革,彻底革新了传统的肺癌治疗模式。然而,肿瘤微环境极为复杂且具有高度的异质性,这种特性对肿瘤免疫反应以及肿瘤细胞的免疫逃逸机制产生了显著影响。在此背景下,仅依靠单一免疫标志物来评估患者的预后情况,其价值相对有限。鉴于此,该文采用了多色免疫组化(mIHC)技术,对 98 例非小细胞肺癌(NSCLC)患者免疫微环境中的 PD - 1、PD - L1、CD8(作为抗肿瘤 T 细胞的标志物)以及 FOXP3(代表免疫抑制性 Treg 的标志物)的表达情况展开深入分析,旨在探究这些标志物在 NSCLC 患者预后评估以及分层治疗中的潜在价值。该研究成果已发表于学术期刊《Frontiers in Immunology》,该期刊的影响因子为 7.561。
一、研究结果
1. 借助多色免疫组化(mIHC)技术剖析NSCLC组织内肿瘤免疫微环境表型
为深入探究非小细胞肺癌(NSCLC)中原位驻留及浸润性免疫细胞的特性,研究人员精心构建并优化了多色免疫组化(mIHC)的工作流程。该流程旨在全面评估CD8⁺T细胞、FOXP3⁺Treg细胞、PD - 1⁺细胞以及PD - L1⁺细胞的相关情况。在实验中,以PanCK阳性作为判定肿瘤成分的依据。
运用inForm软件完成光谱拆分操作后,能够将图像分解为其原本的荧光团,并将对应的图像清晰呈现(见图1A)。随后,针对组织微阵列(TMA)样本开展6色mIHC染色实验,以此评估CD8⁺T细胞、FOXP3⁺Treg细胞、PD - 1⁺细胞和PD - L1⁺细胞在肿瘤组织以及癌旁组织中的分布密度(见图1B)。
之后,通过inForm软件对肿瘤区和间质区的表型进行评估,其中肿瘤区由PanCK阳性区域来界定(见图1C)。此外,研究人员还采用了一种模式识别算法,对瘤周和瘤内区域的免疫细胞数量进行量化分析,进而深入探究NSCLC患者瘤周和瘤内区域的肿瘤免疫微环境表型特征(见图1D)。

图1. 六色mIHC评估NSCLC的微环境
2. NSCLC中高密度肿瘤相关免疫细胞与免疫抑制表型的关联性
研究者依据样本的来源,把非小细胞肺癌(NSCLC)样本划分为肿瘤组织组和癌旁正常组织组。随后,运用六色多色免疫组化(mIHC)技术检测这两组样本中肿瘤相关免疫细胞以及免疫检查点的特征。
检测结果显示,CD8⁺、FOXP3⁺和PD - 1⁺细胞在肿瘤组织中的密度显著高于癌旁正常组织(p < 0.01);而CD8/FOXP3比值在癌旁正常组织中则明显高于肿瘤组织(p < 0.0001)。值得注意的是,PD - L1⁺细胞水平在肿瘤组织与癌旁正常组织之间并未呈现出显著差异(p = 0.067)。
由于PD - 1/PD - L1高水平表达通常与患者预后不良相关,研究者进一步根据PD - 1⁺细胞密度的中值以及PD - L1的表达水平,将NSCLC样本分别进行分组,并对比了各组间CD8⁺和FOXP3⁺细胞的密度或水平。研究发现,在PD - 1高表达组中,CD8⁺ T细胞(p < 0.0001)和FOXP3⁺ Treg细胞(p < 0.001)的密度均显著升高;在PD - L1高表达组中,CD8⁺ T细胞(p = 0.0192)和FOXP3⁺ Treg细胞(p = 0.0201)的水平也显著升高。
这一系列发现提示,CD8⁺和FOXP3⁺细胞的浸润与PD - 1/PD - L1的高表达存在关联。这表明在免疫抑制亚型的NSCLC中,可能会观察到高浸润的CD8⁺ T细胞,进而导致Treg细胞浸润增加,并且肿瘤可能以一种适应性方式诱导更高的PD - 1/PD - L1表达。
3. NSCLC 肿瘤周围与肿瘤内亚区样本呈现差异化的免疫亚群及检查点特征
研究人员借助热图分析和聚类分析方法,对肿瘤周围和肿瘤内亚区不同 NSCLC 样本之间的潜在相关性展开评估。依据 CD8⁺、FOXP3⁺、PD - 1⁺ 和 PD - L1⁺ 细胞的水平,能够清晰区分出瘤周组织和瘤内组织各自独特的免疫亚区。
通过对比同一患者瘤周和瘤内组织的免疫亚群和免疫检查点情况,研究人员发现,瘤周区域 CD8⁺、FOXP3⁺ 和 PD - 1⁺ T 细胞群体所占比例显著升高(P 值范围在 0.01 - 0.0001 之间)(见图 2D - F),而 PD - L1⁺ 细胞比例则未呈现出显著差异(见图 2G)。
瘤周组织中细胞毒性 T 细胞数量相对较多,这一现象可能暗示着肿瘤边缘存在某种特定的免疫反应。基于此,促使研究人员进一步深入探究肿瘤周围亚区的免疫特性。
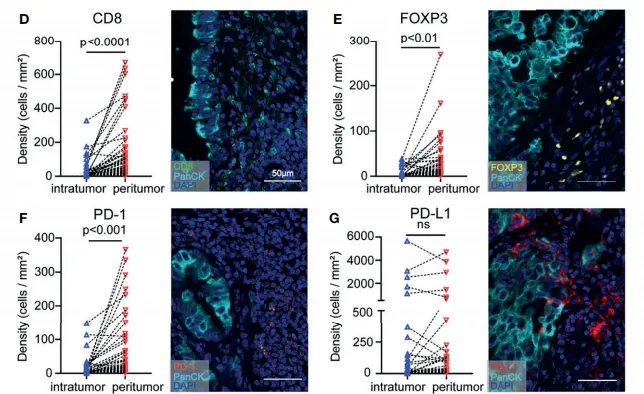
图2. 免疫细胞亚群在癌旁和癌内的差异
4. 聚类分析证实联合考量NSCLC免疫亚群与检查点具备良好预后价值
研究人员运用无监督分层聚类分析对相关标记物进行处理,以此评估瘤周亚区中 CD8⁺、FOXP3⁺、PD - 1⁺ 和 PD - L1⁺ 细胞密度对非小细胞肺癌(NSCLC)患者预后的不同影响。
针对整个患者队列开展的 Kaplan - Meier 分析结果表明,单独考量 CD8⁺ T 细胞、FOXP3⁺ Treg 细胞、PD - 1⁺ 细胞和 PD - L1⁺ 细胞密度时,这些指标对患者生存情况并未展现出显著的预后价值(见图 3A - D)。
随后,基于免疫细胞密度进行无监督聚类分析,研究人员成功鉴定出 3 个生存期存在显著差异的簇。具体而言,簇 1 的特点是 CD8/FOXP3 比值处于中等水平,同时 PD - 1 和 PD - L1 呈现高表达;簇 2 的特征为 CD8/FOXP3 比值较低,且 PD - 1 和 PD - L1 表达也较低;簇 3 则表现为 CD8/FOXP3 比值较高,而 PD - 1 和 PD - L1 表达较低。进一步分析发现,簇 3 的总生存期(OS)显著优于簇 1 和簇 2(P = 0.0486)(见图 3E、F)。
基于上述聚类分析结果,对患者进行分层处理,能够为抗 PD - 1/PD - L1 治疗提供有价值的指导(例如簇 1 患者可能更适合该治疗策略),而簇 2 患者或许能从针对 Treg 细胞的干预策略中获益。
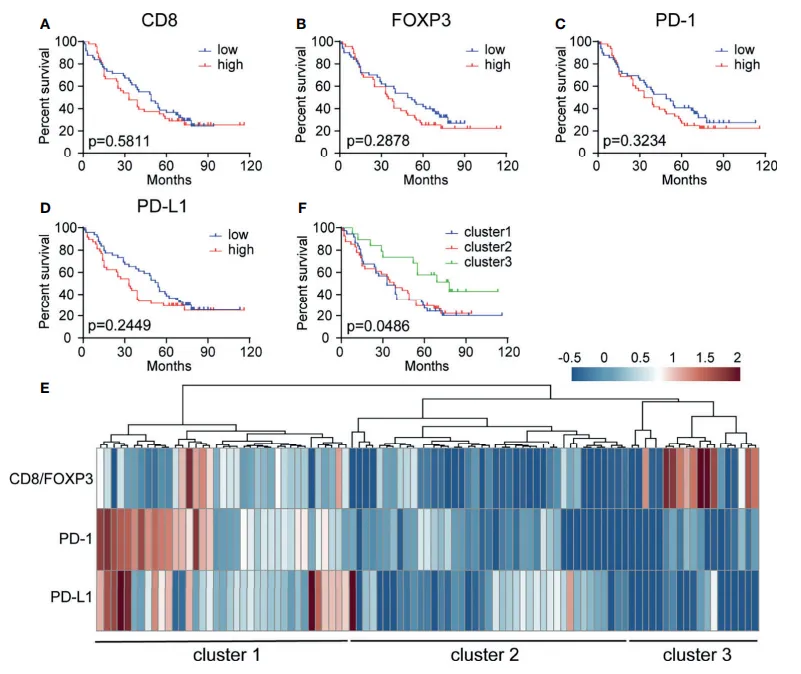
图3. 根据CD8、FOXP3、PD-1、PD-L1细胞密度对患者进行预后分层
5. 高 CD8/FOXP3 比值与高 PD - L1 表达和亚组患者更优生存预后相关联
研究人员进一步深入评估了 3 个亚组患者瘤周区域 CD8⁺、FOXP3⁺、PD - 1⁺ 和 PD - L1⁺ 细胞密度水平,以及 CD8/FOXP3、CD8/PD - 1 和 CD8/PD - L1 细胞比值(见图 4A - E)的预后意义。
通常情况下,高水平的肿瘤浸润性 CD8⁺ T 细胞被视为多种癌症类型(涵盖 NSCLC)的良好生存预后因素。然而,在本研究中,肿瘤浸润性 CD8⁺ T 淋巴细胞与患者生存情况在所有患者或任何亚组中均未呈现出显著相关性(见图 3A)。
值得注意的是,CD8/FOXP3 比值较高时,能够提升簇 3 中患者的生存率,但在其他亚组中却未观察到这一现象(见图 4B)。而 CD8/PD - 1 比值和 CD8/PD - L1 比值在任何一个亚组患者中均未体现出预后价值。这些结果提示,在亚组患者中,CD8 水平相对于 FOXP3 水平具有一定的预后意义。
此外,FOXP3 高表达的簇 2(表现为低 CD8/FOXP3 比值)患者,其生存率相对较低(见图 3C)。这一现象或许暗示,针对 FOXP3⁺ Treg 细胞进行干预,有可能改善该簇患者中 CD8⁺ 细胞的功能,进而对该簇患者的预后产生积极影响。PD - 1 的表达在 3 个亚组中均未显示出预后价值(见图 4D)。而单独的 PD - L1 水平在簇 3 中体现出了预后价值,在簇 1 中却无此表现,并且高 PD - L1 表达与更好的生存结果相关联(见图 3E)。
这些研究结果可能表明,当 CD8/FOXP3 比例较高,同时 PD - L1 表达处于适度水平时,能够平衡肿瘤反应性和免疫抑制微环境所带来的影响,进而使患者获得更优的生存结局。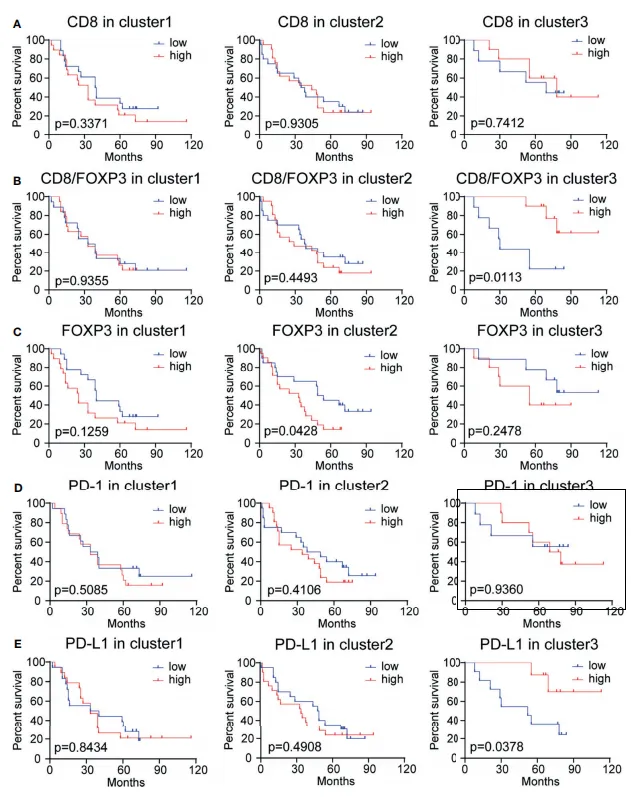
图4. 根据CD8、CD8/FOXP3、FOXP3、PD-1、PD-L1表达水平分层的亚组患者总生存率
6. EGFR 状态与 PD-1/PD-L1 调控的免疫抑制关联
研究发现,EGFR 突变的 NSCLC 组织中 PD-L1 常呈过表达,且肿瘤 PD-L1 表达水平与肺腺癌患者的 EGFR 突变状态及不良预后呈正相关。为进一步探究 PD-1/PD-L1 表达是否与 EGFR 或 ALK 突变状态协同调控免疫抑制,研究者分析发现:簇 1(18.92%)和簇 2(14.63%)中具有免疫抑制特征的患者 EGFR 突变率显著高于簇 3(0%)(图 5A),而 ALK 突变率在簇 1(16.22%)、簇 2(17.07%)和簇 3(10.53%)间无显著差异(图 4B)。数据表明,EGFR 突变状态与两类免疫表型相关:一类为高肿瘤浸润淋巴细胞(TIL)密度伴高 PD-1/PD-L1 表达(簇 1),另一类为低 TIL 密度伴低 PD-1/PD-L1 表达(簇 2),这与既往 “EGFR 突变 NSCLC 患者 PD-L1 高表达” 的报道既存在一致性,也揭示了突变状态与免疫微环境关联的复杂性。进一步分析基因突变与野生型亚组的免疫细胞预后价值发现,仅野生型患者中 CD8+T 细胞与 FOXP3+Treg 细胞的比例(CD8/FOXP3 比值)具有独立预后意义,提示该比值在 EGFR 野生型人群中可能是关键的预后预测因子。
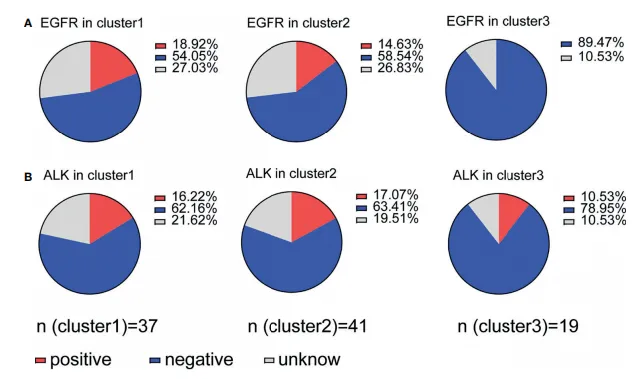
图5. 免疫抑制状态与EGFR或ALK突变的关系
7. 基于多因素Cox回归构建判断预后的免疫风险评分模型
研究人员成功构建了一个能够提供线性风险测量的免疫评分模型,其具体公式为:风险评分 = 0.391 × CD8⁺ + (-0.374) × FOXP3⁺ + (-0.396) × PD - 1⁺ + 0.272 × PD - L1⁺ + (-0.269) × CD8/FOXP3 + (-0.473) × CD8/PD - 1 + 0.181 × CD8/PD - L1。
为验证该风险评分模型的可靠性,研究人员尝试使用TCGA队列来检验基于组织微阵列(TMA)结果构建的模型。验证结果显示,所得结果与TMA数据结果具有相似性,高危评分与患者较差的生存预后存在相关性(P = 0.0558)。该评分模型选取肿瘤周围亚区内的部分成分作为免疫变量,基于这些成分之间复杂的相互作用来反映非小细胞肺癌(NSCLC)患者的预后情况。
此外,研究人员还开展了时间依赖性受试者工作特征曲线(ROC)分析,以此评估风险评分在判断NSCLC患者预后方面的敏感性和特异性。ROC曲线分析结果表明,1年、3年和5年总生存期(OS)的曲线下面积(AUC)值分别为0.784、0.698和0.722。
不仅如此,研究人员进一步深入分析了临床病理特征(包括年龄、肿瘤分期、淋巴结分期、AJCC分期)与风险评分之间的关系。分析结果显示,高淋巴结分期(P = 0.03)和高AJCC分期(P = 0.02)患者的风险评分显著高于低淋巴结分期和低AJCC分期患者,这充分表明该风险评分模型具有重要的预后价值。
二、总结
本研究聚焦NSCLC预后评估,挖掘关键预测标志物并构建风险评分模型。本研究以评估非小细胞肺癌(NSCLC)预后为核心目标,运用多色免疫组化(mIHC)技术,对NSCLC组织中肿瘤相关免疫细胞以及免疫检查点的特征展开检测。通过进一步的聚类分析,研究有了重要发现:CD8/FOXP3比值较高、免疫检查点PD - 1和PD - L1表达较低,且不存在EGFR基因突变,这些特征组合可作为NSCLC预后良好的预测标志物。研究人员依据CD8/FOXP3比例以及PD - 1和PD - L1免疫检查点的表达情况进行聚类,并依据不同的预后标志物对患者进行分层。这种分层方式能够为肿瘤免疫治疗提供指导,例如针对不同分层的患者,可选择抗PD - 1/PD - L1治疗或靶向Treg细胞治疗等个性化方案。除此之外,研究团队在此基础上成功构建了一个具有重要价值的风险评分模型,该模型可用于判断NSCLC患者的预后情况。展望未来,后续研究将把重点放在高度异质性的肿瘤微环境,以及CD8、FOXP3、PD - 1、PD - L1等免疫检查点表达的空间分布上。通过深入研究这些方面,有望更精准地对患者进行分层,从而为NSCLC患者的临床免疫治疗提供更为科学、有效的指导。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、蛋白芯片、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


