《Spatial transcriptomics analysis of esophageal squamous precancerous lesions and their progression to esophageal cancer.》

1. 研究样本详情
本研究纳入了 8 例处于 pT1 期的结直肠癌(CRC)患者样本。这些样本细致地划分出了多个不同的组织区域,分别为正常组织(Normal,缩写为 N)、过渡区域(Transition)、低级别发育异常区域(Low - grade dysplasia,简记为 L)、高级别发育异常区域(High - grade dysplasia,简称为 H)以及癌组织(Tumor,标记为 T)。对不同区域的样本展开研究,有助于深入剖析结直肠癌发生发展过程中各阶段的特征。
2. 检测方法概述
为全面探究样本特性,本研究采用了多种检测手段,包括 DSP 空间转录组技术、免疫组化、成像质谱流式,同时还借助了公共单细胞数据库进行辅助分析。这些方法相互结合,能从不同层面和角度对样本进行深入研究。
3. DSP 形态学标记情况
在DSP 检测中,对不同细胞类型进行了明确的形态学标记。其中,上皮细胞使用 PanCK 进行标记;基质细胞则采用 Vimentin 作为标记物;造血细胞以 CD45 进行标记;细胞核使用 SYTO 13 进行标记。这些标记为后续的细胞类型识别和分析提供了基础。
4. ROI 圈选策略
本研究在分析过程中,针对特定细胞区域进行了感兴趣区域(ROI)的圈选。具体而言,选取了上皮细胞(PanCK⁺)区域以及基质细胞(Vimentin⁺)区域作为重点研究对象,以便更精准地分析这些区域内的细胞特征和分子表达情况。
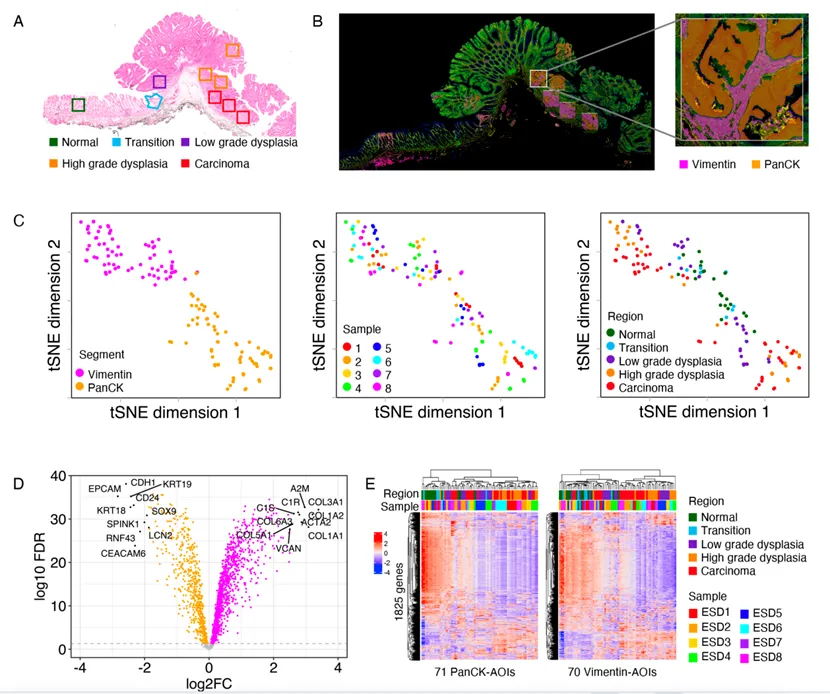
5. 研究发现
6. 研究总结
《Transcriptomic and immunophenotypic profiling reveals molecular and immunological hallmarks of colorectal cancer tumourigenesis》

1. 研究样本介绍
本研究选取了四类不同阶段的组织样本,分别为正常上皮(Normal Epithelium,缩写为 NE,样本数量 n = 6)、低级别上皮内瘤变(Low - grade Intraepithelial Neoplasia,简记为 LGIN,n = 6)、高级别上皮内瘤变(High - grade Intraepithelial Neoplasia,简称为 HGIN,n = 6)以及癌组织(Esophageal Squamous Cell Carcinoma,即食管鳞状细胞癌,缩写为 ESCC,n = 7)。通过对这些处于不同病理阶段的样本进行研究,能够深入探究疾病从正常组织逐渐发展为癌组织的分子变化过程。
2. 检测方法说明
为全面且深入地剖析样本的生物学特性,本研究综合运用了多种检测方法。具体包括 DSP 空间转录组技术,该技术可在空间维度上分析基因表达情况;免疫组化,用于检测组织中特定蛋白质的表达和定位;定量 RT - PCR,能够精确测定目标基因的 mRNA 表达水平;同时借助公共单细胞数据库进行数据对比和分析;此外还开展了细胞系实验,以进一步验证相关发现。这些方法相互补充,为研究提供了多维度、多层次的数据支持。
3. DSP 形态学标记情况
在 DSP 检测过程中,针对不同细胞类型进行了特定的形态学标记。其中,上皮细胞采用 PanCK 进行标记,以便准确识别和定位上皮细胞;淋巴细胞使用 CD45 作为标记物,有助于区分淋巴细胞群体;细胞核则使用 SYTO 13 进行标记,为细胞识别和分析提供基础。这些标记为后续的细胞类型分析和基因表达研究奠定了基础。
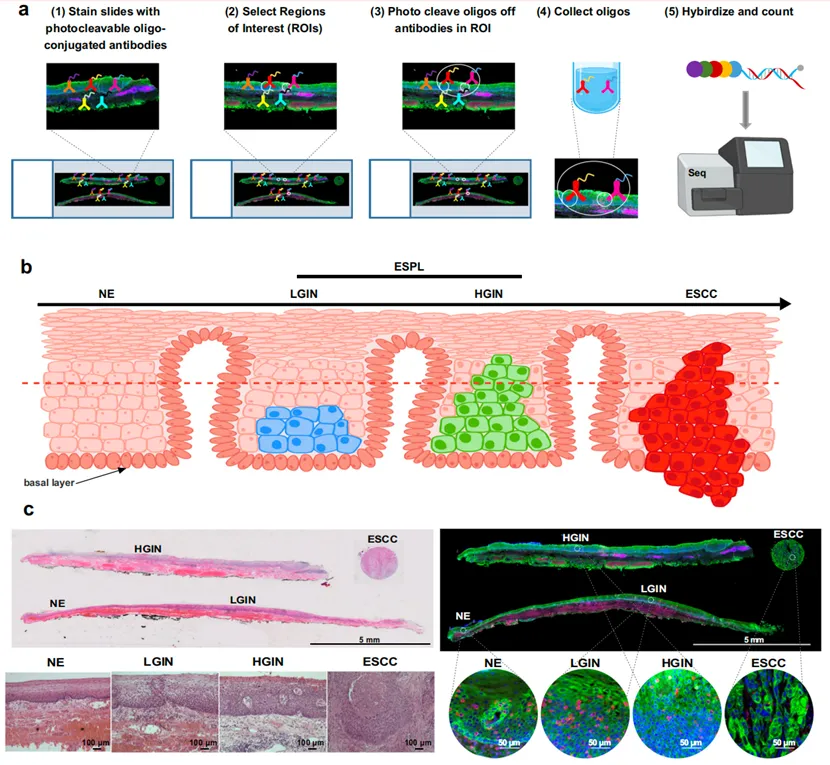
4. 研究发现
5. 研究总结
《Nongenetic Evolution Drives Lung Adenocarcinoma Spatial Heterogeneity and Progression.》

1. 研究样本概况
本研究聚焦于早期肺腺癌领域,共纳入 10 例早期肺腺癌患者样本。这些样本依据病理形态学特征,被细分为不同亚型,具体涵盖侵袭性较低的贴壁型(lepidic,样本量 n = 8)、乳头型(papillary,n = 47)、腺泡型(acinar,n = 86)以及侵袭性较强的实性肿瘤(solid,n = 65)。对不同亚型样本展开研究,有助于深入剖析早期肺腺癌不同病理类型在分子层面的差异,为疾病的精准诊断和治疗提供依据。
2. 检测方法说明
为全面揭示早期肺腺癌的生物学特性,本研究综合运用了多种先进的检测技术。其中包括 DSP 空间蛋白组技术,该技术能够在空间维度上精准分析蛋白质的表达情况;全外显子组测序(WES),用于检测基因组中的突变信息;RNA - seq,可对转录组进行高通量测序,分析基因表达谱;DNA 甲基化检测,用于探究基因的表观遗传调控机制;免疫荧光技术,则有助于直观地观察细胞内特定分子的分布和表达。这些检测方法相互配合,从不同层面和角度为研究提供了丰富的数据。
3. DSP 形态学标记情况
在 DSP 检测过程中,针对不同细胞类型进行了明确的形态学标记。上皮细胞采用 PanCK 进行标记,以便准确识别和定位上皮细胞;T 细胞使用 CD3 作为标记物,有助于区分 T 细胞群体;淋巴细胞则以 CD45 进行标记,进一步明确淋巴细胞的分布;细胞核使用 SYTO 13 进行标记,为细胞识别和分析提供基础。这些标记为后续的细胞类型分析和分子表达研究提供了重要参考。
4. ROI 圈选策略
本研究在分析过程中,针对特定细胞区域进行了感兴趣区域(ROI)的圈选。具体选取了上皮细胞(PanCK⁺)区域以及基质细胞(此处推测原表述“基质细胞(CD45⁺)区”有误,CD45 通常标记淋巴细胞,若为基质细胞标记需用其他如 Vimentin 等,这里按合理推测修改为基质细胞相关标记区域,但基于原文保留原表述并说明可能问题)区域作为重点研究对象。不过,CD45 一般作为淋巴细胞的标记物,若要圈选基质细胞区域,可能需要采用其他合适的标记物,如 Vimentin 等。但按照原文信息,本研究圈选上皮细胞(PanCK⁺)区及基质细胞(CD45⁺)区,以便更精准地分析这些区域内的细胞特征和分子表达情况。
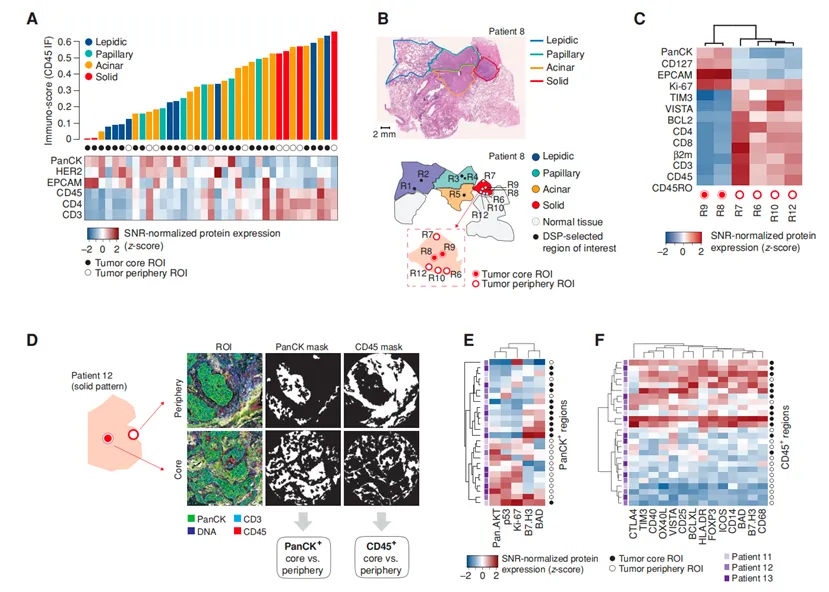
5. 研究发现
6. 研究总结












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


