乳腺癌,作为全球范围内发病率位居第二的恶性肿瘤,给无数患者带来了沉重的健康负担。临床数据显示,约有 20% - 30%的乳腺癌患者在初次确诊时,癌细胞便已发生转移。更为严峻的是,超过 90%的乳腺癌死亡病例都与病灶转移密切相关。在乳腺癌的疾病进程中,原发性乳腺癌以及其转移灶的肿瘤微环境(TME)呈现出显著的异质性。这种异质性意味着不同部位的肿瘤细胞及其周围环境存在诸多差异。而通过单细胞转录组技术来评估原发灶与转移灶内部的瘤内异质性,或许能够为乳腺癌的精准治疗开辟全新的思路,为患者带来更多的生存希望。
在乳腺癌转移的众多路径中,肺部常常成为癌细胞的重要“落脚点”,是乳腺癌转移的关键靶器官。然而,在科研领域,对乳腺癌肺转移灶肿瘤微环境的研究却面临着诸多挑战。传统的单细胞转录组(scRNA - seq)技术存在明显局限,它只能对新鲜样本进行分析。但在临床实际中,要同时获取来自乳腺癌原发灶和肺转移灶的新鲜肿瘤样本,难度极大,这就导致乳腺癌肺转移灶的肿瘤微环境至今仍未得到充分的研究。事实上,在临床工作中,福尔马林固定石蜡包埋(FFPE)样本是一种极为宝贵的研究资源。这些样本经过了特殊的处理,能够长期保存,为后续的研究提供了可能。但遗憾的是,传统单细胞转录组技术的局限性,使得这些丰富的 FFPE 临床样本资源难以得到有效利用,这也成为了乳腺癌肿瘤微环境研究道路上的一个重要障碍。
不过,近日传来了一则令人振奋的消息。浙江大学医学院附属第一医院的科研团队在知名学术期刊上发表了一篇题为《Spatial multi - omics profiling of breast cancer oligo - recurrent lung metastasis》的学术论文。在这项研究中,科研团队突破了传统技术的限制,创新性地利用 FFPE 样本单细胞转录组测序技术,对乳腺癌及其肺转移灶的 FFPE 样本进行了细致的检测。同时,他们还结合了成像质谱流式细胞术(IMC)等多种先进技术,对乳腺癌原发灶和与之配对的肺转移灶的肿瘤微环境展开了深入且全面的分析。通过这一系列研究,科研团队成功揭示了肺转移灶特有的细胞组成、独特的空间拓扑结构以及潜在的生物学机制,并基于这些发现提出了新的治疗靶点,为乳腺癌肺转移的治疗带来了新的曙光。

一、实验设计
研究团队纳入 9 例乳腺癌患者的原发灶及配对肺转移灶 FFPE 样本,运用 IMC 技术对 250,600 个带空间坐标的细胞进行高分辨率成像与标记分析,首次揭示肺转移灶与原发灶在细胞组成及空间分布上的显著差异。结合空间蛋白组学技术,系统分析肿瘤微环境中蛋白质表达的空间异质性,发现转移灶特有的免疫抑制蛋白网络特征。为验证多组学数据的一致性,研究通过 FFPE 样本单细胞转录组测序,从转录水平佐证了 IMC 与空间蛋白组学的关键发现,成功构建转移灶微环境的细胞分化轨迹。进一步利用多重免疫荧光技术,在组织原位精准定位肿瘤相关巨噬细胞、T 细胞等关键细胞亚群的空间互作模式,证实转移灶中免疫细胞浸润的区域性分布规律。整合多维度技术数据后,研究明确乳腺癌肺转移灶微环境的三大特征:免疫细胞谱系重构、成纤维细胞活化异质性及细胞外基质重塑,首次建立基于空间蛋白组特征的转移灶侵袭性预测模型,为转移性乳腺癌的精准诊疗提供空间组学理论支撑。

二、研究结果
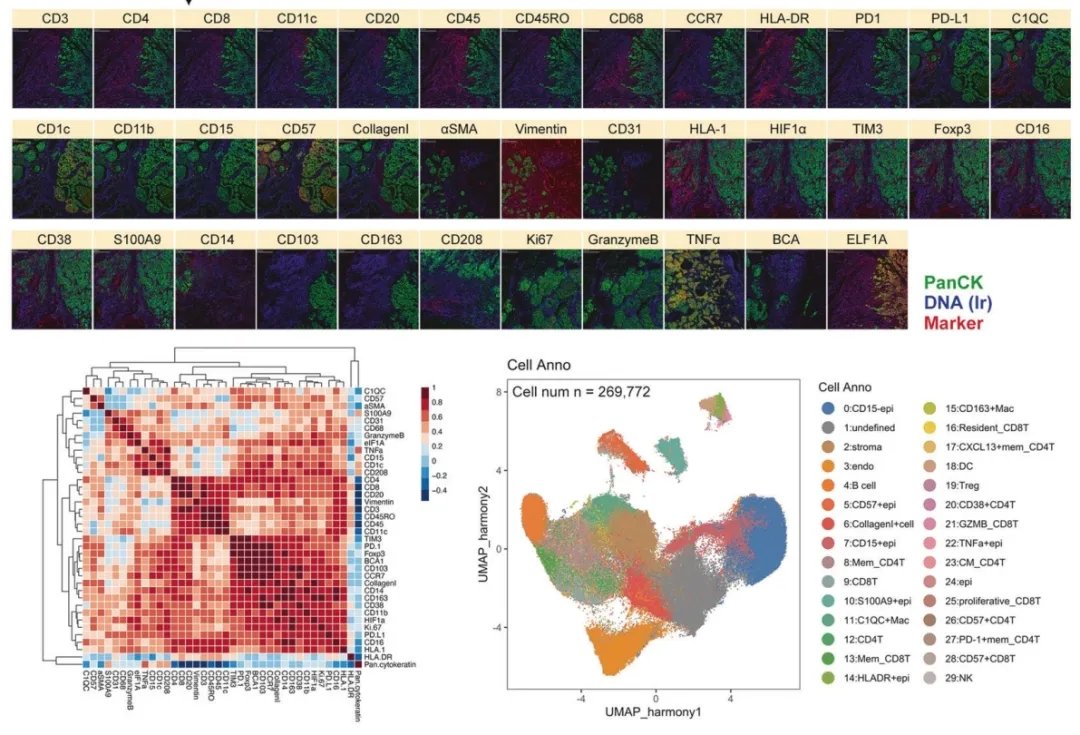
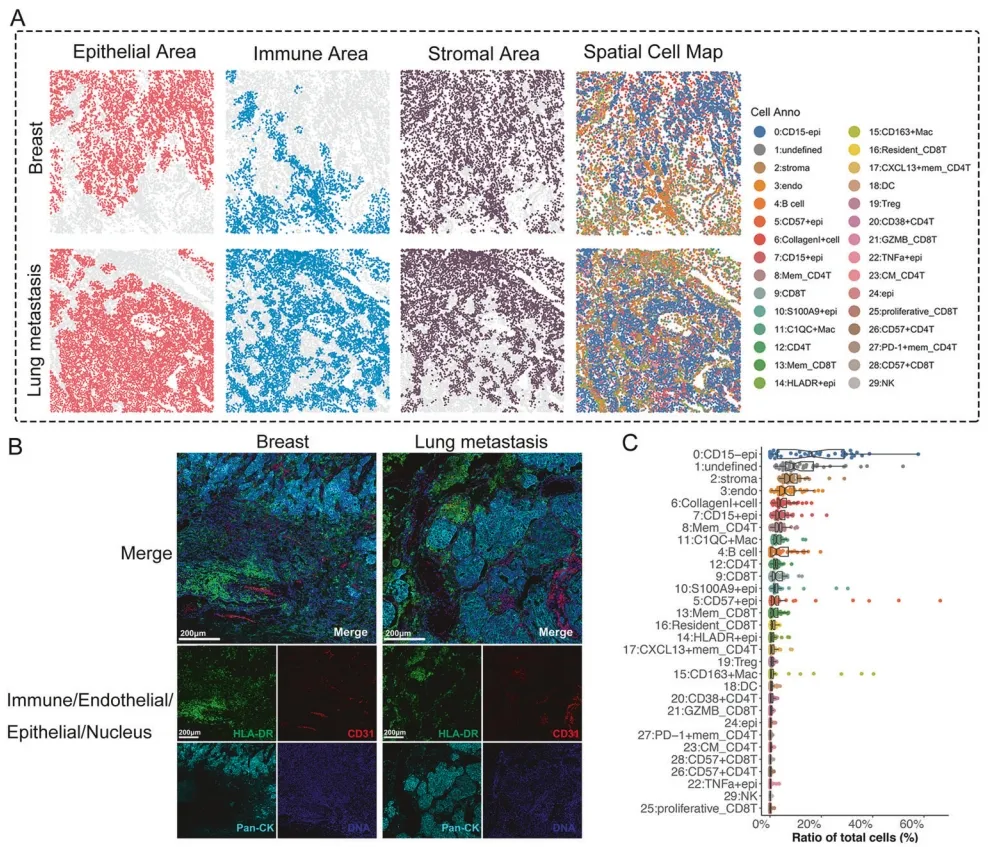
该研究借助 IMC(成像质谱流式)技术构建高维组织病理图谱,首次系统揭示乳腺癌原发灶与肺转移灶肿瘤微环境的空间拓扑差异。通过对 250,600 个带空间坐标的细胞进行聚类注释(图 1),发现转移灶中免疫细胞浸润呈现特征性 "周边富集 - 核心耗竭" 的空间分布模式,而原发灶微环境中肿瘤相关成纤维细胞的空间排列更为有序。空间拓扑分析显示,肺转移灶的细胞互作网络复杂性显著高于原发灶,尤其是巨噬细胞与肿瘤细胞的近距离接触频率增加 2.3 倍(P<0.01),提示转移微环境中细胞通讯的空间重构可能驱动侵袭表型。结合空间蛋白组学数据,进一步证实转移灶核心区富集免疫检查点分子 PD-L1 的空间表达热点,与其免疫抑制微环境的拓扑特征高度吻合。
图1:乳腺癌及肺转移灶微环境空间差异、细胞注释。
研究基于 IMC 技术解析空间细胞类型,构建乳腺癌原发灶与肺转移灶肿瘤微环境空间细胞图谱。图谱显示,两类病灶的免疫、内皮及上皮区域存在显著差异(图 2A-B);经细胞占比统计分析发现,CD15 - 上皮细胞、基质细胞和内皮细胞主导肿瘤微环境整体空间细胞构成(图 2C)。
图2.乳腺癌及肺转移灶的空间细胞图谱
研究者运用细胞邻域(CN)与细胞间互作 / 回避分析,成功解析乳腺癌及肺转移灶的器官特异性免疫空间拓扑结构,精准注释出 15 种细胞邻域类型(图 3A-C) ,其组成特征为肿瘤免疫微环境结构提供直观解读(图 3D-F)。进一步通过区域相关性分析,明确肺转移灶中特有的空间细胞互作组合与回避模式(图 3G-H)。
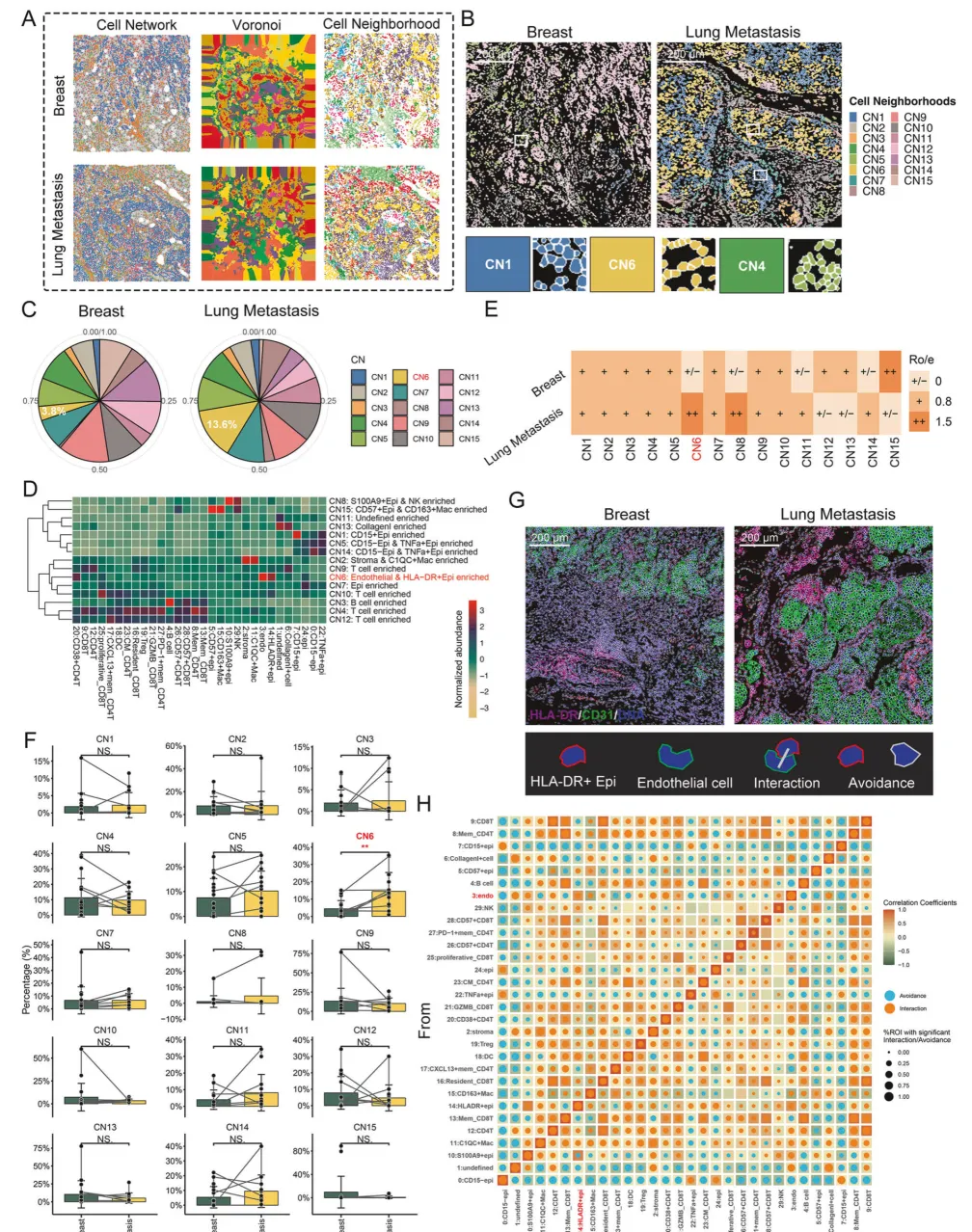 图3.器官特异性免疫空间拓扑结构
图3.器官特异性免疫空间拓扑结构
2.乳腺癌肺转移的潜在分子机制解析
为深度挖掘乳腺癌肺转移的分子调控机制,研究团队运用多重免疫荧光(mIF)技术,聚焦关键 T 细胞调控因子在原发灶与肺转移灶中的表达特征。通过量化 HLA-DR + 上皮细胞、耗竭 T 细胞与内皮细胞的空间距离,证实肺转移灶中这些细胞形成更致密的互作网络(图 4A-D),提示细胞空间微环境重塑或为驱动转移进程的关键因素。
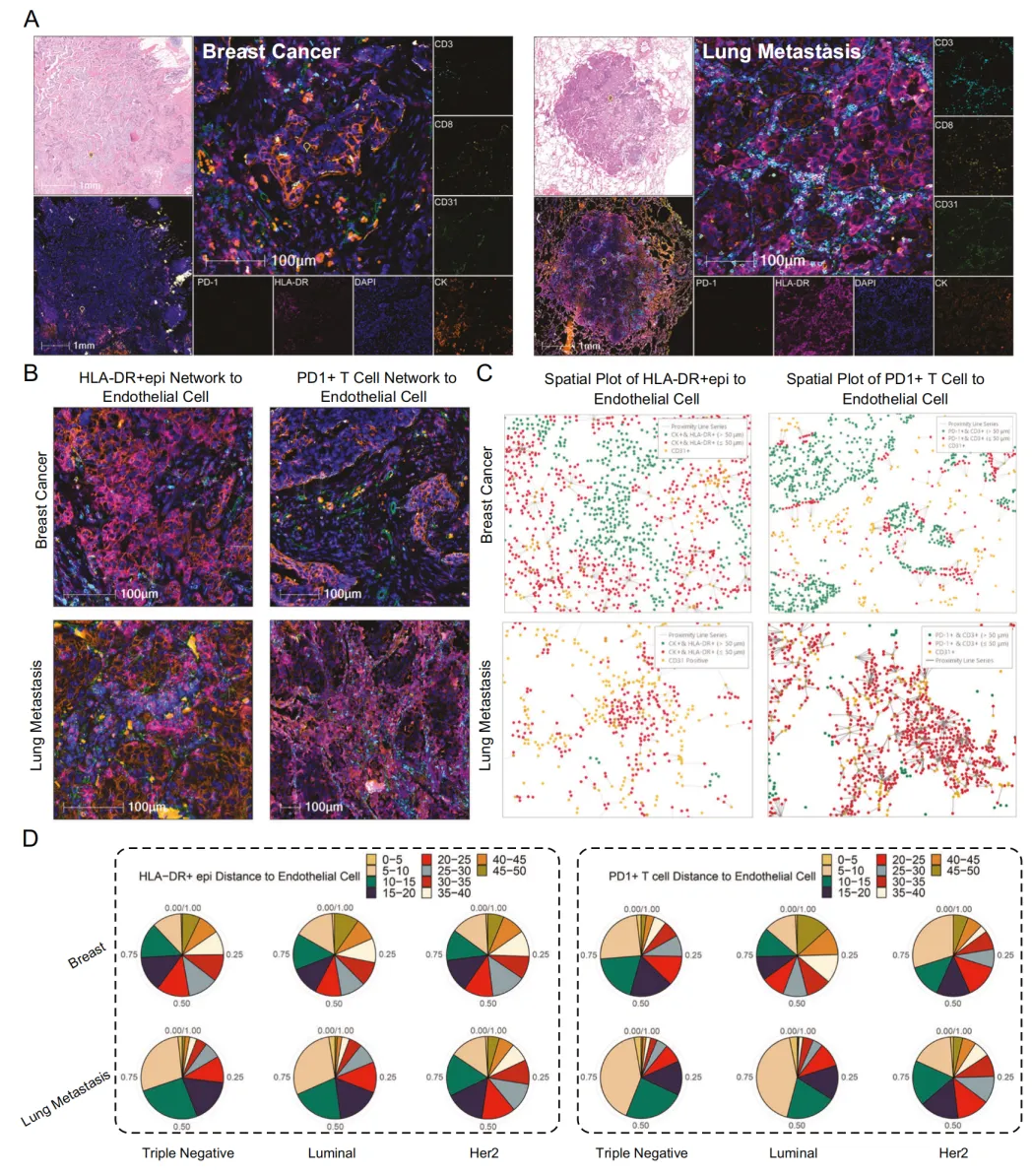 图4. 乳腺癌及肺转移灶中耗竭T细胞表型差异
图4. 乳腺癌及肺转移灶中耗竭T细胞表型差异
研究团队创新性开发质谱蛋白质组与组织膨胀空间蛋白组学(FAXP)联用技术(图 5A),并整合 IMC 技术对 36 个感兴趣区域(ROI)进行分析。通过筛选乳腺癌原发灶与肺转移灶的差异表达蛋白(DEPs)并开展 GO 分析发现,肺转移灶中细胞黏附与趋化性相关蛋白显著富集(图 5B-D),揭示其与原发灶在蛋白表达层面的关键差异。
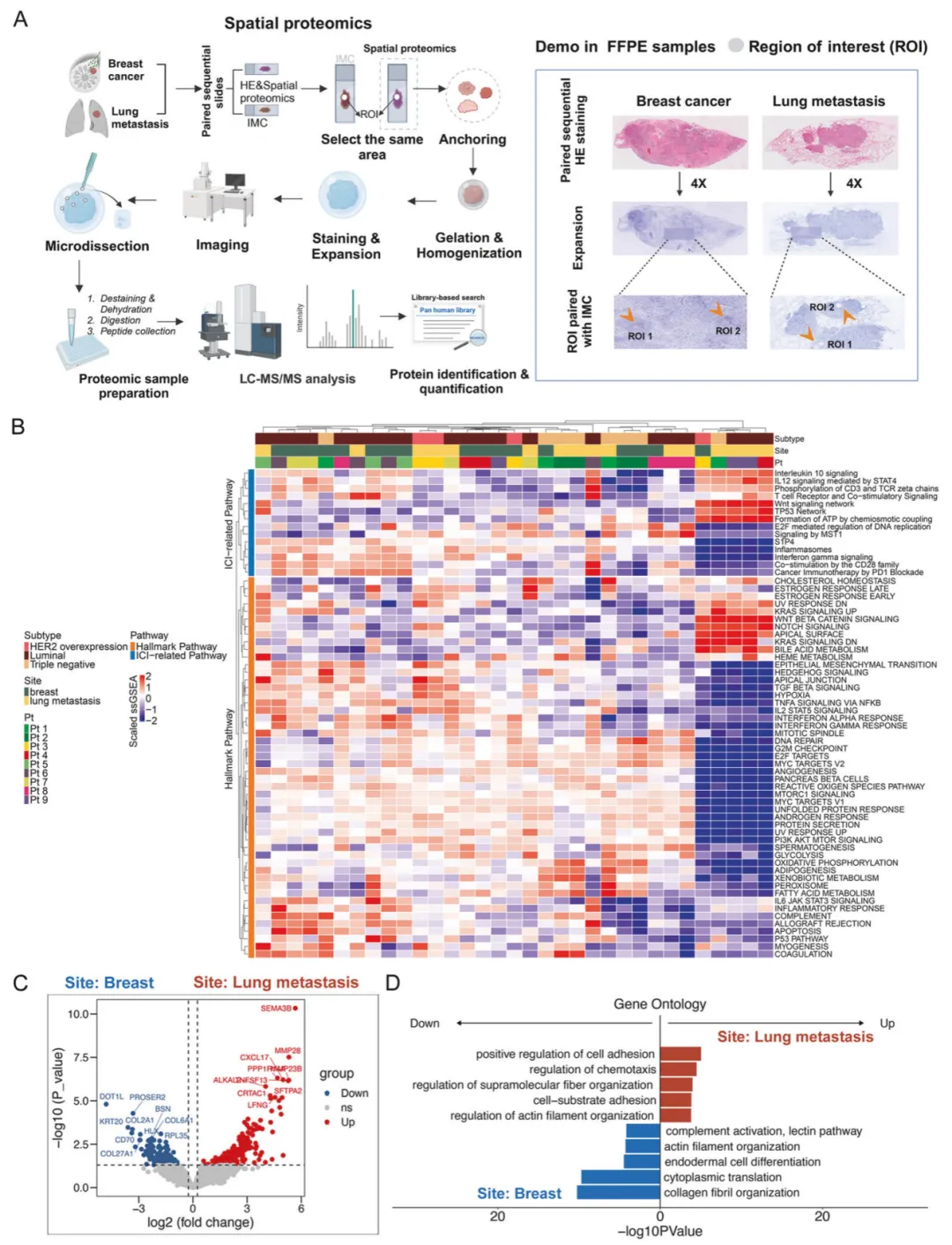 图5. 空间蛋白质组学揭示乳腺癌肺转移分子机制
图5. 空间蛋白质组学揭示乳腺癌肺转移分子机制
研究团队联合 IMC 技术与加权基因共表达网络分析(WGCNA),在各感兴趣区域(ROI)中量化肿瘤微环境细胞频率并开展相关性分析(图 6A-C)。分析显示,内皮细胞频率与黄色模块呈负相关,而 CD57 + 上皮细胞频率与该模块呈正相关(图 6D-K)。上述多维度研究结果共同阐释了乳腺癌肺转移的潜在分子调控机制。
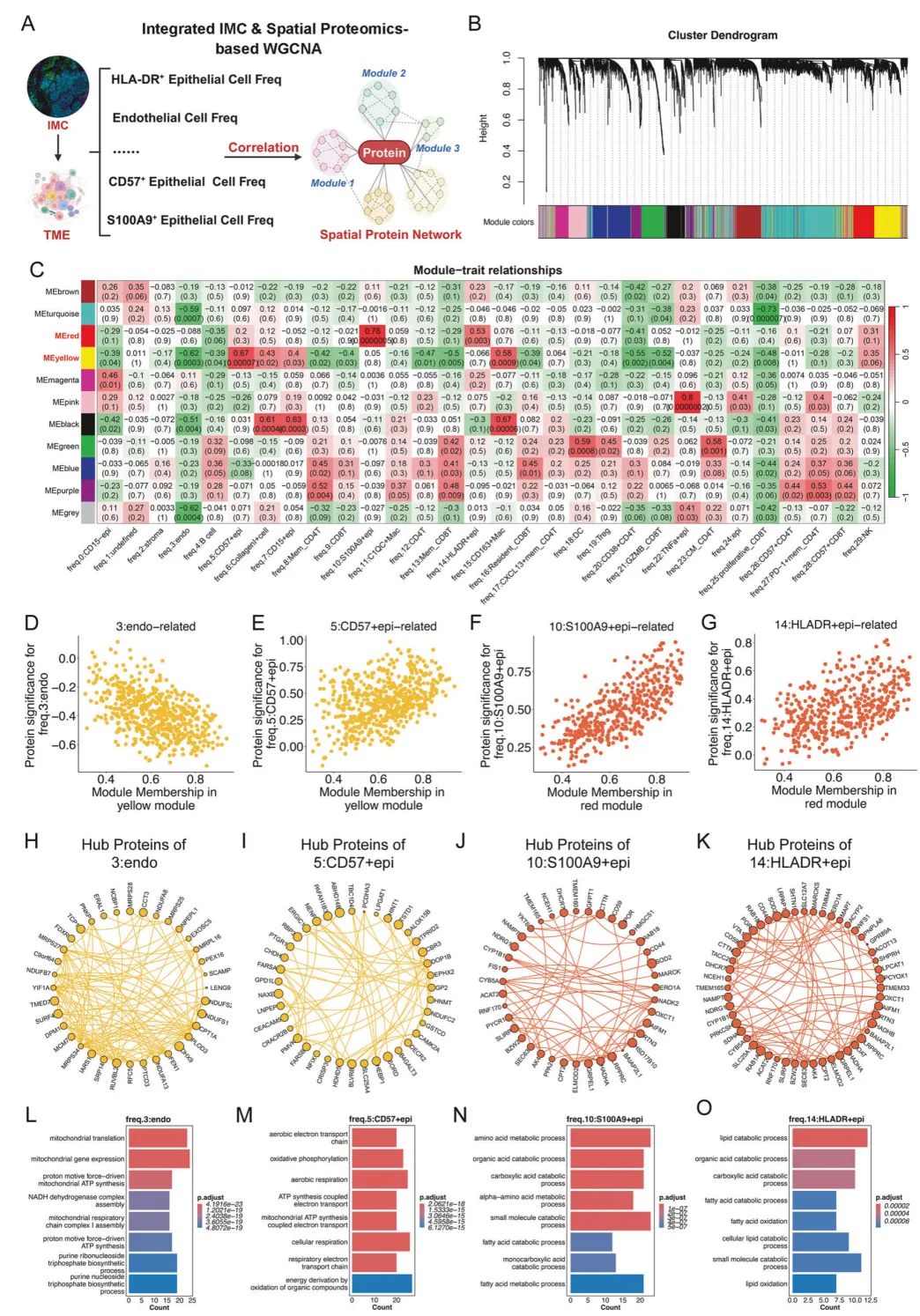 图6.乳腺癌及肺转移灶的肿瘤微环境分子特征
图6.乳腺癌及肺转移灶的肿瘤微环境分子特征
3.单细胞测序解码乳腺癌肺转移微环境特征
研究对 3 对乳腺癌原发灶及配对肺转移灶开展单细胞转录组测序,对 100,235 个细胞进行无监督聚类后划分为 8 个细胞群,通过经典标志物完成细胞注释(图 7A-C)。进一步分析细胞群在不同病灶及患者间的比例分布,揭示原发灶与肺转移灶的微环境特征差异(图 7D)。结果显示,肺转移组织中内皮细胞显著富集,与 IMC 和 mIF 技术的前期发现高度吻合(图 7E)。
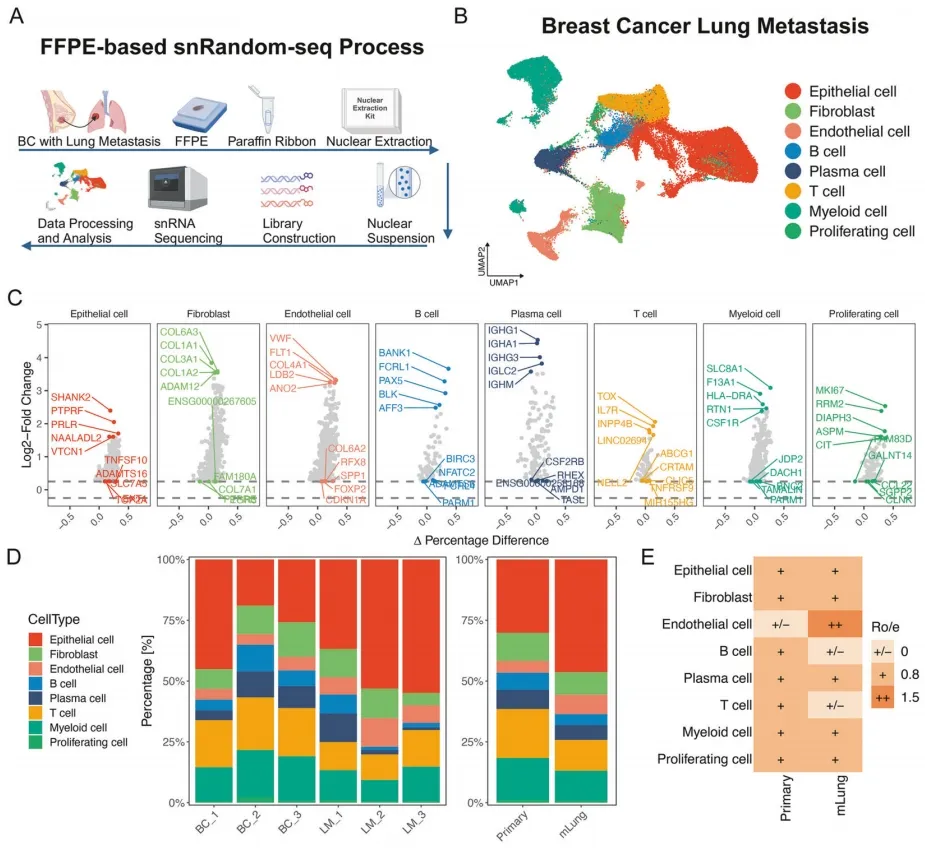 图7. 乳腺癌及肺转移灶的肿瘤微环境图谱
图7. 乳腺癌及肺转移灶的肿瘤微环境图谱
为深入探究肺转移灶内皮细胞异质性,研究者对内皮细胞进行重聚类分析,鉴定出 14 个亚群(图 8F)。借助淋巴管与血管内皮标志物(图 8G),成功区分 591 个淋巴管内皮细胞和 5,431 个血管内皮细胞(图 8H),并进一步将血管内皮细胞分为动脉、普通毛细血管和静脉三种亚型(图 8I-J)。其中,普通毛细血管内皮细胞在肺转移组织中显著富集,且通过 FFPE 全切片图像验证(图 8K)。该发现证实,基于 FFPE 样本的单细胞转录组测序可精准解析肺转移灶内皮细胞亚群的特异性分布特征。
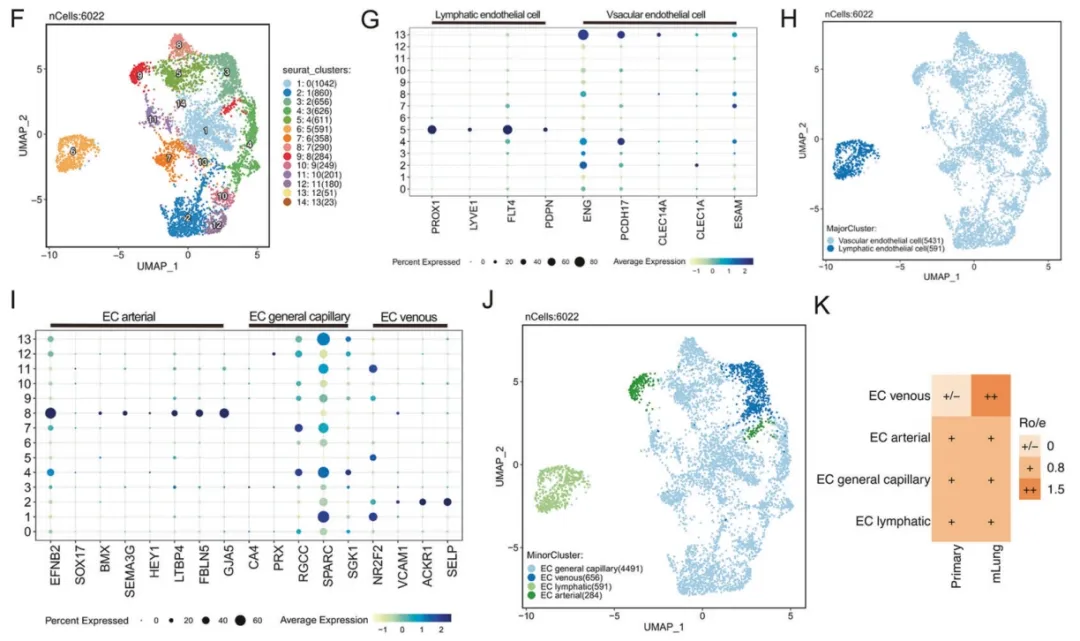 图8. 单细胞测序揭示乳腺癌肺转移灶内皮细胞的亚群特征
图8. 单细胞测序揭示乳腺癌肺转移灶内皮细胞的亚群特征
总结
本研究通过单细胞转录组测序联合 IMC、mIF 等技术,系统解析肺转移灶内皮细胞亚群特征及肿瘤微环境分子机制。结果显示,与原发灶相比,肺转移灶微环境中细胞群体的分布与富集模式显著不同,其中内皮细胞亚群的特异性富集特征尤为突出。该发现为乳腺癌肺转移的个性化治疗策略开发提供关键依据,特别是为抗血管生成治疗与免疫治疗的靶点挖掘奠定理论基础。值得关注的是,FFPE 样本单细胞转录组测序技术的应用,使大量临床珍贵 FFPE 样本得以用于前沿单细胞研究,在样本筛选与配对方面展现显著优势,极大拓展了单细胞测序技术在临床研究中的应用场景。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、蛋白芯片、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。





















 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


