|
这周的文献选自《Cell Reports》的“NFE2L3 Controls Colon Cancer Cell Growth through Regulation of DUX4, a CDK1 Inhibitor”在这项研究中,旨在揭示控制NFE2L3调节和功能的通路网络。
NFE2L3控制结肠肿瘤的生长
作者首先根据癌症基因组图谱(TCGA)数据库研究了正常及癌症组织中NFE2L3的mRNA水平,发现在结肠腺癌中NFE2L3明显上调,且IHC实验也证实了这一结果(图1A-C)。之后作者把样本分为4个组,观察到NFE2L3表达很弱,在大多数相邻的正常组织(95%)中,属于第1、2组。相反,NFE2L3水平很高,在大多数结肠肿瘤组织中,属于第2-4组(97%;图1D)。除了转移阶段,NFE2L3在肿瘤样品中的高表达与疾病的晚期相关(图1E)。在一这些结果表明NFE2L3可能在结肠腺癌的发展中起关键作用,并且可能与主要的致癌途径有关。
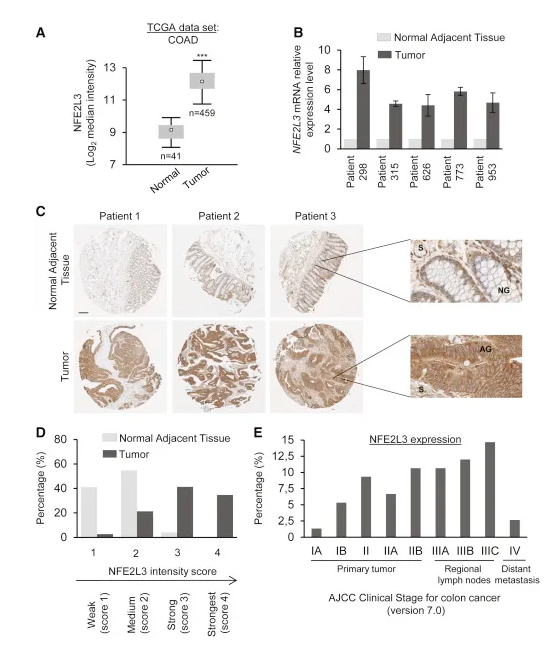 图1 图1
沉默NFE2L3抑制结肠癌细胞的增殖
为了评估NFE2L3在结肠癌中的作用,作者在不同的结肠癌细胞系HCT116和HT29中用两种不同的慢病毒短发夹RNA(shRNA)消除了NFE2L3的表达。NFE2L3的敲低已通过定量实时PCR和免疫印迹得到证实(图2A-B),并影响了所有先前表征的NFE2L3 A,B和C三种形式的丰度(图2 C)。作者观察到,敲减后三天,当NFE2L3被敲除后,细胞数量大大减少,集落形成显着减少(图2D-F)。相反,溴脱氧尿苷(BrdU)合并细胞数量减少,以及主要细胞增殖标记物MKI67 (Ki67)基因编码mRNA表达减少,表明NFE2L3发挥结肠癌细胞生长的正向调节作用(图2 G和2H)。为了模拟生理条件,作者在软琼脂分析中评估了不依赖锚定的结肠癌细胞的生长(图2I和2J)和HCT116细胞在小鼠异种移植模型中的体内增殖(图2K和2L)。在这两种情况下,NFE2L3敲低都严重损害了细胞的生长。在NFE2L3敲除样本的异种移植物中,MKI67染色降低证实了这一效应主要是由于体内细胞增殖减少(图2M和2N)。总之,这些结果证实了NFE2L3作为结肠癌细胞增殖和肿瘤生长的启动子的关键作用。
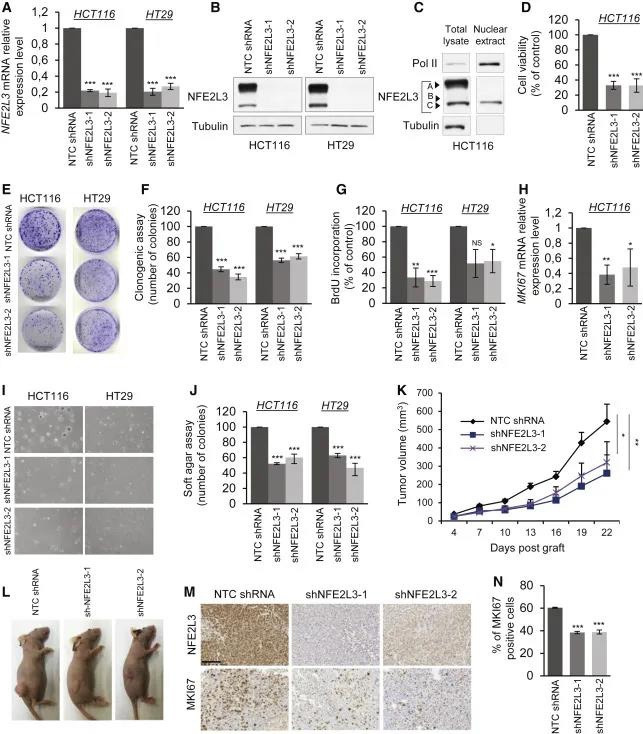 图2 图2
RELA充当NFE2L3表达的正调节剂
为了确定结肠癌细胞中NFE2L3上调的分子机制,作者在TNF激活后用不同信号通路的抑制剂处理了细胞,并评估了NFE2L3的水平。尽管MEK1 / 2,p38和PI3K / AKT抑制剂没有作用或作用很小,但作者观察到NF-κB信号抑制剂明显降低了NFE2L3水平(图3 A)。TNF处理结肠癌细胞系会增加NFE2L3蛋白水平;在用两种机制不同的NF-κB信号抑制剂处理细胞后,这种作用大大减弱(图3B-C):BAY 11-7082阻断TNF诱导的NFKBIA(IκBα)磷酸化,而JSH-23充当TNF-α抑制剂NF-κB转录活性。shRNA介导的敲除RELA可以显着降低NFE2L3 mRNA和蛋白质表达水平(图3D-E)。作者通过染色质免疫沉淀(ChIP)-qPCR分析和荧光素酶报告基因分析证实了这一点(图3H–J)。以上结果说明,RELA可以积极调节NFE2L3的表达,因此可能有助于其促癌作用。
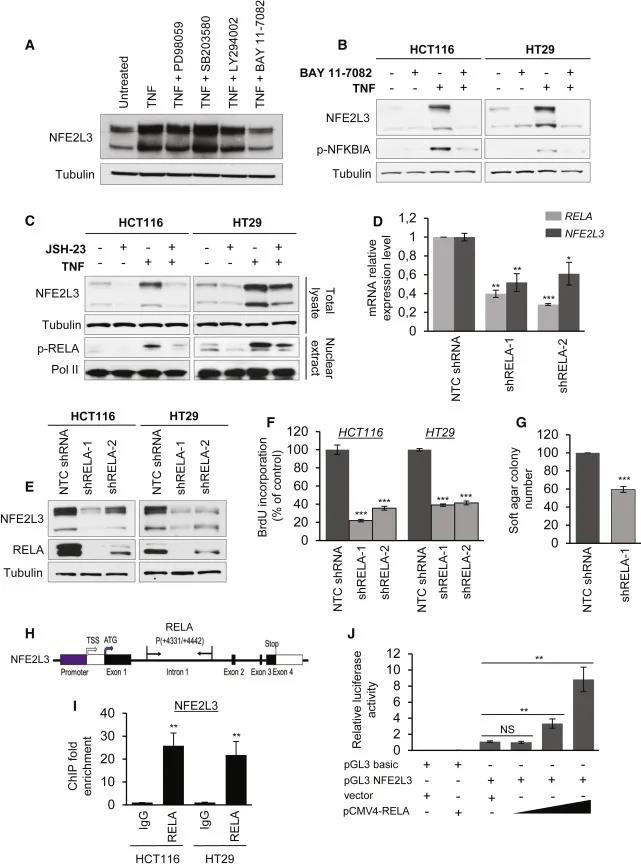
图3
将DUX4识别为NFE2L3的负调控目标
为了研究NFE2L3与细胞增殖之间的机制联系,作者研究了NFE2L3控制的基因,该基因可能介导其对结肠癌细胞增殖的影响。为了鉴定转录靶标,作者在TNF治疗的HCT116细胞中用NFE2L3特异性抗血清进行了ChIP测序。在已发现的潜在NFE2L3靶基因中,DUX4基因被选为候选基因,它与细胞周期有关。另外,当结合倍数富集和到转录起始位点(TSS)的距离时,DUX4被列为拥有其NFE2L3峰的最高基因收敛(图4 A)。通过ChIP-qPCR分析证实了NFE2L3与DUX4基因座的结合(图4 B),敲低NFE2L3导致DUX4 mRNA(图4 C)和蛋白质水平(图4 D)显着增加。通过慢病毒转导重新引入完整形式和核C形式的NFE2L3降低了DUX4水平,部分挽救了细胞增殖(图4E和4F)。与这些数据一致的是,通过relai -knockdown或JSH-23抑制剂处理抑制NF-κB可降低NFE2L3,增加DUX4蛋白水平(图4 G和4H)。为了评估升高的DUX4水平是否有助于抑制结肠癌细胞株中NFE2L3沉默后观察到的增殖,作者敲低了DUX4并观察到NFE2L3和DUX4的联合消耗,部分挽救了结肠癌细胞生长减少的表型,如BrdU和软琼脂测定结果一致(图4I-L)。作者还分析了DUX4结肠腺癌和正常邻近组织标本中的mRNA水平。总的来说,这些数据表明DUX4部分介导了在调节RELA和/或NFE2L3水平时观察到的增殖表型。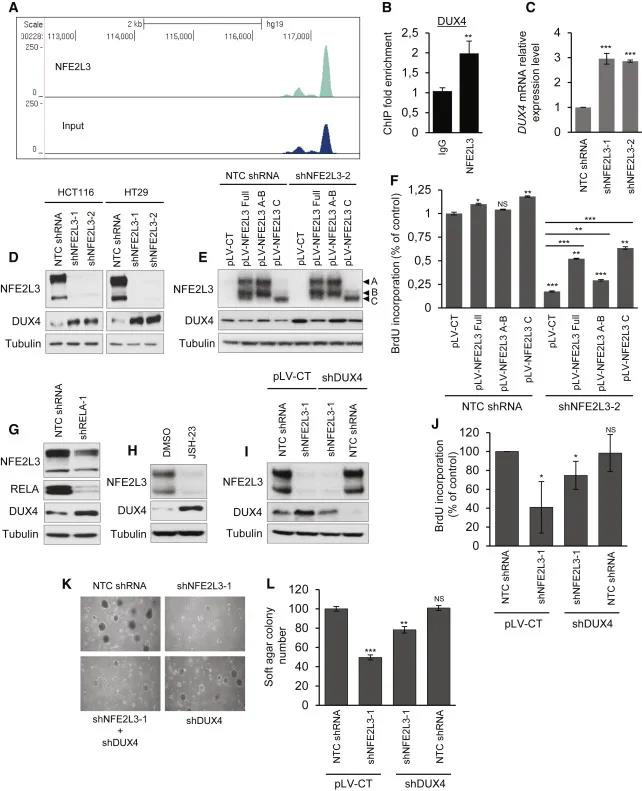
图4
DUX4作为CDK1活性的直接抑制剂的作用
为了了解DUX4如何影响细胞增殖,作者通过在HCT116细胞中进行免疫沉淀和质谱分析,在结肠癌细胞中研究了与DUX4相互作用的蛋白质。作者通过免疫共沉淀表位标记的CDK1和DUX4在HCT116细胞中共表达,证实了DUX4和CDK1之间的相互作用(图5A)。同时,作者用另外三个CDKs (CDK2, 4和6)进行了免疫共沉淀实验,以验证DUX4-CDK1相互作用的特异性(图5A)。显然,DUX4与CDK1之间的相互作用强于与CDK家族其他成员之间的相互作用。从表达NFE2L3 shRNA的细胞中免疫沉淀内源性CDK1,增加内源性DUX4蛋白水平,证实了该激酶与DUX4蛋白之间的相互作用(图5 B)。此外,作者使用ZDOCK服务器设计了DUX4-CDK1复合体的计算机模型(图5 C-D)。基于这些计算机在模型中,作者产生了三种不同的突变体,以表征与CDK1相互作用涉及的DUX4结构域(图5E)。从111-131位删除影响较大,从141-180位删除影响中等,减少了与CDK1的相互作用,而删除aa 381-400则没有影响(图5 F)。通过免疫沉淀,作者观察到与野生型蛋白相比,CDK1和那些DUX4突变体之间的相互作用降低了(图5G)。
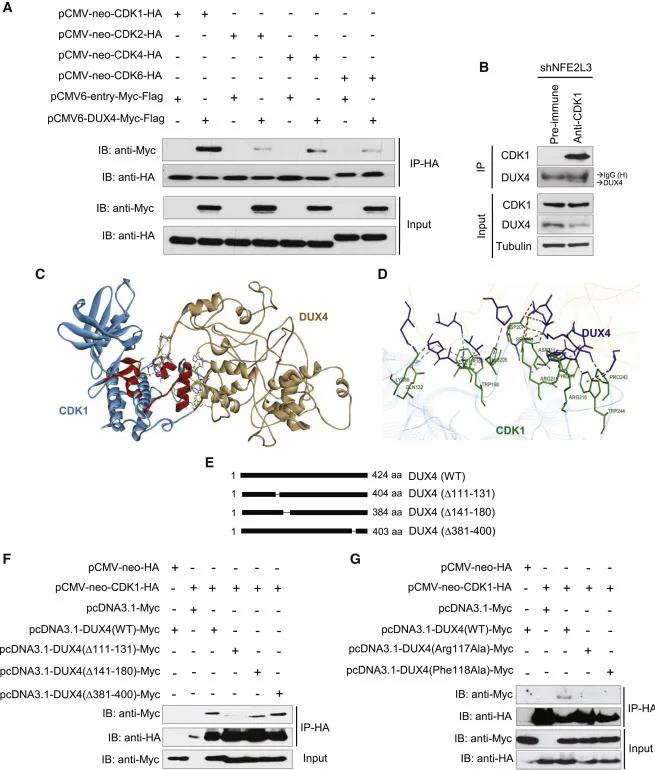 图5 图5
接下来,作者比较了DUX4与CDK1和CDK1-cyclin B复合物的结合,进行了谷胱甘肽S-转移酶(GST)下拉反应(图6 A-B)。作者的数据表明DUX4优先与CDK1相互作用,而与CDK1-cyclin B复合体的相互作用很小。此外,作者通过微尺度热泳(MST)定量评估了DUX4-GST和CDK1-His标签之间的相互作用。对于DUX4与CDK1的结合,作者确定了1.7±0.1μM的KD(解离常数)(图6 C)。仅将GST用作阴性对照。作者的结果表明DUX4蛋白直接与CDK1相互作用。
为了确定DUX4是否抑制CDK1的活性,作者通过免疫沉淀CDK1,并评估了其对重组组蛋白H1蛋白的体外激酶活性。结果显示,在单个DUX4或组合的NFE2L3 / DUX4敲低后,通过H1磷酸化测量的CDK1活性在NFE2L3敲低后的细胞中大大降低,但在对照细胞中没有改变(图6 D)。细胞周期分析和高水平的NUP98还显示,NFE2L3沉默会导致G2 / M期细胞蓄积,这由CDK1-cyclin B复合物控制(图6 E–6G)。因此,CDK1活性的降低可能解释了敲低NFE2L3后结肠癌细胞增殖的减少。总之,作者的数据揭示了NF-κB信号通路与细胞周期调控之间的联系,其中NFE2L3充当CDK1抑制剂DUX4的阻遏物(图6 H)。
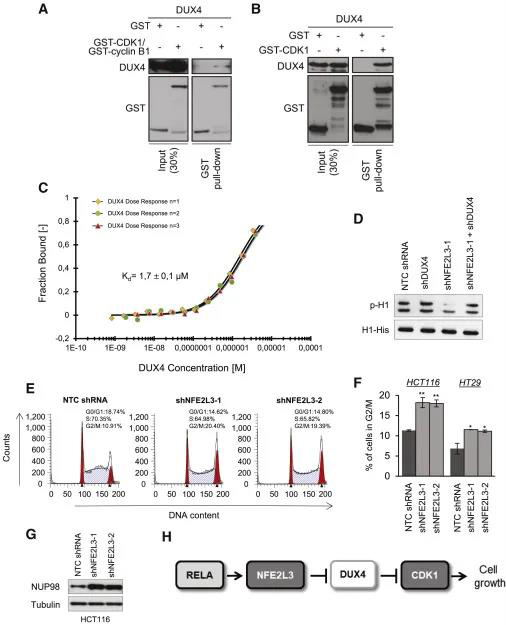 图6 图6
总结:
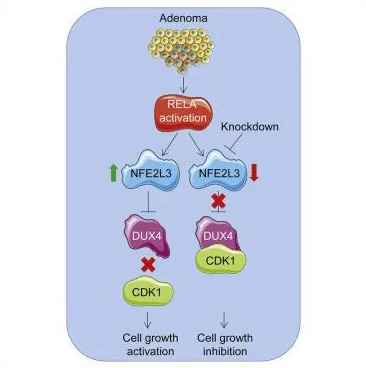
组成性核因子κB (NF-κB)的激活是结肠肿瘤生长的一个标志。细胞周期依赖激酶(CDKs)是关键的细胞周期调节因子,抑制CDK活性已被成功地用于抗癌治疗。本研究表明,NFE2L3转录因子在NF-κB信号通路与CDK1活性控制之间起关键调控作用,从而驱动结肠癌细胞增殖。作者发现NFE2L3的表达受NF-κB的RELA亚基调控,并且与正常的邻近组织相比,结肠腺癌患者NFE2L3水平升高。NFE2L3沉默显著降低了结肠癌细胞的体外增殖和体内肿瘤的生长。NFE2L3敲除导致双同源框因子4 (DUX4)水平升高,而DUX4是CDK1的直接抑制剂。发现的控制细胞周期进展的致癌途径可能为精确的癌症治疗开辟了独特的途径。
本文涉及技术: 流式细胞术
本文涉及技术: 多重免疫组化
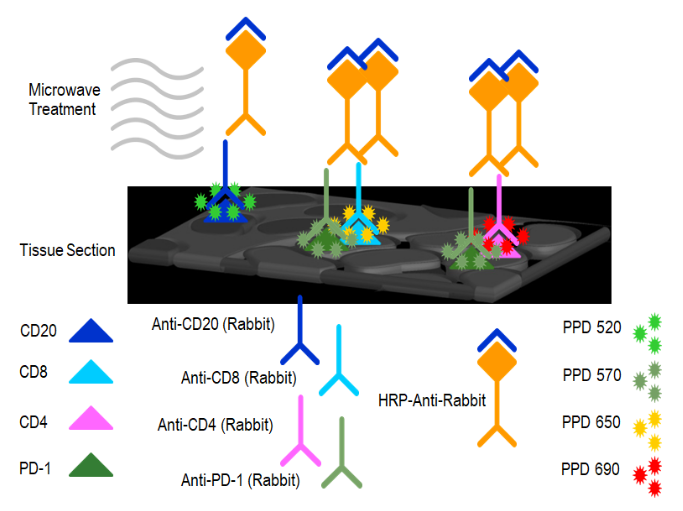
本文涉及技术: 单/多因子检测
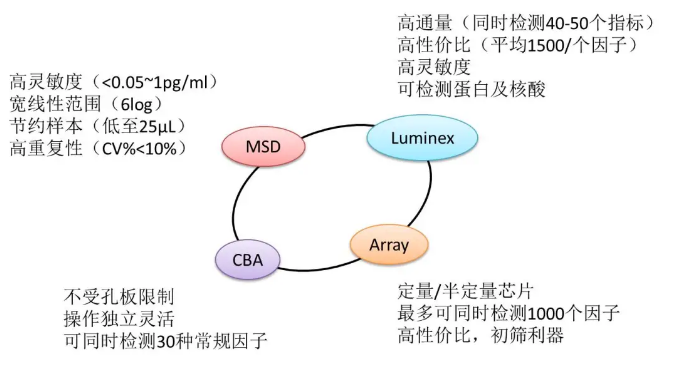
|






















 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


