在干细胞生物学研究领域,神经干细胞(NSCs)的定向分化机制始终是揭示神经系统发育奥秘、推动神经再生医学发展的核心课题。神经干细胞作为一类具有自我更新能力和多向分化潜能的细胞群体,能够在特定条件下精准分化为神经元、星形胶质细胞和少突胶质细胞等多种神经细胞类型,这一过程受到内在遗传程序与外在微环境信号的协同调控。深入解析神经干细胞定向分化的分子机制,不仅有助于阐明神经系统发育的基本规律,更为神经退行性疾病的细胞治疗提供了重要的理论基础和技术支撑。
1、神经干细胞定向分化的动态过程
神经干细胞的定向分化是一个高度有序的动态过程,涉及细胞命运决定、表型特征形成和功能成熟等多个阶段,在胚胎发育和成年神经发生中呈现出精准的时空调控模式。
1.1 神经诱导阶段
在胚胎发育早期,原始外胚层细胞经历神经诱导过程,逐步获得神经干细胞特性,这是神经系统发生的起始步骤。神经诱导过程的核心是打破外胚层细胞的默认分化命运,使其向神经命运转变。研究表明,骨形态发生蛋白(BMP)信号通路的抑制是神经诱导的关键调控事件。在脊椎动物胚胎中,organizer 区域分泌的 Noggin、Chordin 等 BMP 拮抗剂能够中和表皮外胚层中的 BMP 信号,解除其对神经命运的抑制作用,从而启动神经发生程序。
同时,成纤维细胞生长因子(FGF)信号通路的激活在神经诱导中也发挥重要作用,FGF 不仅能够直接促进神经相关基因的表达,还可通过下调 BMP 受体的表达增强细胞对 BMP 信号的抵抗性。这一阶段细胞逐步表达巢蛋白(Nestin)、Sox2 等神经干细胞标志物,形成神经板结构,为后续神经组织的形成奠定基础。
1.2 区域特化阶段
经过神经诱导形成的神经干细胞群体,在神经管发育过程中沿着前后轴和背腹轴方向发生区域特化,形成不同脑区和脊髓节段的神经前体细胞。这一过程受到多种形态发生素的梯度调控,形成精确的位置信息编码。在脊髓发育中,腹侧神经管受到来自脊索的 Sonic Hedgehog(Shh)信号调控,Shh 形成由腹侧向背侧递减的浓度梯度,诱导不同类型运动神经元和中间神经元的分化。
高浓度 Shh 诱导腹侧底板细胞和 V3 中间神经元形成,而较低浓度则诱导运动神经元和 V2 中间神经元分化。与之相对,背侧神经管受到来自表皮的 BMP 和 Wnt 信号调控,形成由背侧向腹侧递减的信号梯度,诱导背侧感觉神经元的分化。这种梯度信号通过调控 Pax、Nkx 等家族转录因子的区域特异性表达,建立起细胞的位置特性,确保不同区域神经细胞的正确分化。
1.3 细胞类型分化阶段
区域特化后的神经前体细胞进一步经历细胞类型分化,最终产生神经元、星形胶质细胞和少突胶质细胞等主要神经细胞类型,这一过程在发育时序上呈现出明显的先后顺序。在胚胎发育早期,神经干细胞主要向神经元方向分化,形成神经系统的基本网络结构;而在出生后,神经干细胞的分化重心转向胶质细胞,星形胶质细胞和少突胶质细胞相继产生,参与神经环路的功能完善和髓鞘形成。
细胞类型分化受到特异性转录因子的精密调控,NeuroD1、Ascl1 等转录因子通过激活神经元特异性基因表达,推动神经干细胞向神经元分化;Sox9、Stat3 等因子则促进星形胶质细胞分化;Olig1、Olig2 等因子在少突胶质细胞的命运决定中发挥关键作用。这些转录因子形成相互拮抗又协同作用的调控网络,确保不同细胞类型的平衡产生。
2、神经干细胞定向分化的调控因素
神经干细胞的定向分化行为受到内在调控因子和外在微环境信号的协同作用,形成复杂的调控网络,精确控制细胞命运决定过程。
2.1 内在调控因素
转录因子网络在神经干细胞定向分化中发挥核心调控作用,通过组合性表达和相互作用决定细胞的分化方向。Pax6 作为一种进化保守的转录因子,在端脑发育中维持神经干细胞的增殖能力,同时抑制过早分化,而其表达下调则促进神经元分化。Olig2 在脊髓运动神经元和少突胶质细胞分化中具有双重功能,在发育早期与 Ngn2 协同促进运动神经元分化,而在后期则通过与 Sox10 相互作用诱导少突胶质细胞形成。
表观遗传修饰通过影响染色质状态和基因表达参与分化调控。DNA 甲基化通常与基因沉默相关,神经干细胞分化过程中,神经元特异性基因启动子区的去甲基化使其激活表达。组蛋白修饰呈现多样化调控模式,组蛋白 H3K4 三甲基化与基因激活相关,而 H3K27 三甲基化则与基因沉默相关,这些修饰状态的动态变化由相应的修饰酶精确调控。非编码 RNA 特别是 microRNA 通过靶向调控转录因子和信号分子的表达,在分化时序调控中发挥重要作用,例如 miR-124 通过抑制非神经基因表达促进神经元分化。
2.2 外在调控因素
细胞外基质(ECM)作为细胞微环境的重要组成部分,通过物理特性和生化信号影响神经干细胞的分化行为。纤连蛋白通过与细胞表面的整合素 α5β1 结合,激活 FAK-RhoA 信号通路,促进神经干细胞的增殖和向神经元分化;层粘连蛋白则通过整合素 α6β1 介导的信号,维持神经干细胞的未分化状态或诱导其向特定神经元亚型分化。ECM 的物理特性如刚度也可调控分化方向,柔软基质促进神经元分化,而较硬基质则倾向于诱导胶质细胞分化。
生长因子和细胞因子构成复杂的信号网络调控分化进程。神经生长因子(NGF)和脑源性神经营养因子(BDNF)通过激活 Trk 受体酪氨酸激酶,促进神经元的存活、突起生长和功能成熟;睫状神经营养因子(CNTF)通过激活 JAK-STAT3 信号通路,上调星形胶质细胞特异性基因如 GFAP 的表达,推动向星形胶质细胞分化;血小板衍生生长因子(PDGF)和甲状腺激素 T3 则是少突胶质细胞分化的关键诱导因子,促进少突胶质前体细胞的增殖和成熟。
神经递质在神经干细胞分化中具有非突触性调控作用。在发育早期,γ- 氨基丁酸(GABA)通过激活 GABAA 受体引起氯离子内流,产生去极化效应,促进神经干细胞的增殖和早期神经元分化;谷氨酸通过 NMDA 和 AMPA 受体激活 Ca²⁺内流,调控神经发生相关基因的表达,影响神经元的迁移和突触形成。这些神经递质信号与生长因子信号相互整合,共同调控分化过程的时空特性。
3、神经干细胞定向分化的研究应用前景
神经干细胞定向分化技术的发展为神经系统疾病的治疗带来了新的希望。在神经再生与修复领域,通过体外诱导神经干细胞定向分化为特定功能的神经元,可用于细胞移植治疗帕金森病、阿尔茨海默病等神经退行性疾病。例如,利用 Shh、FGF8 等因子组合可高效诱导神经干细胞分化为多巴胺能神经元,将其移植到帕金森病模型动物的纹状体中,能够存活并整合到宿主神经环路,分泌多巴胺改善运动功能障碍。
对于脊髓损伤,诱导神经干细胞分化为少突胶质细胞可促进髓鞘再生,而定向分化的运动神经元前体细胞移植则有望重建神经传导通路。在疾病模型构建方面,利用患者特异性诱导多能干细胞(iPSC)定向分化为神经细胞,可模拟神经系统疾病的病理过程,用于疾病机制研究和药物筛选。例如,阿尔茨海默病患者 iPSC 分化的神经元可再现 tau 蛋白过度磷酸化和淀粉样蛋白沉积等病理特征,为筛选有效的疾病修饰药物提供平台。
未来研究需进一步优化定向分化的效率和特异性,解决移植细胞的存活、整合和功能调控等关键问题,同时深入探索内在和外在调控因素的相互作用机制,为实现神经干细胞的精准调控和临床转化应用奠定基础。随着技术的不断进步,神经干细胞定向分化技术必将在神经系统疾病治疗中发挥越来越重要的作用。
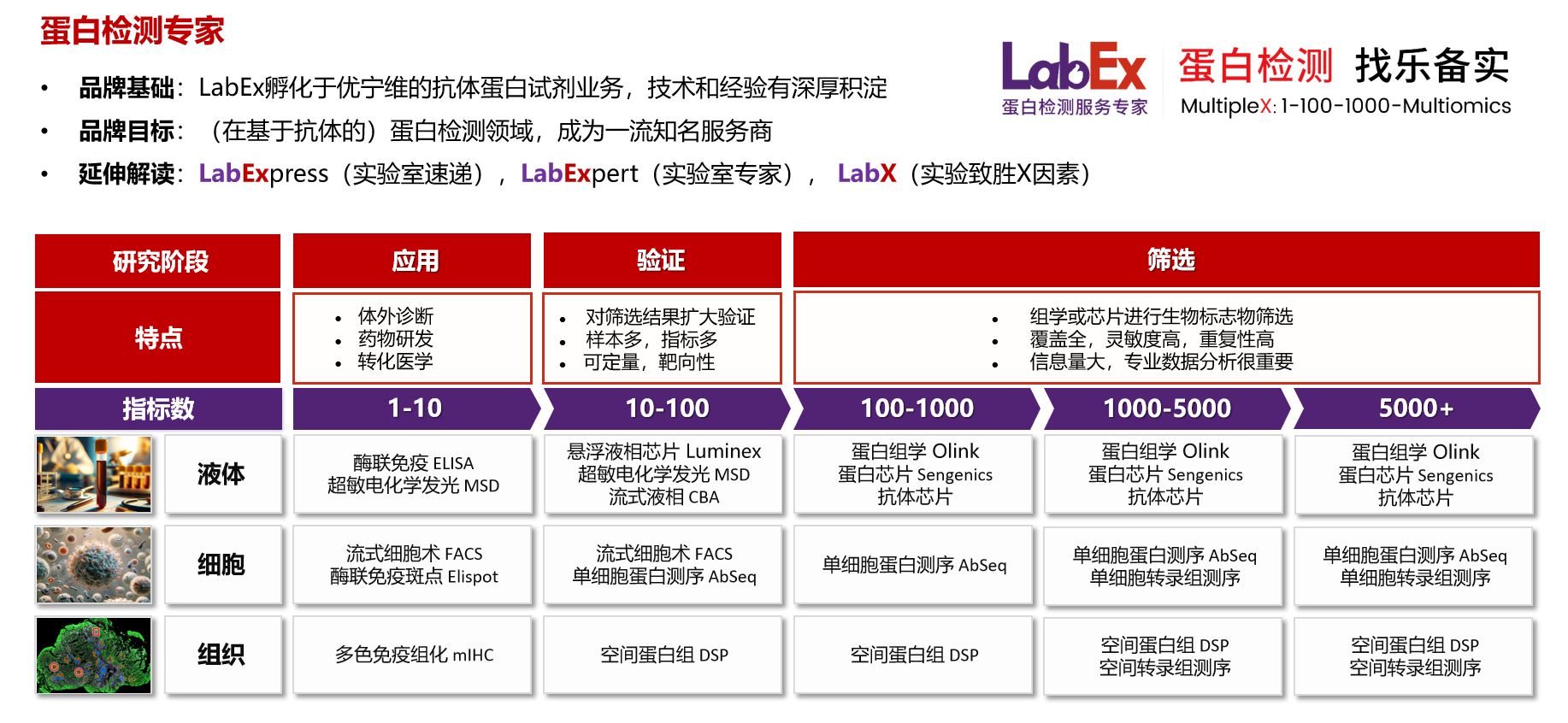
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


