蛋白质 - 蛋白质相互作用(PPIs)是细胞信号传导、代谢调控等核心生命活动的 “分子枢纽”,其空间动态变化直接决定细胞功能。传统研究方法如免疫共沉淀需破坏细胞结构,酵母双杂交难以模拟天然微环境,均无法实现原位、高灵敏、低丰度 PPIs的精准解析。而邻近连接检测技术(PLA)的出现,融合抗体特异性与核酸信号放大优势,可在细胞或组织中原位检测距离 <20-40 nm 的 PPIs,不仅 “看见” 互作发生,更 “看透” 其亚细胞定位、动态变化及疾病关联,成为 PPIs 研究的革新工具。
为破解多通路串扰场景下的 PPIs 分析难题,顺序 PLA 通过分阶段加入差异化荧光标记的 PLA 探针,实现单一样本中 47 种蛋白质参与的 PPIs 多重检测。该技术与免疫荧光联用,既能确定 PPIs 在亚细胞结构(如细胞膜、高尔基体)的共定位,又能追踪外界干预下的互作动态。
在 EGFR 突变型非小细胞肺癌研究中,顺序 PLA 清晰揭示:奥希替尼处理 24 小时后,细胞膜上 EGFR-AKT 互作斑点减少 60%,细胞质中 EGFR-STAT3 互作增强(提示通路代偿);基于空间互作数据构建的图卷积网络,可精准预测单细胞药物处理状态(准确率 92%),为靶向 PPIs 药物设计提供依据。
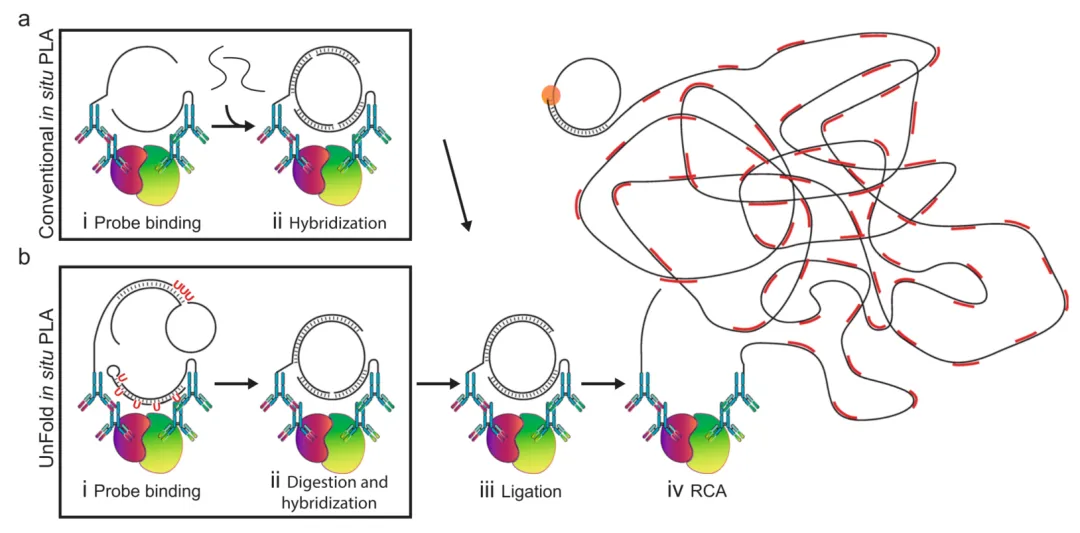
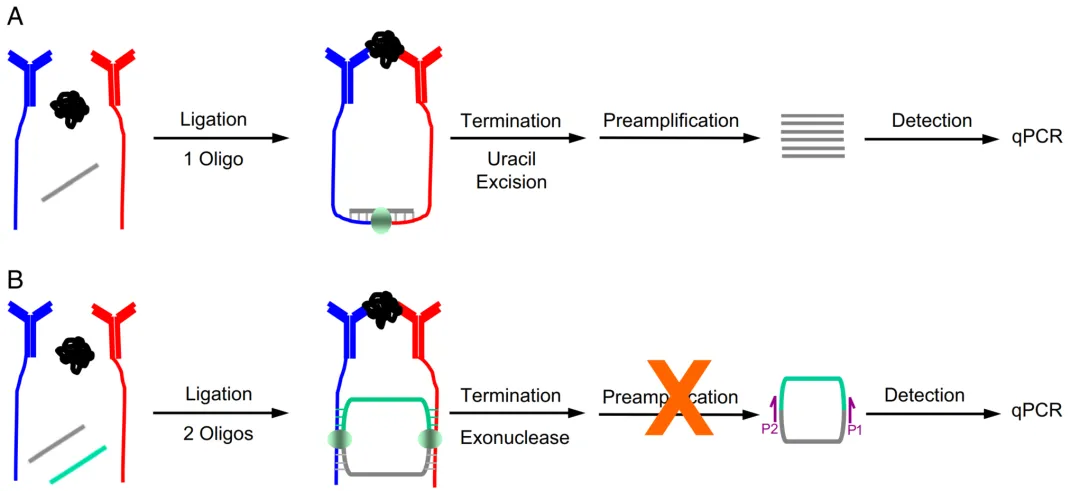
环形 PLA 通过 “环形 DNA 形成” 优化反应设计:目标蛋白互作时,探针寡核苷酸形成线性前体,经连接酶催化为闭合环形 DNA,再通过核酸外切酶降解未环化序列去除背景。这一设计带来三重优势:降低随机连接背景、提升检测选择性,且兼容低亲和力抗体 —— 在人体血浆中对 CA125 的检测灵敏度较传统 PLA 提升 3-5 倍,重现性(CV<8%)更优,为临床缺乏高亲和力试剂的场景提供新路径。
蛋白互作PLA技术原理是什么:基于邻位连接技术,通过DNA环化扩增产生可检测荧光信号。
PLA 通过 “两步协同” 实现 PPIs 检测:
特异性识别:两种不同物种一抗分别结合目标 PPIs 的两个蛋白,再结合偶联寡核苷酸的 PLA 探针(二抗);
信号放大:若蛋白互作(距离 < 20-40 nm),探针寡核苷酸靠近,启动滚环 DNA 合成(RCA),生成大量重复序列;
荧光检测:荧光标记的互补探针结合 RCA 产物,形成高浓度荧光斑点,每个斑点代表一组原位 PPIs,可量化互作水平。
超高灵敏度:RCA 放大效率达 10³-10⁴倍,可检测 fM 至 nM 级低丰度 PPIs,适用于循环肿瘤细胞等微量样本;
原位保留信息:无需破坏细胞,可在活细胞 / 组织中检测,同时保留亚细胞定位,解析互作的空间调控;
强兼容性:无需纯化蛋白,可与免疫荧光、流式细胞术、ELISA 联用,形成 “互作 - 表达 - 功能” 完整研究链。
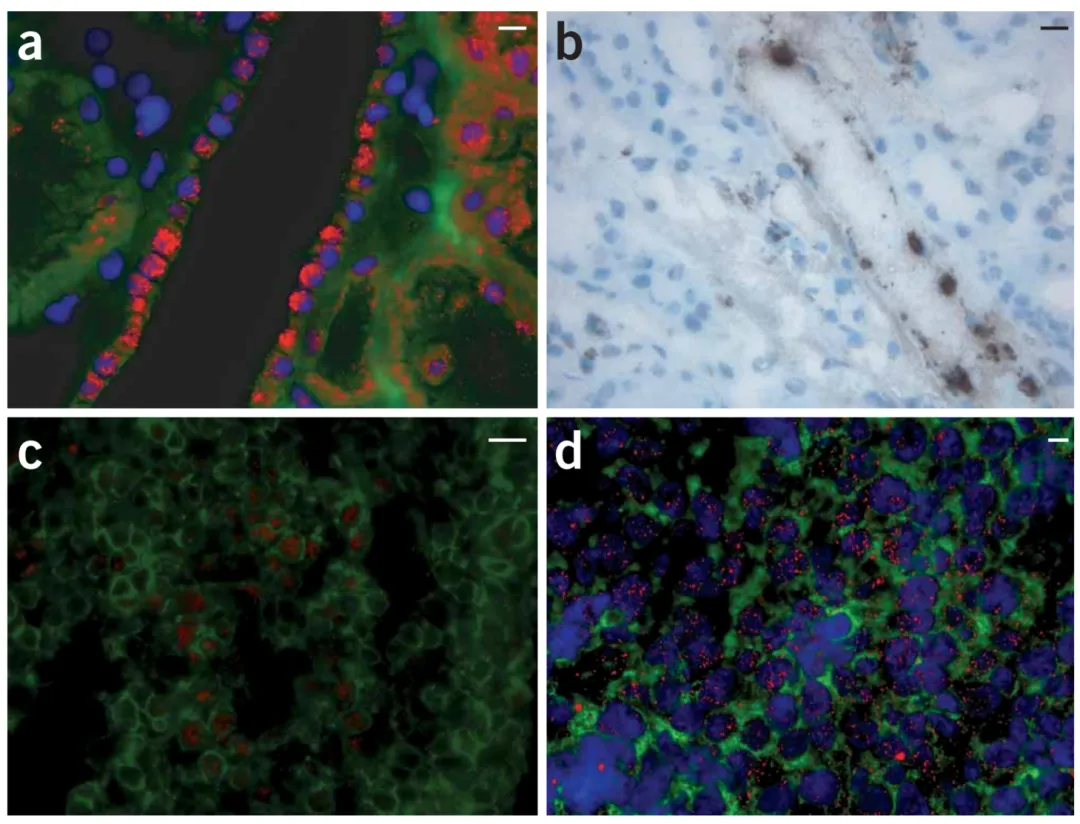
淋巴瘤:PLA 发现弥漫性大 B 细胞淋巴瘤中,MYC 与 BCL-2 互作显著富集,该互作抑制 MYC 介导的凋亡,与预后负相关,为靶向药物开发提供靶点;
肺癌:动态追踪 EGFR 突变型 NSCLC 中 EGFR 与 PI3K/SRC 的互作,奥希替尼耐药细胞中 EGFR-SRC 互作增强,提示 SRC 抑制剂可逆转耐药。
在 PD-1/PD-L1 免疫治疗中,PLA 检测 T 细胞 PD-1 与肿瘤细胞 PD-L1 的原位互作 —— 抗 PD-1 抗体处理后,互作斑点减少 80%,减少程度与患者客观缓解率正相关,为临床用药提供分子标志物。
遗传性心肌病中,MYBPC3 突变减弱其与肌动蛋白的互作;PLA 结合单分子成像显示,患者心肌组织中该互作斑点密度降低,且降低程度与心肌肥厚正相关,助力罕见病机制解析与诊断。
PLA 技术仍有广阔优化空间:技术上,结合微流控可实现高通量检测,适配临床大样本;应用上,可拓展至类器官、活体成像,解析生理病理下 PPIs 动态网络;临床转化上,c-PLA 有望开发为 PPIs 靶向诊断试剂,用于肿瘤早期筛查。蛋白互作PLA结果怎么分析通过计数每个细胞内的荧光点数目进行定量统计分析。未来,PLA 将推动 PPIs 研究从 “定性” 向 “定量、原位、动态” 跨越,为生命科学与临床诊断带来更多突破。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。














 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


