一、ELISA 的核心定义与检测原理
固相包被:将已知抗原或抗体通过物理吸附(疏水、静电作用)固定于聚苯乙烯微孔板(固相载体),确保包被分子均匀分布且保留天然构象,为后续结合反应提供稳定界面;
封闭处理:用 5% 脱脂牛奶或 1% BSA 等封闭液孵育,占据载体空白位点,避免游离成分非特异性吸附,降低背景信号;
样本孵育:加入含待测物质的样本(血清、细胞培养液等),37℃孵育 60 分钟左右,使目标物质与固相包被分子特异性结合,形成 “固相 - 待测物质” 复合物;
洗涤分离:用含 0.05% 吐温 - 20 的 PBS 多次洗涤,去除液相中未结合的杂蛋白、游离抗体等,仅保留固相表面的特异性复合物;
酶标显色与定量:加入酶标记二抗(如 HRP、ALP 标记),形成 “固相 - 待测物质 - 酶标二抗” 三明治结构;再加入特异性底物(TMB、pNPP 等),酶催化底物显色后,通过酶标仪检测吸光度,结合标准曲线计算待测物质浓度。
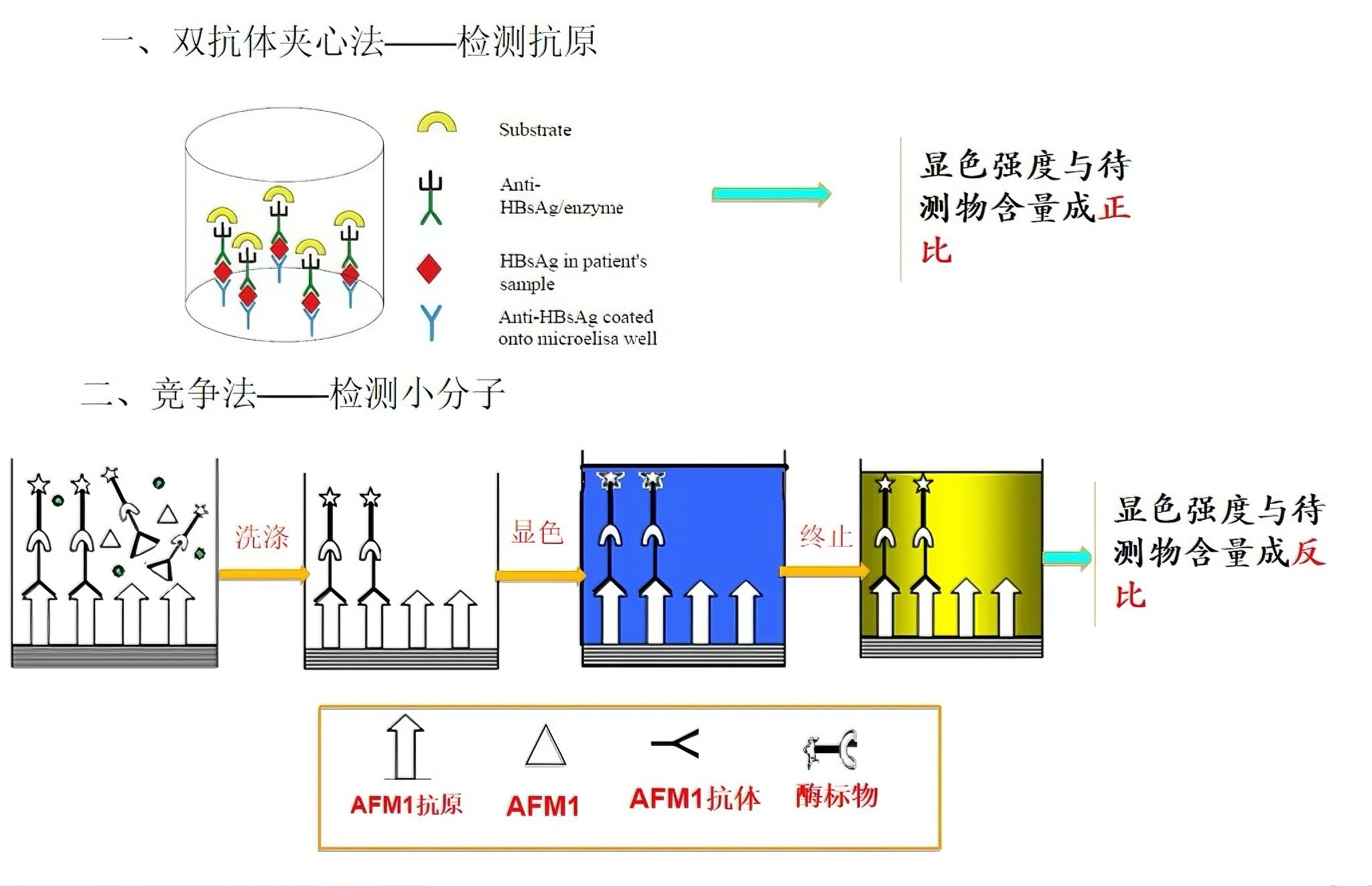
ELISA试剂盒的原理
二、ELISA 技术的发展历程:从初创到产业化
(一)初创期(20 世纪 70 年代):方法奠基
(二)优化期(20 世纪 80-90 年代):技术突破
单抗技术应用:杂交瘤技术诞生后,单抗以 “特异性强、均一性高” 取代多抗,如肿瘤标志物 AFP 检测的交叉反应率从 15% 降至 1% 以下;
基因工程升级:重组技术改造抗体(如 scFv、Fab 片段),提升结合效率;实现抗体 - 酶融合表达,简化酶标过程;
仪器革新:全自动酶标仪实现 96/384 孔高通量检测,速度较手动提升 10 倍,部分集成荧光、化学发光功能,拓展检测范围。
(三)应用期(21 世纪至今):多领域落地
医疗诊断:成为传染病(乙肝、新冠)、肿瘤(CEA、CA125)、自身免疫病的常规检测技术,如乙肝五项 ELISA 检测灵敏度达 0.1ng/mL;
食品安全:检测药物残留(青霉素、瘦肉精)、微生物毒素(黄曲霉素),如牛奶青霉素残留检测限 0.1μg/kg,远低于国标;
环境监测:检测水体、土壤中的农药残留、重金属结合蛋白,支撑生态评估。
三、ELISA 的核心基础概念:抗原与抗体
(一)抗原:检测的靶向核心
完全抗原:同时具备免疫原性(刺激机体产抗体)与免疫反应性(与抗体结合),如蛋白质、细菌、病毒等,例如 BSA 可刺激小鼠产生抗 BSA 抗体,且能与该抗体结合;
半抗原(不完全抗原):仅具免疫反应性,需与蛋白质载体(BSA、OVA)偶联才获免疫原性,如氯霉素、青霉素等小分子,适配 ELISA 检测食品中小分子污染物。
抗原决定簇:抗原表面决定特异性的 6-12 个氨基酸 / 碳水基团,是抗体识别的关键位点,其特异性直接决定 ELISA 检测准确性,避免交叉反应。
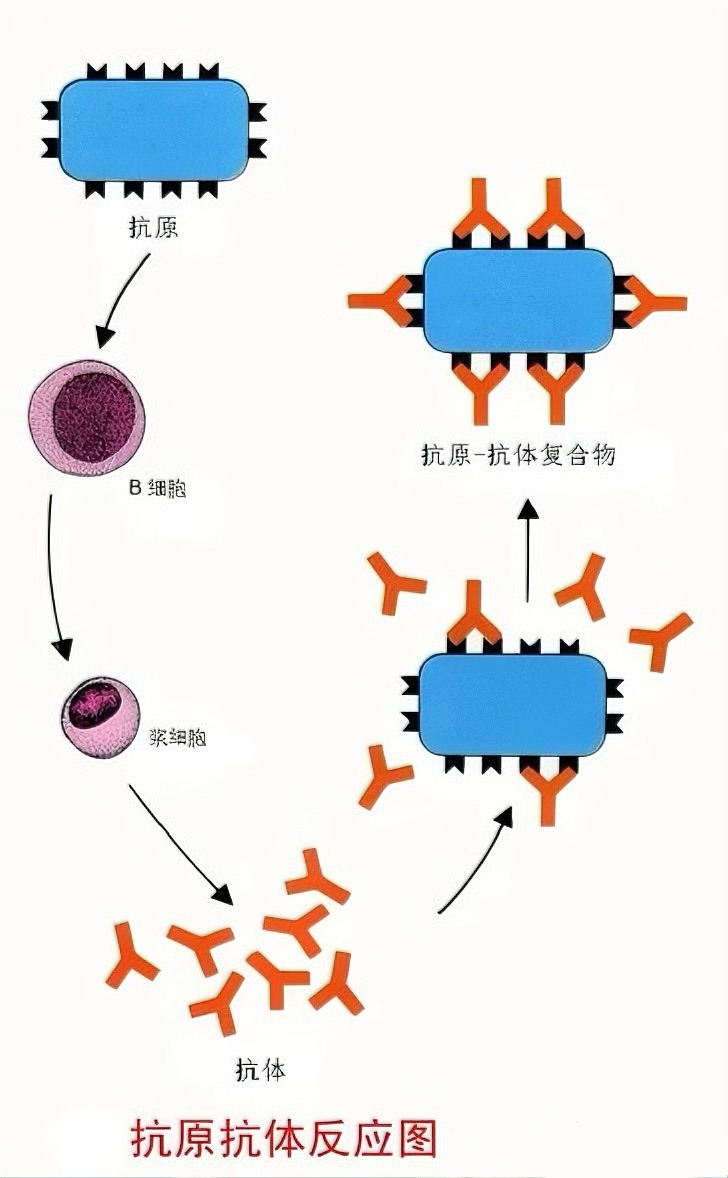
(二)抗体:检测的识别工具
单抗与多抗:
单抗:单一 B 细胞克隆产生,针对单个抗原决定簇,特异性强、批次稳定,适用于肿瘤标志物等精准检测;
多抗:多种 B 细胞产生,针对多个抗原决定簇,亲和力高、成本低,适用于低丰度抗原捕获;
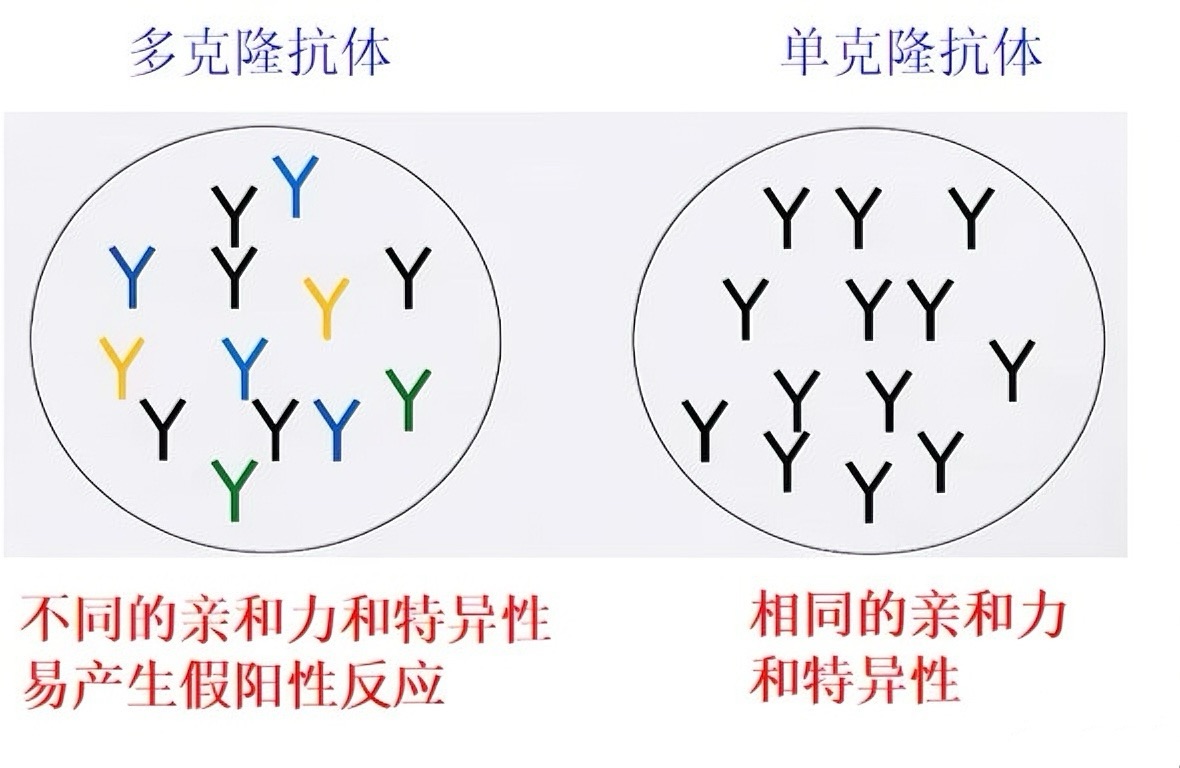
一抗与二抗:
一抗:直接结合目标抗原,如抗 HBsAg 抗体检测乙肝表面抗原;
二抗:针对一抗恒定区(如羊抗小鼠 IgG-HRP),偶联酶实现信号放大,简化流程且提升灵敏度。
四、总结与展望











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


