摘要
N6 - 甲基腺苷(m6A)作为真核生物 RNA 关键表观遗传修饰,由甲基转移酶(writers,如 METTL3)、去甲基化酶(erasers,如 FTO/ALKBH5)及结合蛋白(readers,如 YTH 家族)协同维持动态平衡,深度参与基因表达调控。它精准作用于 mRNA 剪接、核输出、翻译、降解等代谢环节,还能干预 miRNA 加工,构建复杂基因表达网络。本文系统梳理 m6A 在 RNA 代谢中的分子机制,揭示其核心调控地位,为疾病机制研究与干预策略开发筑牢理论根基。
一、m6A 修饰:基因表达调控的 “分子密码” 体系
m6A 修饰广泛分布于 mRNA 编码区、3' 非翻译区(3'UTR)及非编码 RNA,通过三类核心蛋白构建调控网络:以 METTL3 为核心的甲基转移酶复合物(writers),在 mRNA 转录后迅速开展修饰,决定修饰位点特异性;FTO、ALKBH5 等去甲基化酶(erasers),分别在不同亚细胞区域维持 m6A 动态平衡;YTHDF 家族、HNRNPA2B1 等结合蛋白(readers),精准识别 m6A 标记并介导下游 RNA 代谢事件。m6A甲基化如何调控基因表达:mRNA上最常见的化学修饰,影响其剪接、稳定性和翻译效率。
正常生理状态下,m6A 如同 “分子密码”,有序引导 mRNA 完成剪接、核输出、翻译与降解流程;一旦修饰平衡被打破,RNA 代谢紊乱随之而来,与肿瘤发生、神经退行性疾病进展等病理过程紧密关联,成为基因表达调控网络的核心支点。
二、m6A 对 mRNA 代谢的精准调控
(一)mRNA 前体剪接的 “指挥棒”
mRNA 前体剪接依赖剪接体精准切除内含子、连接外显子,m6A 在此过程中扮演多重角色:一方面,HNRNPA2B1 等结合蛋白识别 m6A 位点,招募 SR 蛋白等剪接因子,灵活调控外显子选择,塑造多样剪接异构体;另一方面,m6A 修饰降低 A - U 碱基对稳定性,重塑 RNA 二级结构,暴露隐藏剪接位点,影响剪接因子结合效率。同时,ALKBH5 功能异常可改变 ASF/SF2 磷酸化水平,间接干预剪接进程。
实验证据充分印证:经环亮氨酸处理细胞后,mRNA 前体在核内大量累积,成熟 mRNA 产量锐减;METTL3 敲低细胞中,甲基化基因的剪接异构体表达格局改变,且 m6A 修饰峰在剪接相关区域显著富集,清晰勾勒出 m6A 与选择性剪接的内在关联。
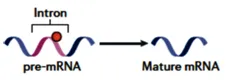
图1 m6A修饰对mRNA前体剪接的影响
(二)mRNA 核输出的 “加速器” 与 “制动器”
成熟 mRNA 需经核孔复合体转运至细胞质,m6A 对这一过程的调控兼具特异性与复杂性。当 m6A 修饰缺失(如 STH 处理 HeLa 细胞),mRNA 核内滞留时间延长 40%,核输出受阻;而在 ALKBH5 缺陷细胞中,m6A 水平升高,新生 mRNA 更多分布于细胞质,因 ASF/SF2 磷酸化状态改变,增强其与 TAP - P15 转运复合体互作,加速核输出。值得注意的是,m6A 调控具 RNA 种类偏好性,mRNA 核输出对其高度敏感,rRNA 因独立转运途径,受 ALKBH5 缺陷影响甚微;ALKBH5 缺陷引发的 SRPK1 异常聚集,也从侧面映射出 m6A 在 RNA 代谢多环节的调控势能。
(三)mRNA 翻译的 “双向调控阀”
m6A 对 mRNA 翻译效率的影响呈现双向性,这由 mRNA 特性与结合蛋白共同决定:YTHDF1 识别 m6A 位点时,可招募 eIF3 等核糖体起始因子,像小鼠 DHFR mRNA 体外甲基化后,翻译水平提升 1.5 倍,展现促进翻译的效能;然而,当 m6A 导致 mRNA 结构改变,阻碍核糖体结合,或 YTHDF2 等结合蛋白招募降解复合体时,翻译会被抑制,如环亮氨酸处理细胞,体外翻译产生的 DHFR 蛋白量降低 20% 。这种双向调控本质上是 mRNA 顺式元件(m6A 位点周边序列)与反式作用因子(结合蛋白类型)协同作用的结果,具体分子机制仍待深入挖掘,却为基因表达的精细调控提供了灵活 “阀门”。
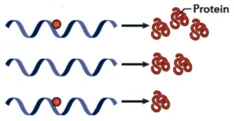
图2 m6A修饰对mRNA翻译的影响
(四)mRNA 稳定性的 “调控器”
mRNA 稳定性由 3'UTR 区域的 ARE、miRNA 结合位点等功能元件主导,m6A 通过两条路径参与调控:一方面,ELAV1/HuR 等结合蛋白识别 3'UTR m6A 位点与 ARE,增强 mRNA 稳定性,而 YTHDF2 则反向操作,招募降解复合体加速 mRNA 降解;另一方面,m6A 与 mRNA 剪接深度关联,METTL3 敲低细胞中,含 m6A 位点的 mRNA 表达水平下降,尤其是内含子携带 m6A 修饰的 mRNA,因剪接受损触发质量控制机制,被细胞主动降解。m6A 对 mRNA 稳定性的调控并非全局统一,而是针对特定基因实施精准干预,确保基因表达调控的精细度与灵活性。
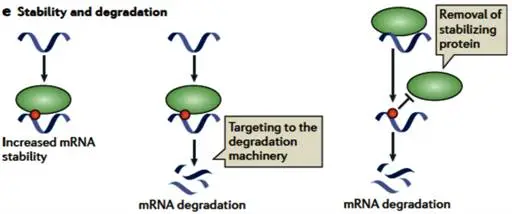
图3 m6A对mRNA稳定性的影响
三、m6A 与 miRNA 加工的交互:基因网络的 “协同者”
miRNA 成熟需历经核内 pri - miRNA 剪接(由 DGCR8 - Drosha 复合体介导)与细胞质 pre - miRNA 切割(由 Dicer 介导)两个关键步骤,m6A 深度参与其中:HNRNPA2B1 识别 pri - miRNA 上的 m6A 位点,与 DGCR8 相互作用,推动 pri - miRNA 剪接进程;同时,m6A 修饰可改变 pri - miRNA 结构,生成不同异构体,间接影响加工效率,比如内含子区域的 m6A 修饰,可促进内含子切除,优化 pri - miRNA 结构,助力成熟 miRNA 生成。
MeRIP - Seq 数据分析显示,67% 含 m6A 修饰峰的 mRNA 3'UTR 存在 miRNA 结合位点,且 m6A 修饰峰与 miRNA 结合位点位置邻近却不重叠,生动展现出 m6A 与 miRNA 协同调控 mRNA 稳定性、翻译的互动关系,共同编织复杂且精密的基因表达调控网络。
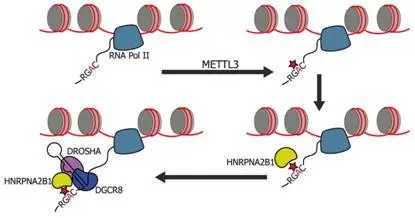
图4 m6A对pri-microRNA剪接的影响
四、展望:解码 “分子密码”,赋能疾病干预
m6A 作为基因表达调控的 “分子密码”,在 RNA 代谢各环节的核心调控作用已逐步明晰,但其深层分子机制仍有诸多未知:m6A 位点识别的精准特异性、不同结合蛋白功能差异、与 m5C、m1A 等其他 RNA 修饰的协同效应,以及疾病状态下 m6A 调控网络的重塑规律。靶向RNA修饰的疾病治疗:调控RNA修饰酶为癌症和神经疾病提供了新的治疗策略和药物靶点。
未来,解码这些科学问题,将为肿瘤、神经疾病等开发 m6A 靶向诊断标志物、治疗药物筑牢根基,推动 RNA 表观遗传学从基础研究加速迈向临床转化,让这一 “分子密码” 真正成为疾病干预的有力 “武器”,为人类健康事业开辟全新治疗维度。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


