引言
蛋白质是细胞功能的核心执行者,其酶促功能(如催化反应)与非酶促功能(如蛋白互作、信号支架作用)共同调控生命活动,二者异常均可能诱发癌症、心血管疾病等重大疾病。传统小分子抑制剂仅能靶向催化结构域阻断酶促活性,却无法干预非酶促功能,导致临床疗效有限、易耐药。而蛋白水解靶向嵌合体(PROTAC)技术通过介导蛋白质降解修饰,直接清除靶蛋白,实现对酶促与非酶促功能的同步阻断,为突破传统调控困境提供了革命性方案。本文将聚焦 PROTAC 的作用机制,结合典型案例解析其在蛋白质功能全维度调控中的核心价值与应用进展。
一、蛋白质功能调控的核心困境:非酶促功能的 “不可靶向性”
1.1 蛋白质的 “功能二元性”:酶促与非酶促功能协同致病
多数功能性蛋白存在 “功能二元性”:酶促功能依赖催化结构域(如激酶磷酸化、甲基转移酶甲基化),非酶促功能则依赖非催化结构域(如 FERM、泛素结合结构域)介导蛋白互作(PPI)或信号支架作用。例如,EZH2(表观遗传调控因子)既通过酶促功能催化 H3K27me3 沉默抑癌基因,又通过非酶促功能结合 cMyc 激活促癌基因;MDM2(E3 连接酶)的非酶促功能 —— 直接结合 p53 抑制其活性,比其酶促降解 p53 的作用更关键。这些案例表明,蛋白质的病理效应常是双功能协同的结果,仅靶向其一无法根治疾病。
1.2 传统抑制剂的局限:陷入 “功能盲区”
传统小分子抑制剂以 “抑制酶促活性” 为核心设计逻辑,存在天然缺陷:一是无法阻断非酶促功能,如 EZH2 抑制剂仅降低 H3K27me3,却不能阻止其与 cMyc 的促癌互作;二是易耐药,靶蛋白突变催化结构域即可逃避抑制,非酶促功能仍持续致病;三是选择性差,催化结构域(如激酶 ATP 口袋)高度保守,易交叉作用于同源蛋白引发毒副作用。因此,亟需能 “全维度调控蛋白质功能” 的新技术。
二、PROTAC:蛋白质降解修饰的核心技术与优势
2.1 作用机制:劫持泛素 - 蛋白酶体系统实现靶向降解
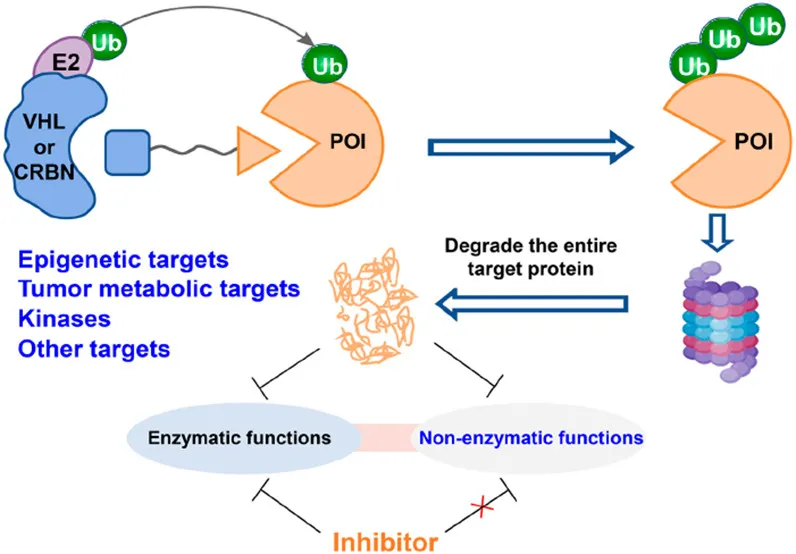
PROTAC 是一种 “分子桥梁”,由三部分构成:靶蛋白(POI)配体(确保靶向性)、E3 泛素连接酶配体(募集泛素酶系)、连接子(调节空间构象)。其作用过程为:进入细胞后,PROTAC 分别结合 POI 与 E3 连接酶,形成 “POI-PROTAC-E3” 三元复合物;E3 连接酶将泛素标记到 POI 上,泛素化的 POI 被蛋白酶体识别降解;PROTAC 释放后可循环使用,实现高效降解修饰。这一过程直接清除靶蛋白,从根源上同步阻断酶促与非酶促功能。
2.2 技术优势:超越传统抑制剂的功能调控维度
相较于抑制剂,PROTAC 的核心优势体现在三方面:一是全功能调控,降解靶蛋白可同时消除酶促活性与非酶促功能,避免 “功能逃逸”;二是高选择性与低耐药,依赖 POI 配体特异性与三元复合物空间匹配,可区分同源蛋白,且无需长期占据催化口袋,降低突变耐药风险;三是催化性作用,单个 PROTAC 可降解多个 POI,理论上剂量更低、效率更高、毒副作用更小。
三、PROTAC 降解修饰的典型应用案例
3.1 表观遗传靶点:破解非酶促转录调控难题
(1)EZH2:同步阻断基因沉默与激活
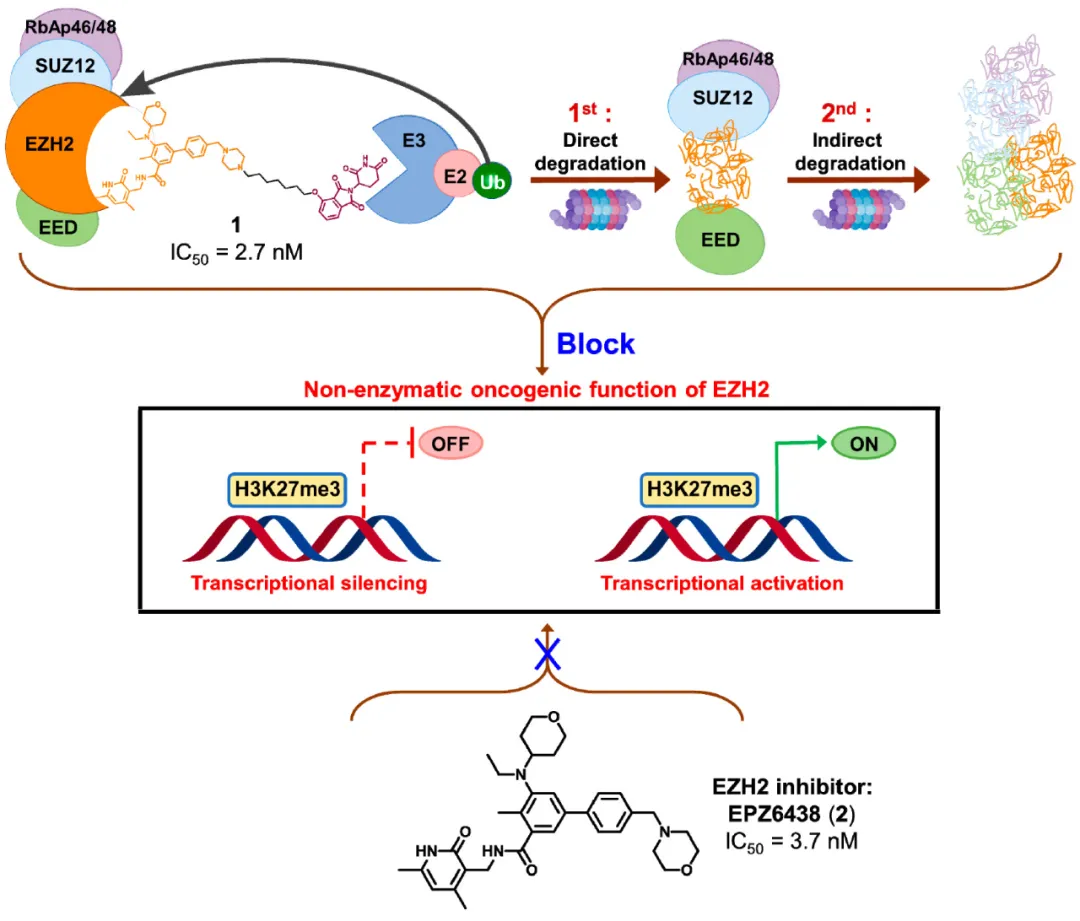
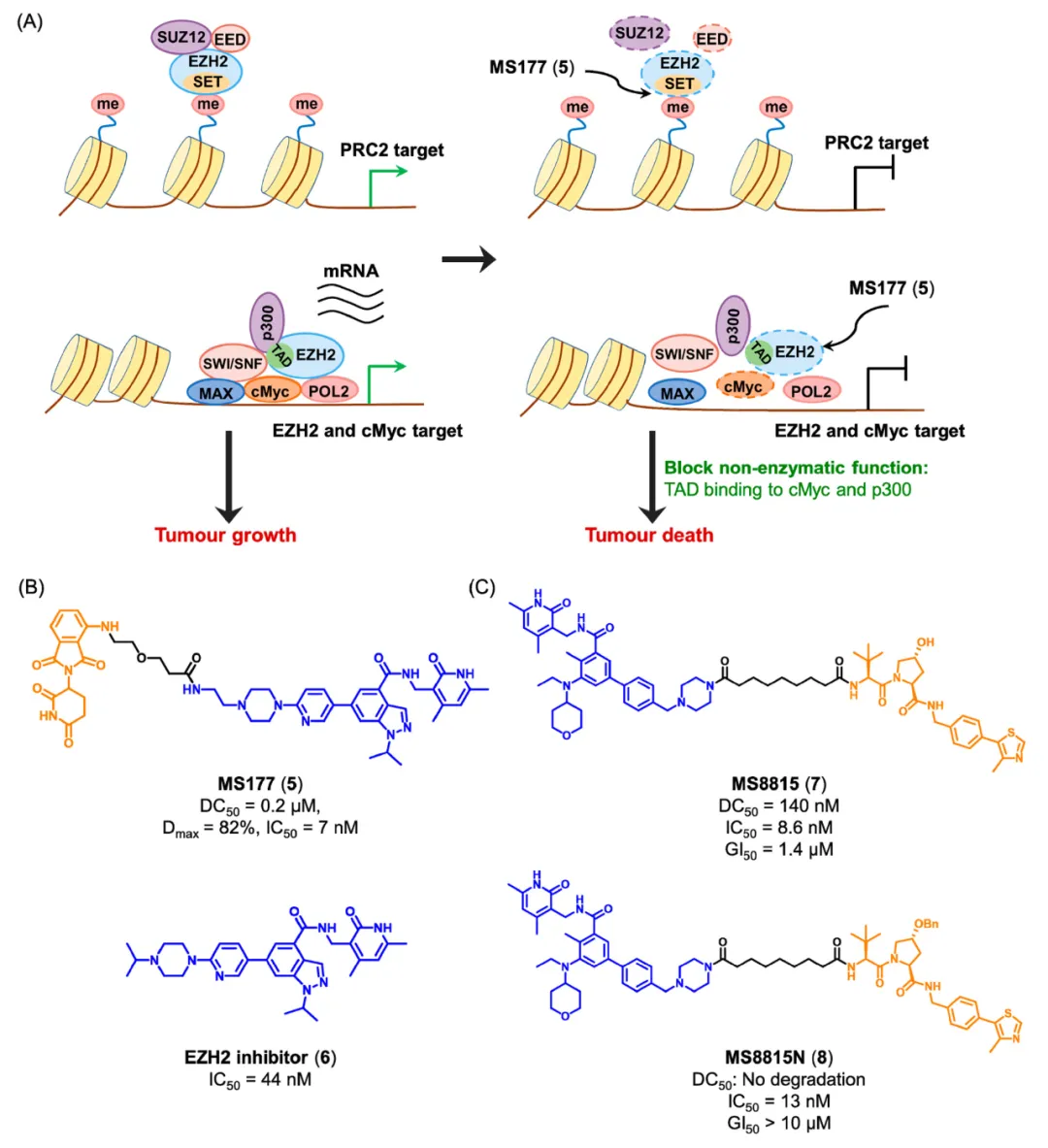
EZH2 是淋巴瘤、乳腺癌的关键靶点,传统抑制剂仅抑制其酶促甲基化功能,无法阻断其与 cMyc 结合的非酶促转录激活。PROTAC 降解剂(如 YM281、MS177)通过将 EZH2 配体与 VHL/CRBN 配体偶联,可高效降解 EZH2,同时诱导 PRC2 复合物其他亚基(EED、SUZ12)降解;不仅降低 H3K27me3 水平(阻断酶促沉默),还消除其与 cMyc 的互作(阻断非酶促激活)。在淋巴瘤模型中,降解剂对抑制剂耐药细胞仍有效,肿瘤抑制率显著高于抑制剂。
(2)HDAC6:干预非酶促炎症调控
HDAC6(组蛋白去乙酰酶)的非酶促功能(通过 UBD 结构域激活 NLRP3 炎症小体)与炎症疾病相关,传统抑制剂无法干预。PROTAC 降解剂(如化合物 9、10)可降解 HDAC6,既抑制其酶促脱乙酰活性,又清除 UBD 介导的非酶促炎症调控;在小鼠模型中,能显著减弱 NLRP3 炎症反应,且无抑制剂的细胞毒性,为自身免疫病治疗提供新方案。
3.2 代谢与激酶靶点:克服耐药与调控免疫
(1)NAMPT:重塑肿瘤免疫微环境
NAMPT(NAD + 合成关键酶)的细胞外形式(eNAMPT)通过非酶促功能促进髓源性抑制细胞(MDSC)扩增,抑制 T 细胞免疫。传统抑制剂仅阻断细胞内 NAMPT(iNAMPT)酶促功能,无法干预 eNAMPT。PROTAC 降解剂可降解 iNAMPT,减少 eNAMPT 分泌,既抑制肿瘤代谢(酶促功能),又阻断 MDSC 免疫抑制(非酶促功能)。在肿瘤小鼠模型中,降解剂激活抗肿瘤免疫,疗效优于抑制剂且毒性更低。
(2)FAK:抑制非酶促肿瘤转移
FAK(粘着斑激酶)的非酶促支架功能(介导细胞粘附迁移)是肿瘤转移的关键,抑制剂无法干预。PROTAC 降解剂(如 GSK215、FC-11)可高效降解 FAK,既抑制其酶促磷酸化活性,又清除其非酶促迁移支架作用。在三阴性乳腺癌模型中,降解剂显著降低细胞迁移侵袭能力,抗转移效果优于临床抑制剂 defactinib。
四、挑战与展望
PROTAC 仍面临挑战:一是选择性风险,部分降解剂可能诱导非靶蛋白降解(如 PRC2 亚基 “多米诺降解”);二是递送效率,分子量大(>700 Da),难以穿透实体瘤或血脑屏障;三是靶点局限,多聚焦于有明确配体的蛋白,无配体靶点(如转录因子)仍难靶向。
未来方向可聚焦三方面:优化连接子与配体提升选择性;结合纳米载体、细胞穿透肽改善递送;借助 AI 与片段筛选拓展靶点范围,开发 “双功能降解剂”(同步降解两个协同致病蛋白),进一步提升调控精准性。
结论
PROTAC 介导的蛋白质降解修饰,通过直接清除靶蛋白,突破了传统抑制剂无法干预非酶促功能的 “盲区”,实现了蛋白质功能的全维度调控。从表观遗传到代谢、激酶靶点,PROTAC 已在多种疾病模型中展现出优于传统药物的疗效,为难治性疾病(如耐药肿瘤、炎症疾病)提供了新策略。尽管仍需解决选择性、递送等问题,但其作为蛋白质功能调控的革命性技术,有望推动药物研发进入 “降解修饰” 新时代。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


