技术简介与基本原理
酶联免疫斑点检测(Enzyme-Linked ImmunoSpot Assay, ELISpot)是一种将体外细胞培养与酶联免疫吸附测定(ELISA)技术相结合的高灵敏度生物分析方法。该技术能够在单细胞水平上对特定细胞因子的分泌进行原位检测与定量分析,其检测灵敏度理论上可达百万分之一,是目前免疫学研究与临床检测中一项重要的功能性分析工具。
从技术名称构成来看,“酶联免疫”反映了其基于酶-底物显色反应进行信号放大的免疫检测原理,与ELISA技术一脉相承;而“斑点”则形象地描述了该技术最终输出的信号形式——即由单个细胞分泌的蛋白分子被固相抗体捕获后,通过酶促显色反应在膜上形成的有色沉淀斑点。每一个斑点代表一个在该位置曾活跃分泌目标蛋白的细胞,通过对斑点的计数即可实现对分泌该因子的细胞频率的定量分析。
与ELISA技术相比,二者虽共享类似的酶联免疫原理,但仍存在显著区别:ELISA主要检测的是溶液样品中已经存在的、处于溶解状态的靶蛋白浓度,其结果表现为整体溶液的颜色变化,通过光度计读取吸光度(OD值)进行定量;而ELISpot检测的是在实验过程中由活细胞新分泌的蛋白,这些蛋白被包被在固相板上的抗体即时捕获,最终形成肉眼或仪器可识别的斑点,从而实现对细胞功能的动态评估。
ELISpot与FluoroSpot的技术进展
传统的ELISpot实验通常针对单一细胞因子进行检测。随着研究需求的日益复杂,科研人员常需在同一实验体系中同时评估多种细胞因子的分泌情况,为此多色荧光斑点技术(FluoroSpot)应运而生。FluoroSpot技术借鉴了流式细胞术中的多色荧光检测策略,使用不同荧光素标记的抗体对多种细胞因子进行同时识别。通过搭配特异性滤光片,可有效区分不同荧光信号,避免光谱重叠带来的串扰问题,从而实现在单个实验孔中同步检测两种或更多种类的细胞因子。目前,已有供应商如MabTech开发出可同时检测四种不同指标的多色FluoroSpot试剂盒,极大提升了实验效率与数据丰富度。
技术流程概述
标准的ELISpot实验通常需历时三天完成,其基本流程如下:
第一天:抗体包被
使用Coating Buffer预先润湿PVDF膜孔板,去除残余液体后,加入经过优化的捕获抗体溶液,于4°C条件下孵育过夜,使抗体充分吸附于膜表面。
第二天:封闭与细胞铺板
移除包被抗体溶液,使用缓冲液洗涤板孔以去除未结合抗体,随后加入封闭液(如含血清的培养基或蛋白溶液),室温孵育1小时,以阻断膜上非特异性结合位点。
在封闭期间,准备待测细胞悬液,调整细胞密度至适宜浓度(通常根据预实验确定)。细胞接种时需设置包括实验孔、阳性刺激对照孔、阴性对照孔及背景对照孔在内的多种平行条件,以确保实验结果的可靠性与可解释性。铺板完成后,将培养板置于37°C、5% CO₂培养箱中孵育一定时间(通常为16–24小时),使细胞在刺激物存在下分泌目标因子。
第三天:显色与检测
小心移除孔内细胞及培养液,随后使用冰冷的去离子水在4°C下裂解残留细胞,以便更好地暴露已被捕获的细胞因子。经洗涤后,依次加入生物素化检测抗体、酶标记亲和素(如辣根过氧化物酶或碱性磷酸酶标记链霉亲和素)进行孵育,每一步之后均需充分洗涤。最后加入相应的显色底物(如BCIP/NBT或AEC),避光条件下进行显色反应。待斑点发育至合适大小后终止反应,洗去残余底物。将板晾干后,使用专用ELISpot读板系统进行图像采集与斑点计数分析。
一般来说,ELISpot实验中的质量好的斑点会呈现出明显的晕-核结构,如下图。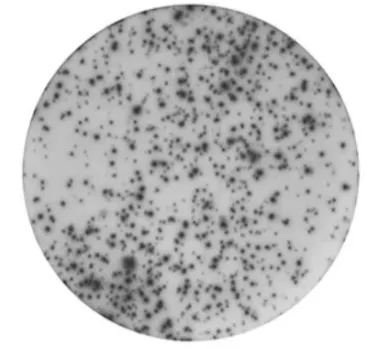
实验结果判读与常见问题分析
理想状态下,ELISpot实验产生的斑点应具有清晰的“晕—核”结构,中心着色深、边缘渐浅,提示其为单个细胞分泌所形成的典型形态。然而实际实验中常会因各种因素导致非理想结果的出现,例如:
背景过高或无信号;
斑点数量过少或过多;
斑点形态不规则、拉丝或聚集呈团;
整个膜面斑点分布严重不均。
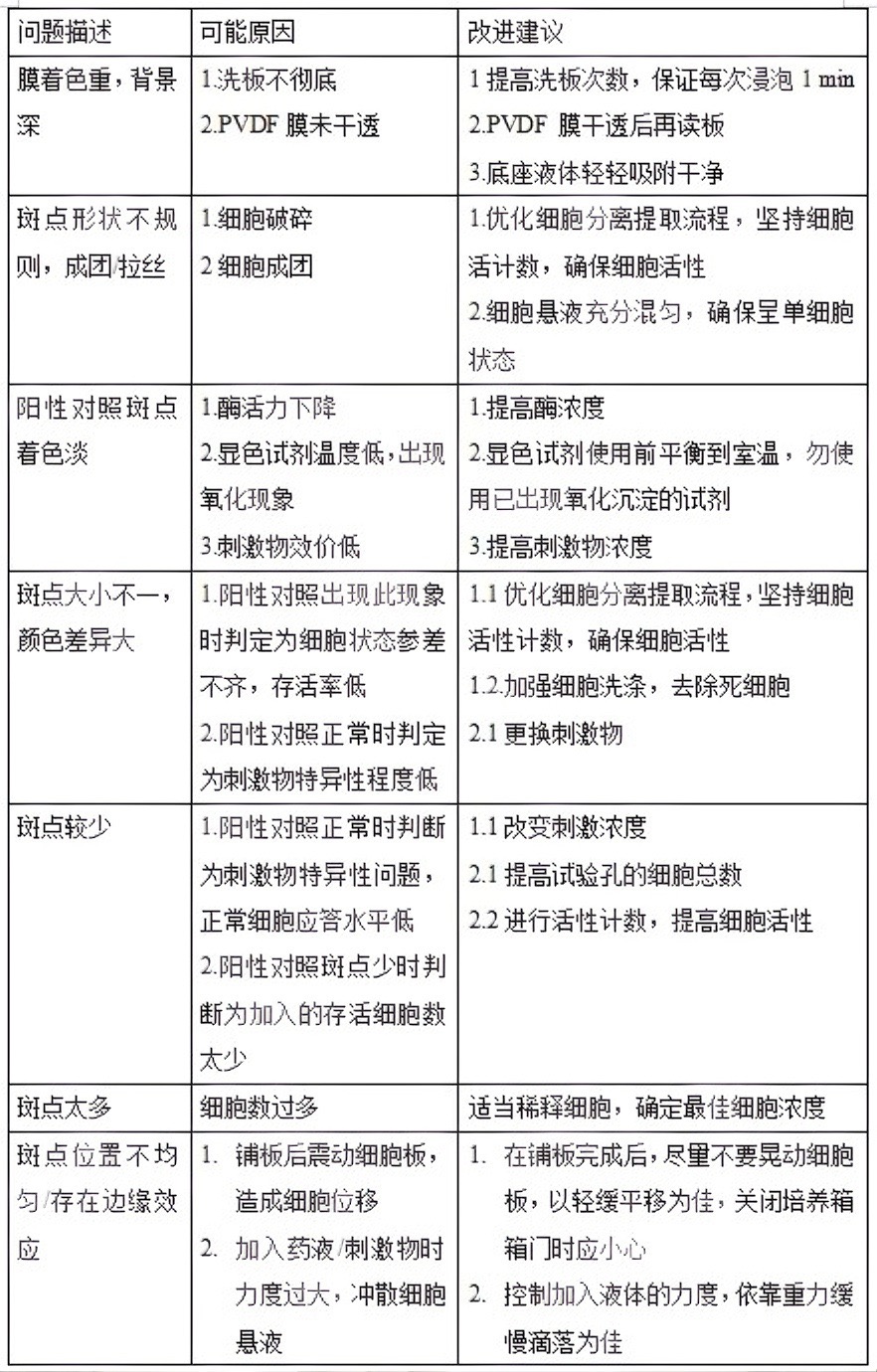
这些现象可能源于抗体质量、细胞状态、试剂污染、操作不当或培养条件不适等多种因素,需结合具体实验条件系统排查。下表整理了实验中常见的问题及可能的原因。
细胞静息处理的重要性
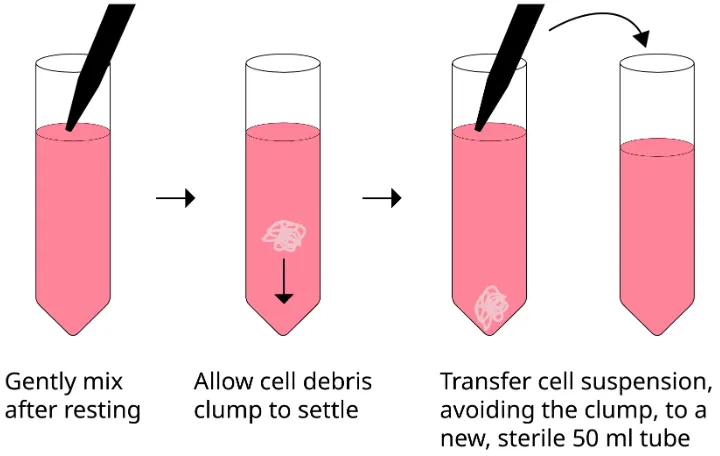
除常见的实验操作要素外,细胞本身的活化状态对ELISpot结果影响显著,却易被忽略。由于该技术灵敏度极高,即使是极低水平的自发分泌也可能导致背景升高或假阳性结果。细胞在分离或冻存复苏过程中可能因机械刺激、温度变化或凋亡等产生预激活或功能损伤,因此,在正式实验前对细胞进行静息处理(resting)尤为关键。
静息处理指的是将分离或复苏后的细胞在完全培养基中于37°C、5% CO₂条件下静置培养一段时间(通常为1小时至过夜),使其脱离外界刺激、恢复稳态。这一步骤不仅可降低因操作引起的自发分泌,还能清除部分细胞碎片和死细胞,从而显著改善信噪比,提升检测的准确性与可重复性。具体操作方法包括:洗涤细胞后重悬于适量培养基中,置于离心管(如15 mL或50 mL锥形管)内,稍拧松管盖以利于气体交换,放入培养箱静置。静息结束后轻柔重悬、再次洗涤并计数,调整细胞活性及密度后即可用于正式实验。
应用实例与文献支持
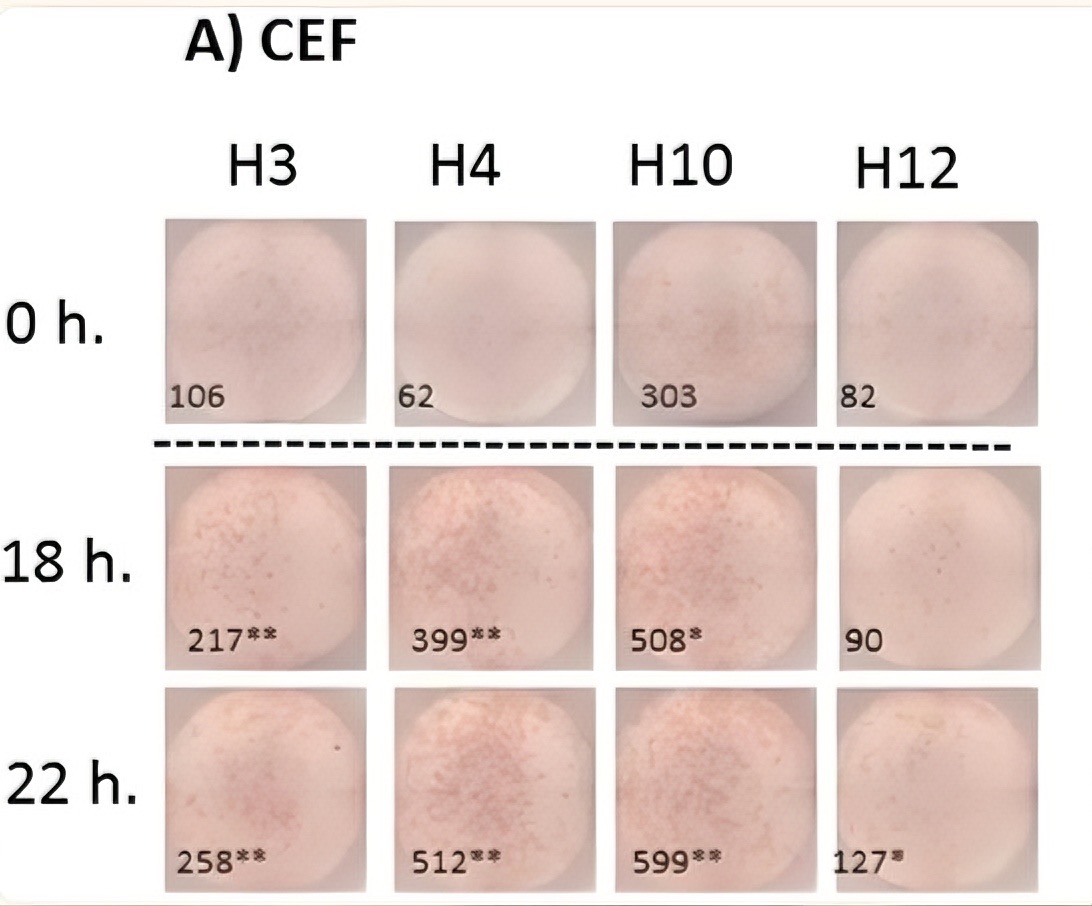
在一项针对冻存人外周血单个核细胞(PBMC)的ELISpot条件优化研究中,研究者比较了不同静息时间(0h、18h及22h)对细胞功能恢复的影响。结果发现,未经静息的细胞对CEF肽库刺激的应答较弱,IFN-γ斑点数量较少;而经18小时或22小时静息处理的PBMC,其特异性应答能力显著增强,斑点数量明显增多,且形态更为清晰典型。该结果表明,适当的静息处理有助于细胞恢复正常的生理状态和反应能力,从而提高实验的成功率和数据的可靠性。
技术应用领域
凭借其高灵敏度、单细胞水平检测及可定量等优势,ELISpot技术已被广泛应用于多个生物医学领域,包括但不限于:
疫苗研发:评价疫苗诱导的细胞免疫应答;
细胞治疗与基因治疗:评估效应细胞的功能活性及免疫稳定性;
临床免疫学诊断:检测感染性疾病、自身免疫病及免疫缺陷病中的特异性T细胞反应;
肿瘤免疫:监测肿瘤抗原特异性T细胞应答,评估免疫治疗疗效;
生物工程与药物开发:作为功能性体外测定平台,用于免疫调节药物的筛选与评价。
综上所述,ELISpot技术是一种极为强大的免疫学工具,不仅能够揭示细胞分泌功能的细微变化,还在多种科研与临床场景中发挥着不可替代的作用。通过规范操作流程、重视细胞状态控制并结合多色荧光升级技术,研究者能够更全面、准确地捕捉免疫应答的动态细节,为深入理解免疫机理与推进临床应用提供坚实的数据支持。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


