一、技术概述与基本原理
酶联免疫吸附测定(Enzyme-Linked Immunosorbent Assay, ELISA)是一种将可溶性抗原或抗体固定于固相载体表面,利用其特异性结合反应,并通过酶标记物催化底物显色进行定性或定量分析的高灵敏度检测技术。
其核心原理基于三个关键步骤:
固相包被:使抗原或抗体牢固吸附于固相载体(如聚苯乙烯微孔板),并保持其免疫活性。
酶标记与特异性结合:使抗原或抗体与特定的酶(如辣根过氧化物酶HRP、碱性磷酸酶AP)共价连接,形成酶标结合物。该结合物既能与相应的抗体或抗原发生免疫反应,又保留酶的催化活性。
显色与定量:在反应体系中,结合在固相上的酶量与样本中待测物含量成比例。加入酶底物后,底物被催化生成有色产物,通过测定吸光度值即可实现对目标物的精确定量。酶的高效催化作用可极大放大信号,使该方法具备极高的检测灵敏度。
二、ELISA主要类型及其方法学特点
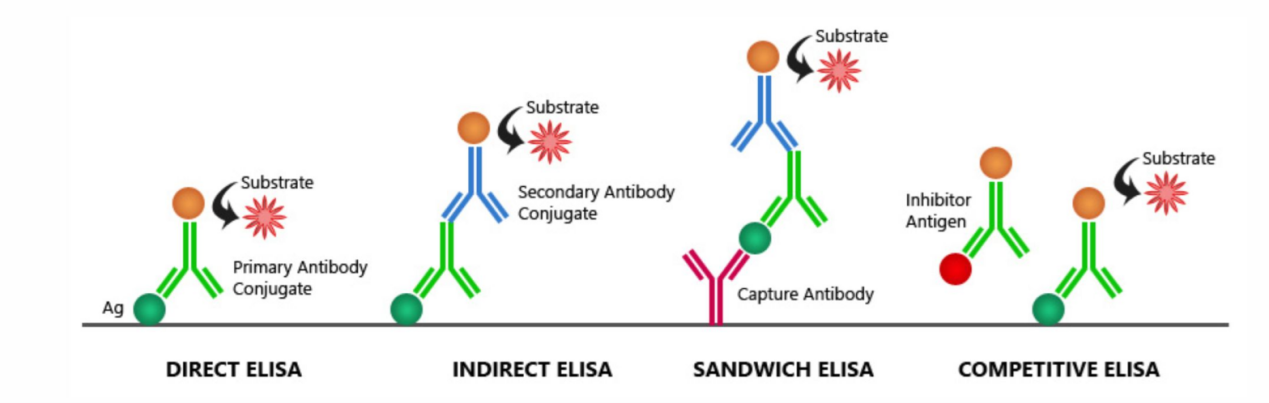
根据实验设计,ELISA可分为以下几种主要类型:
1、直接法
流程:将抗原固定于固相载体,直接加入酶标一抗进行检测。
优点:操作步骤少,耗时短,避免了二抗可能引起的交叉反应。
缺点:信号无放大作用导致灵敏度较低;每种待测物均需制备特异性酶标抗体,灵活性差;易因非特异性吸附导致背景较高。
2、间接法
流程:将抗原固定于固相载体,依次加入非酶标一抗和酶标二抗进行检测。
优点:通过二抗放大信号,灵敏度显著高于直接法;一种酶标二抗可适用于多种同种属来源的一抗,经济且灵活。
缺点:实验步骤增多,周期延长;二抗可能与固相抗原发生非特异性结合,潜在交叉反应风险。
3、双抗体夹心法
流程:使用两种分别针对目标抗原不同表位的抗体,一种作为“捕获抗体”包被固相,另一种作为“检测抗体”进行检测(可直接酶标记或通过酶标二间接检测)。
优点:适用于多表位抗原检测,具有极高的特异性和灵敏度,是应用最广泛的ELISA形式。
缺点:要求两种抗体不存在交叉反应,且不竞争同一结合位点,对抗体配对要求高。
4、竞争法
流程:样本中的待测抗原(或抗体)与已知量的酶标抗原(或抗体)竞争结合有限量的固相抗体(或抗原)。显色强度与待测物浓度成反比。
优点:适用于小分子抗原或半抗原的检测,对样本纯度要求相对较低,数据再现性好。
缺点:操作相对复杂,灵敏度和特异性通常低于夹心法。
三、核心实验材料与试剂
1、抗原与抗体
抗原:包括天然提纯抗原、重组抗原和合成多肽抗原。要求纯度高、免疫原性好。
抗体:可采用多克隆抗体或单克隆抗体。用于包被或标记的抗体需具备高纯度、高效价和高亲和力。
2、固相载体
最常用聚苯乙烯或聚氯乙烯制成的96孔板。要求吸附性能均一、空白值低、透光性好。使用前需进行性能校验。
3、酶与底物系统
辣根过氧化物酶(HRP):最常用。常用底物包括OPD(灵敏度高,有潜在致癌性)、TMB(无致癌性,应用广泛)和ABTS(空白值低)。
碱性磷酸酶(AP):常用底物为p-NPP。其灵敏度可能高于HRP系统,但制备成本较高,稳定性略差。
选择依据:酶的催化效率、底物特性、安全性及成本。
4、酶标结合物的制备
常用方法包括戊二醛交联法(一步法或二步法)和过碘酸钠氧化法(主要用于HRP)。制备的结合物需纯化以去除未结合的酶和抗体,减少背景干扰。
5、包被与封闭
包被:将抗原或抗体吸附于固相载体,通常使用pH 9.6的碳酸盐缓冲液,4℃过夜孵育。
封闭:使用1%-5%牛血清白蛋白(BSA)或其它惰性蛋白质溶液封闭未被占据的固相表面,以防止后续步骤的非特异性吸附,降低本底。
四、样本的采集、处理与保存
1、常见样本类型:血清、血浆、细胞培养上清、尿液、脑脊液、组织匀浆液等。
2、采集与预处理:
血清/血浆:避免溶血,充分离心去除纤维蛋白原或细胞成分。
细胞培养上清:离心去除细胞及碎片。
组织样本:迅速匀浆,离心后取上清检测。
尿液:使用无菌容器,新鲜采集并及时检测或保存。
3、保存原则:
短期(数日内)可于2-8℃保存。
长期需分装后于-20℃或-80℃冻存,并避免反复冻融,以防靶蛋白降解或效价降低。
所有样本在检测前应确保澄清、无沉淀。
五、双抗体夹心法ELISA标准操作流程
以双抗体夹心法为例,其典型步骤如下:
1、包被:将捕获抗体稀释于包被缓冲液中,加入微孔板,4℃过夜孵育。
2、洗涤:弃去孔内液体,使用含吐温-20的PBS缓冲液(PBST)填充各孔,静置后弃去,重复3-5次,以去除未结合物质。
3、封闭:加入封闭液(如5% BSA),37℃孵育1-2小时,随后再次洗涤。
4、加样与孵育:加入标准品或待测样本,37℃孵育一定时间,使抗原与捕获抗体充分结合,随后洗涤。
5、加检测抗体:加入酶标记的检测抗体(或先加未标记检测抗体,再加酶标二抗),37℃孵育,洗涤。
6、加底物显色:加入酶促反应底物溶液,避光反应一定时间。
7、终止反应与检测:加入终止液(如硫酸)终止反应,立即于特定波长下(如TMB为450nm)测定各孔吸光度(OD值)。
8、数据分析:绘制标准曲线,计算样本中待测物浓度。
六、常见问题分析与解决方案
| 问题现象 | 潜在原因 | 解决方案 |
|---|---|---|
| 背景信号过高 | 封闭不充分 | 优化封闭液种类、浓度及封闭时间。 |
| 洗涤不彻底 | 确保洗涤液配方正确,增加洗涤次数与浸泡时间。检查洗板机性能。 | |
| 酶结合物浓度过高 | 进行梯度稀释,确定最佳工作浓度。 | |
| 底物被污染或曝光 | 底物避光保存,现用现配。 | |
| 样本或试剂交叉污染 | 使用新吸头,加样时避免溅出。 | |
| 标准曲线良好,样本无信号 | 样本中无目标物或含量过低 | 设置阳性对照,确认样本中目标物预期含量。 |
| 样本中存在基质干扰 | 对样本进行适当稀释或透析处理。 | |
| 高剂量Hook效应 | 对样本进行系列稀释后复测。 | |
| 重复性差 | 加样操作误差 | 校准移液器,确保加样准确。 |
| 试剂未充分混匀 | 使用前涡旋振荡或颠倒混匀所有液体试剂。 | |
| 孵育温度或时间不一致 | 使用稳定的孵育箱,避免叠放板条。 | |
| 微孔板内有气泡 | 加样后检查并挑破气泡。 | |
| 假阳性结果 | 非特异性交叉反应 | 验证抗体特异性,优化抗体浓度。 |
| 洗涤不充分(残留未结合物) | 严格执行洗涤程序。 | |
| 样本中含有内源性过氧化物酶(如溶血) | 在HRP系统中,可加入过氧化氢酶抑制剂或选用AP系统。 |
七、试剂盒选择要点
-
特异性:优选采用经严格验证的、高特异性的抗体对(尤其是双单抗配对)。
-
灵敏度:根据样本中待测物的预估浓度范围,选择检测下限合适的试剂盒。
-
重复性:评估试剂盒的板内与板间变异系数(CV),通常应小于15%。
-
简便性与通量:考虑操作步骤的繁简、孵育时间长短以及是否适用于自动化平台。
八、ELISA技术相关技术服务哪里有?
乐备实(LabEx)提供ELISA技术相关技术服务
| 技术名称 | 技术类型 | 技术优势 | 检测原理 | 应用领域 |
|---|---|---|---|---|
| 酶联免疫吸附(ELISA) | 1. 双抗体夹心法(检测大分子抗原); 2. 间接法(检测特异性抗体) | 1. 高特异性:依赖抗原 - 抗体特异性结合,交叉反应低; 2. 高灵敏度:酶催化底物放大信号,可检测低浓度目标分子; 3. 操作简便:实验流程标准化,无需复杂仪器; 4. 成本可控:试剂耗材易获取,适合批量检测; 5. 结果稳定:重复性好,定量结果准确可靠 | 1. 双抗体夹心法:包被抗体结合样本中抗原→加入检测抗体形成复合物→酶标试剂结合检测抗体→底物显色,吸光度与抗原浓度正相关; 2. 间接法:包被抗原结合样本中抗体→加入酶标二抗结合目标抗体→底物显色,吸光度与抗体浓度正相关 | 1. 基础科研:蛋白表达定量、抗体水平检测、病原体筛查; 2. 临床相关研究:疾病标志物检测、诊断辅助、疗效评估; 3. 药物研发:药物靶点检测、药物浓度监测、免疫原性分析; 4. 疫苗研究:抗体产生水平评价、免疫效果评估; 5. 食品安全、环境监测等其他领域 |
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、PLA蛋白互作、多色免疫组化、DSP空间多组学等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


