一、ADC药物发展面临哪些关键技术挑战?
抗体药物偶联物(ADC)作为靶向治疗的重要代表,其发展历程经历了从随机偶联到定点偶联的技术革新。早期ADC药物存在诸多局限性:首先,传统非定点偶联导致药物抗体比率(DAR)呈现异质性分布,其中低DAR组分疗效不足,而高DAR组分则易被快速清除;其次,抗原表达异质性、内化效率差异以及溶酶体降解缺陷等因素均会影响有效载荷的释放效率;此外,ADC的较大分子量(约150kDa)限制了其在实体瘤组织中的渗透和分布。
这些技术瓶颈促使研究人员从多个维度进行创新:一是开发位点特异性偶联技术以提高产品均一性;二是优化抗体骨架以改善肿瘤渗透性;三是开发新型有效载荷以克服耐药机制;四是设计智能释放系统以适应肿瘤微环境特性。这些技术突破共同推动了第三代ADC药物的诞生和发展。
二、位点特异性偶联技术如何提升ADC药物质量?
位点特异性偶联技术是第三代ADC的核心特征之一,主要通过三种策略实现:
基于工程化氨基酸的偶联技术通过在抗体特定位点引入非天然氨基酸或半胱氨酸残基,实现精准可控的偶联。例如,在抗体重链第265位或第239位引入特定突变,可与连接子实现定点偶联。研究表明,这种定点偶联得到的ADC与传统随机偶联ADC相比,在保持相似疗效的同时,显著改善了药代动力学特性,降低了系统毒性。
酶介导的偶联技术利用转谷氨酰胺酶等特异性酶催化反应,实现对抗体特定谷氨酰胺残基的修饰。该方法可通过三步法工艺获得均一的ADC产品,且不影响抗体的抗原结合能力。这种生物催化 approach 为ADC的规模化生产提供了新的技术路径。
基于新型连接化学的偶联策略采用二溴甲基酰胺或二噻吩基马来酰亚胺等异质双功能连接体,可直接从天然抗体产生DAR为4的均质ADC。这些创新化学方法不仅提高了产品均一性,还增强了ADC在血浆中的稳定性。
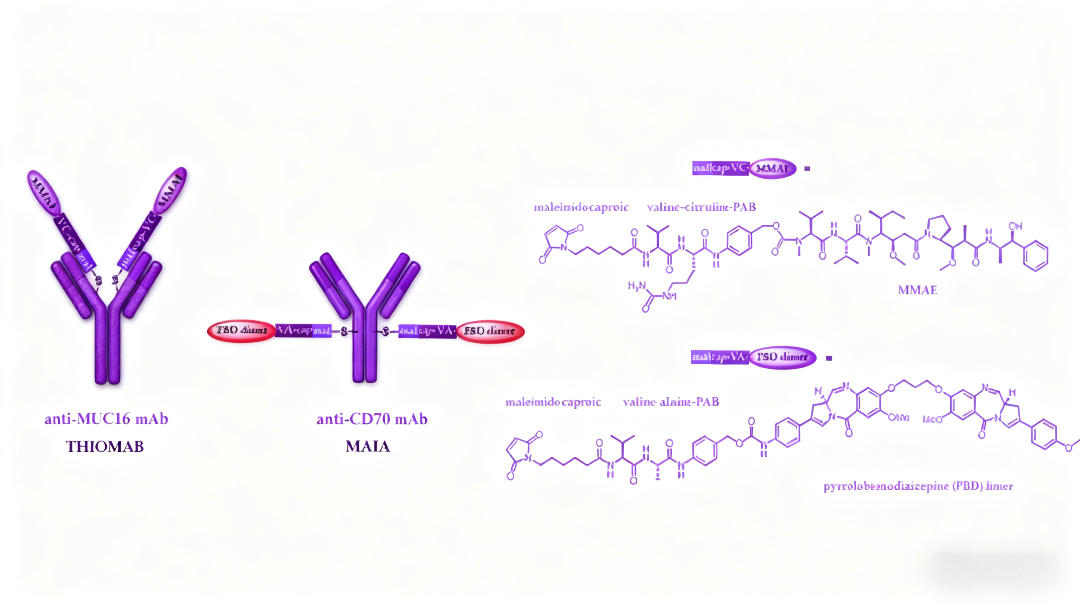
三、新型有效载荷如何拓展ADC的治疗潜力?
第三代ADC在有效载荷方面的创新主要体现在以下几个方面:
PBD二聚体作为高效DNA损伤剂,其分子结构包含两个烷基化亚胺官能团,能够与DNA形成不可逆交联,效力比传统微管蛋白抑制剂高50-100倍。尽管早期基于PBD的ADC(如vadastuximab talirine)因安全性问题在临床试验中受挫,但优化后的tesirine衍生物在loncastuximab tesirine等ADC中展现出更好的治疗窗口。
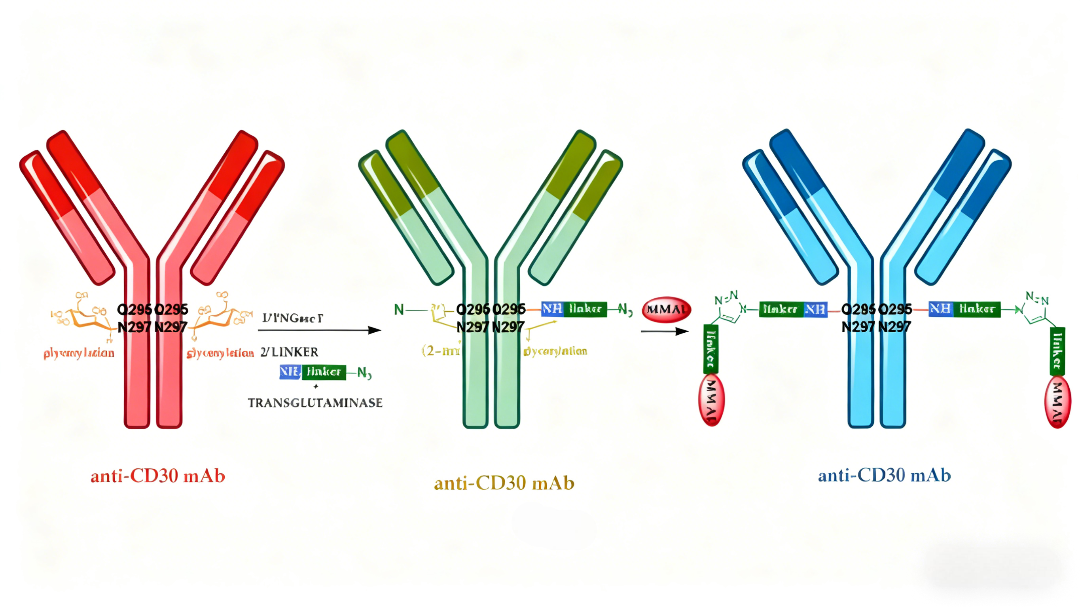
四、创新抗体形式如何优化ADC药物特性?
为克服IgG骨架在实体瘤治疗中的局限性,研究人员开发了多种小型化结合形式:
单链抗体片段(scFv)与auristatin衍生物的定点偶联产生了单链抗体药物偶联物(SDC)。尽管DAR仅为1,但抗HER2 SDC在体外对SK-BR-3细胞显示出纳摩尔级的杀伤效力(EC50分别为0.68nM和0.32nM),且对HER2阴性细胞无影响,证明了小型化结合物的靶向特异性。
双特异性ADC通过同时靶向HER2的不同表位,增强了对低HER2表达癌细胞的结合和内化。例如,IMMU-4276在代表不同患者亚群的各种肿瘤模型中显示出优于T-DM1的抗肿瘤活性。通过引入L234F和S239C突变减少FcγR结合,进一步降低了血小板减少等副作用风险。
小免疫蛋白(SIP)形式将单链抗体片段与人IgE εCH4结构域融合,在C末端引入两个未配对半胱氨酸残基,实现DM1的区域特异性偶联。在F9畸胎瘤模型中,SIP(F8)-SS-DM1在等摩尔剂量下比IgG类似物显示出更优的疗效,使80%的小鼠达到完全缓解。
五、智能释放系统如何提升ADC的治疗指数?
第三代ADC在释放系统方面的创新主要体现在对肿瘤微环境的精准响应:
基于细胞外蛋白酶的释放系统针对实体瘤中难以内化抗原的挑战,利用肿瘤微环境中的特异性蛋白酶实现细胞外药物释放。这种策略使ADC不再依赖于肿瘤细胞的内化过程,有效克服了某些耐药机制。
pH敏感释放系统利用肿瘤组织特有的酸性微环境,通过腙键等酸敏感化学键实现选择性药物释放。这类系统可显著降低正常组织中的脱靶毒性,提高治疗窗口。
可还原二硫键连接子通过响应肿瘤细胞内高浓度谷胱甘肽实现特异性释放。例如,SIP(F8)-SS-DM1中的二硫键连接子显示出优于传统连接子的释放动力学特性,在体内表现出更优的疗效。
六、第三代ADC的成功案例提供了哪些启示?
Enhertu(DS-8201)的成功代表了第三代ADC的多个技术突破:采用新型拓扑异构酶I抑制剂DXd(exatecan衍生物),效力比SN-38高10倍;通过可裂解四肽连接子实现高达7.7的DAR,且不影响药代动力学;优化的连接子化学使DXd具有适度的膜渗透性,产生"旁观者效应"却不引起显著靶外毒性。这些特性使Enhertu在HER2低表达肿瘤中仍保持显著疗效。
Trodelvy(sacituzumab govitecan)的创新体现在三重突破:靶向TROP-2这一在多种上皮癌中广泛表达的靶点;采用具有短PEG单元的CL2A连接子,实现高达7.6的DAR;使用SN-38这一相对温和的有效载荷。这些特性使其在难治性三阴性乳腺癌中显示出显著疗效,重新定义了ADC的DAR最佳值概念。
七、ADC药物的毒性管理策略如何优化?
第三代ADC在毒性管理方面取得了显著进步:
通过位点特异性偶联技术改善产品均一性,避免了高DAR组分的快速清除和低DAR组分的竞争性抑制,从而优化了治疗指数。例如,Enhertu即使DAR高达7.7,仍在临床前模型中显示出良好的耐受性。
连接子技术的创新有效降低了脱靶毒性。DXd和SN-38等有效载荷的短半衰期特性,结合优化的释放动力学,显著减少了正常组织暴露。
靶点选择和组织特异性表达的深入研究帮助预测和管理特定毒性。例如,通过突变Fc区域减少FcγR结合,可降低血小板减少和肝毒性风险。
这些技术进步使得第三代ADC在保持高效抗肿瘤活性的同时,显著改善了安全性特征,为临床应用提供了更广阔的空间。随着技术的不断成熟,ADC药物有望在更多难治性肿瘤中发挥重要作用。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


