2012 年 Dixon 团队首次明确铁死亡的核心定义:一种铁离子依赖性的非凋亡性调节性细胞坏死。其核心机制为铁离子与活性氧协同诱导脂质过氧化,最终导致细胞死亡,且在形态学、生物学特征及基因调控层面,均与凋亡、坏死、自噬等传统细胞死亡形式存在显著差异。值得注意的是,铁死亡可被特异性小分子抑制剂(如 Fer-1)有效阻断,而传统坏死抑制剂对此类调节性细胞死亡无抑制作用。
一、形态学变化:
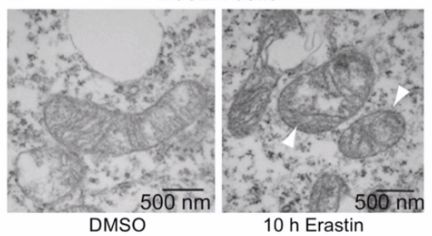
铁死亡的核心特征及本质:
1、超微形态学特征:电镜下可观察到铁死亡细胞的典型形态改变:细胞膜出现断裂与出泡;线粒体呈现体积缩小、膜密度增高、嵴结构减少或消失、外膜断裂等特征;细胞核大小维持正常,且无染色质凝聚现象。其中,线粒体体积缩小与双层膜密度增高是铁死亡较为特异的形态标识。
2、生物学特征:铁死亡的核心生物学表现为细胞内铁离子与活性氧(ROS)大量聚集,进而激活丝裂原活化蛋白激酶(MAPK)信号系统。其关键调控环节包括:抑制胱氨酸-谷氨酸交换体(system Xc⁻)降低胱氨酸摄取,导致谷胱甘肽(GPX4的关键底物)耗竭;同时升高还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶活性,促进ROS生成;此外还会释放花生四烯酸等炎症相关介质,放大死亡信号。
3、免疫学特征:铁死亡过程中会激活损伤相关分子模式(DAMPs)信号通路,释放高迁移率族蛋白B1(HMGB1)等前炎症介质,启动局部炎症反应,这也是铁死亡区别于其他细胞死亡方式的免疫特征之一。
4、基因调控特征:铁死亡的发生受多类基因严密调控,核心调控基因包括:核糖体蛋白L8(RPL8)、铁反应元件结合蛋白2(IREB2)、ATP合成酶F0复合体亚基C3(ATP5G3)、三四肽重复结构域35(TTC35)、柠檬酸合成酶(CS)、酰基辅酶A合成酶家族成员2(ACSF2);同时,铁代谢与储存相关基因(TFRC、ISCU、FTH1、FTL、SLC11A2)也通过调控铁稳态参与铁死亡进程。
铁死亡的本质:铁死亡的本质是细胞内脂质氧化物代谢障碍:在铁离子催化作用下,脂质氧化物发生异常累积,打破细胞内氧化还原平衡,通过攻击细胞膜脂质、蛋白质、核酸等生物大分子,最终触发细胞死亡。
二、信号通路:
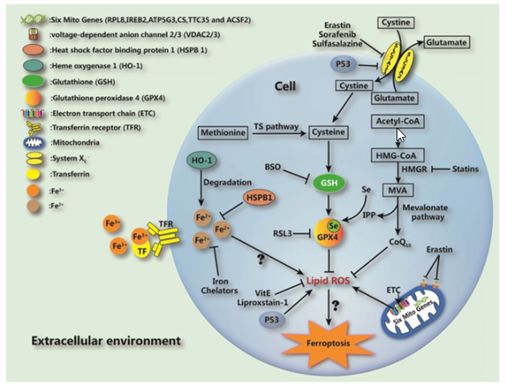
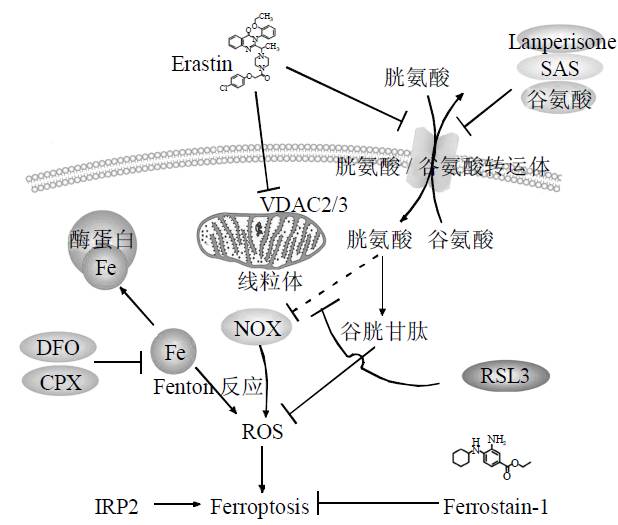
铁死亡的发生受细胞内多重信号通路严密调控,核心包括铁稳态调节通路、RAS 信号通路及胱氨酸转运通路。其核心机制在于膜脂修复关键酶 —— 谷胱甘肽过氧化物酶(GPX4)功能失效,导致膜脂活性氧自由基(ROS)异常累积,而这一过程需铁离子全程参与。
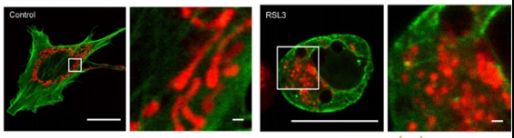
多种小分子物质与外界条件可诱导铁死亡发生:小分子化合物 erastin 通过抑制质膜上的胱氨酸 - 谷氨酸交换体(system Xc⁻),减少细胞对胱氨酸的摄取,进而阻碍 GPX4 的底物 —— 谷胱甘肽(GSH)的合成,最终引发膜脂 ROS 蓄积并触发铁死亡;另一种小分子 RSL3 则直接靶向抑制 GPX4 活性,同样可诱导铁死亡。此外,GPX4 基因敲除小鼠会因肾衰竭死亡,进一步证实 GPX4 在维持细胞存活、抑制铁死亡中的关键作用。
(1)细胞活性检测:采用 CCK-8 法,可快速定量评估铁死亡过程中细胞的存活状态;
(2)细胞内铁水平检测:借助 PGSK 探针(细胞膜透性染料),通过流式细胞术或共聚焦显微镜进行活细胞实时监测,铁死亡细胞中 PGSK 的绿色荧光信号会显著减弱;
(3)活性氧(ROS)水平检测:利用 C11-BODIPY 探针检测,该探针在铁死亡细胞内会发生荧光颜色转变,由红色特异性转化为绿色,直观反映 ROS 累积情况;
(4)关键分子表达检测:通过 QPCR(核酸水平)或 Western Blot(蛋白水平),检测铁死亡相关特征因子的表达变化 ——COX-2、ACSL4、PTGS2、NOX1 等因子表达上调,GPX4、FTH1 等因子表达下调。
(1)细胞超微形态观察:通过透射电镜直接观察,铁死亡细胞典型特征为线粒体体积缩小、线粒体膜密度增高;
(2)线粒体膜电位检测:采用 TMRE 染色,通过流式细胞仪收集并分析 TMRE 阳性细胞比例,反映线粒体膜电位变化;
(3)线粒体形态动态观察:向细胞内转染 LifeAct-GFP 荧光蛋白,结合有丝分裂追踪器,实时观察铁死亡过程中线粒体的形态演变
四、研究进展:
1、细胞铁死亡与肿瘤的关联研究
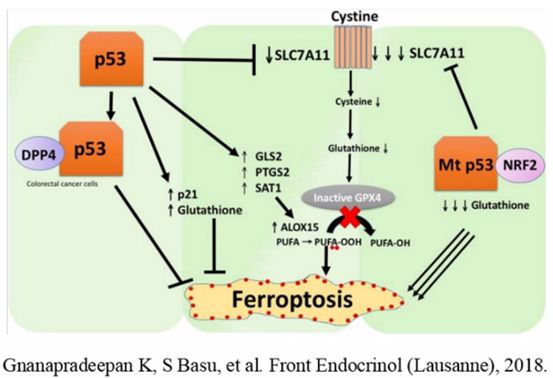
研究表明,不同肿瘤对铁死亡的敏感性存在显著差异,其中肾癌、白血病对铁死亡的敏感性显著高于肺癌、结肠癌等实体瘤。 p53作为经典抑癌基因,以往研究多聚焦其通过诱导细胞衰老、程序性凋亡抑制肿瘤的核心作用;而近年研究揭示,p53在调控细胞代谢及铁死亡过程中同样扮演关键角色:在正常细胞中,p53可负向调控脂质合成与糖酵解通路,同时正向调控氧化磷酸化及脂质分解代谢,这种代谢调控模式使其倾向于正向诱导铁死亡;而肿瘤细胞中常见的突变型p53则呈现功能逆转,通过正向调控脂质合成与糖酵解,显著增强肿瘤细胞对铁死亡的敏感性。这一发现为靶向铁死亡的肿瘤治疗提供了重要理论支撑,尤其为携带p53突变的肿瘤治疗开辟了新方向。
2、细胞铁死亡与脑卒中的关联研究
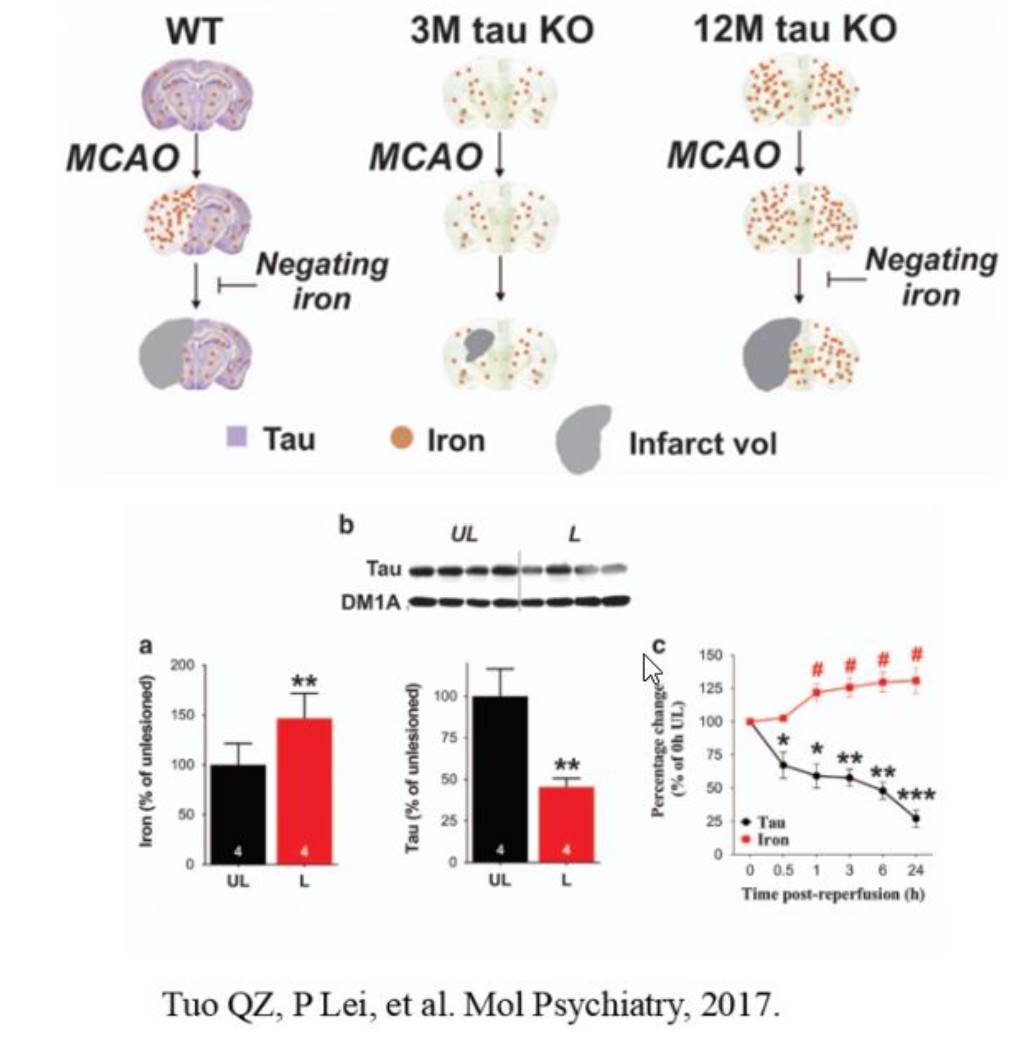
在缺血性脑卒中的病理进程中,Tau蛋白功能失调被证实与年龄依赖性铁介导的神经毒性密切相关。研究发现,大脑中动脉阻塞(MCAO)模型可显著抑制3月龄小鼠脑半球的Tau蛋白功能,并导致脑内铁离子水平异常升高;而在野生型小鼠中,通过铁螯合剂干预可有效阻断铁离子升高,提示Tau蛋白可能通过调控铁稳态发挥抑制铁死亡的保护作用。 进一步研究显示,12月龄Tau基因敲除小鼠中出现了明显的年龄依赖性铁积累,这一现象直接抵消了Tau敲除本身对MCAO诱导的局灶性脑缺血再灌注损伤的保护效应,从正反两方面证实了Tau蛋白通过调控铁死亡通路参与缺血性脑卒中病理机制的核心作用。
3、细胞铁死亡与肝脏损伤的关联研究
该研究通过构建多种基因敲除小鼠模型,首次明确证实:高铁状态及遗传性血色病引发的铁过载,可特异性诱导肝脏组织(含肝细胞与巨噬细胞)发生铁死亡。同时,研究还揭示了转运蛋白Slc7a11调控铁死亡的全新分子机制,为肝脏损伤、遗传性血色病等重大疾病的防治提供了创新性理论依据与潜在干预靶点。
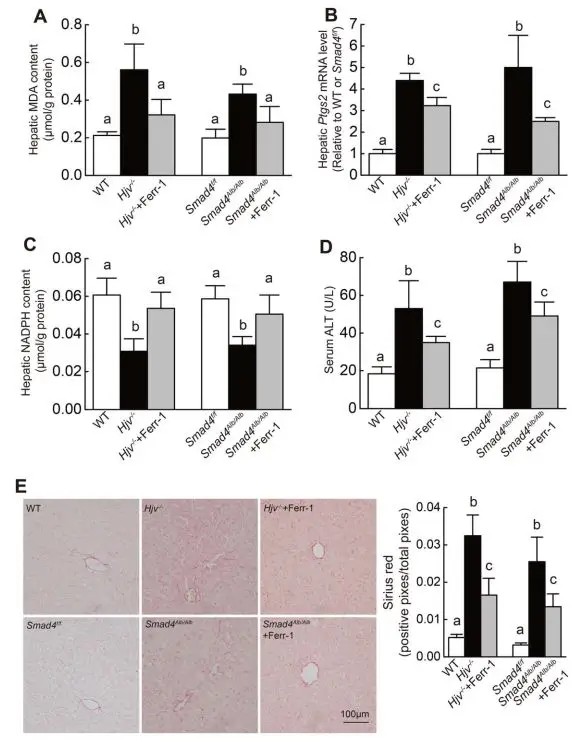 Wang H,et al.Hepatology.2017
Wang H,et al.Hepatology.2017
铁死亡相关指标检测服务哪里有?
铁死亡指标研究可依托乐备实(LabEx)的Luminex 液相芯片、抗体芯片 等多技术平台,实现铁死亡相关细胞因子、炎症因子、铁代谢调控分子等核心指标的精准检测与分析,为机制研究提供全面技术支撑!
| 产品名 |
货号 |
指标 |
| 人炎症10因子Panel |
LXLBH10-1 |
IL-1β/IL-1F2、IL-2、IL-4、IL-6、IL-8/CXCL8、IL-10、IL-12 p70、IL-13、TNF-α、IFN-γ |
| 人细胞因子-48因子Panel |
LXLBH48-1 |
FGF-basic、Eotaxin、G-CSF、GM-CSF、IFN-γ、IL-1β、IL-1rα、IL-1α、IL-2Rα、IL-3、IL-12(p40)、IL-16、IL-2、IL-4、IL-5、IL-6、IL-7、IL-8、IL-9、GRO-α、HGF、IFN-α2、LIF、MCP-3、IL-10、IL-12(p70)、IL-13、IL-15、IL-17、IP-10、MCP-1(MCAF)、MIG、β-NGF、SCF、SCGF-β、SDF-1α、MIP-1α、MIP-1β、PDGF-BB、RANTES、TNF-α、VEGF、CTACK、MIF、TRAIL、IL-18、M-CSF、TNF-β |
| 小鼠细胞因子-23因子Panel |
LXLBM23-1 |
IL-1α、IL-1β、IL-2、IL-3、IL-4、IL-5、IL-6、IL-9、IL-10、IL-12(p40)、IL-12(p70)、IL-13、IL-17A、Eotaxin、G-CSF、GM-CSF、IFN-γ、KC、MCP-1(MCAF)、MIP-1α |
乐备实(上海优宁维生物科技股份有限公司旗下全资子公司),是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、PLA蛋白互作、多色免疫组化、DSP空间多组学等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。

















 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


