细胞作为生命活动的基本单元,其内部存在着复杂且精密的调控网络,生物分子修饰是该网络实现精准调控的核心方式之一,而ADP-核糖基化作为一种关键且保守的生物分子修饰(翻译后修饰)过程,广泛存在于原核生物和真核生物中,它扮演着“分子开关”的核心角色,通过烟酰胺腺嘌呤二核苷酸(NAD⁺)提供ADP-核糖基团,在“写入者”“擦除者”“阅读者”和“供给者”的协同作用下,对目标分子进行功能重塑,精准调控DNA修复、转录调控、细胞周期等多种生物学过程,进而参与调控细胞对内外环境信号的应答;近年来,随着分子生物学技术的飞速发展,ADP-核糖基化的分子机制逐渐被揭示,其在疾病发生发展中的关键作用也受到广泛关注,成为生命科学领域的研究热点,为疾病治疗提供了全新的靶点与策略。
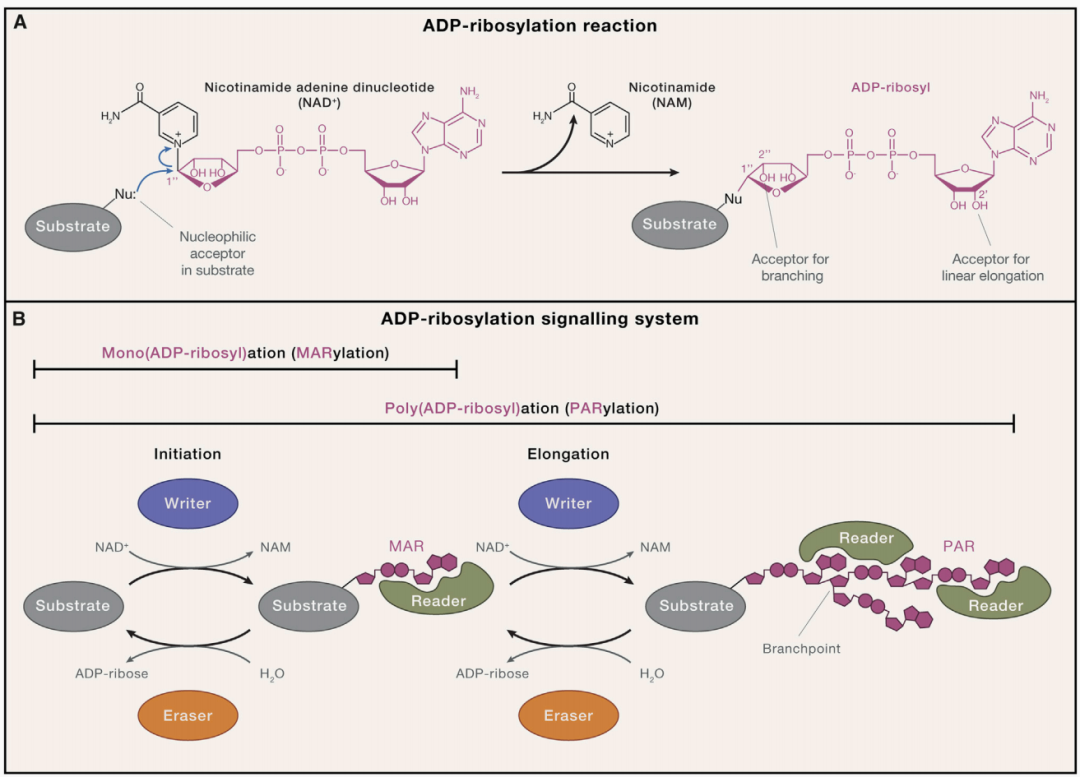
Suskiewicz MJ, Prokhorova E, Rack JGM, Ahel I. ADP-ribosylation from molecular mechanisms to therapeutic implications. Cell. 2023 Oct 12;186(21):4475-4495.
一、ADP-核糖基化的分子机制与核心调控元件
(一)基本反应过程
ADP-核糖基化是指在特定酶的催化下,将NAD⁺分子中的ADP-核糖部分转移至目标分子(包括蛋白质、核酸等)上,同时释放烟酰胺(NAM)的生物化学反应。根据修饰形式的不同,可分为单ADP-核糖基化(MARylation)和多ADP-核糖基化(PARylation):前者是将单个ADP-核糖基团连接至目标分子;后者则通过ADP-核糖链的延伸与分支,形成聚ADP-核糖(PAR)链,实现对目标分子的深度修饰。这一修饰过程直接改变目标分子的结构构象,进而调控其活性、定位及相互作用网络。
(二)核心调控元件
ADP-核糖基化的精准调控依赖于四类核心功能元件的协同作用,构成了完整的调控体系:
1. 写入者(Writers):即催化ADP-核糖基化反应的酶类,包括PARP家族成员、ARTC家族等。其中,PARP家族是真核生物中最主要的“写入者”,负责催化PARylation或MARylation反应的起始与延伸。例如,PARP1可在DNA损伤位点被快速激活,启动PAR链的合成。
2. 擦除者(Erasers):指能够移除目标分子上ADP-核糖基团的水解酶,如PARG、ARH3、MACROD2等。这类酶通过水解ADP-核糖与目标分子之间的连接键,或降解PAR链,逆转ADP-核糖基化修饰,实现调控的动态平衡。
3. 阅读者(Readers):是能够特异性识别ADP-核糖基化修饰位点的蛋白质或结构域,如Macro结构域、WWE结构域、PBZ结构域等。它们通过识别修饰信号,招募下游效应分子形成调控复合物,启动特定的生物学效应。
4. 供给者(Feeders):为ADP-核糖基化反应提供NAD⁺的酶类,通过维持细胞内NAD⁺的稳态,保障修饰过程的持续进行。
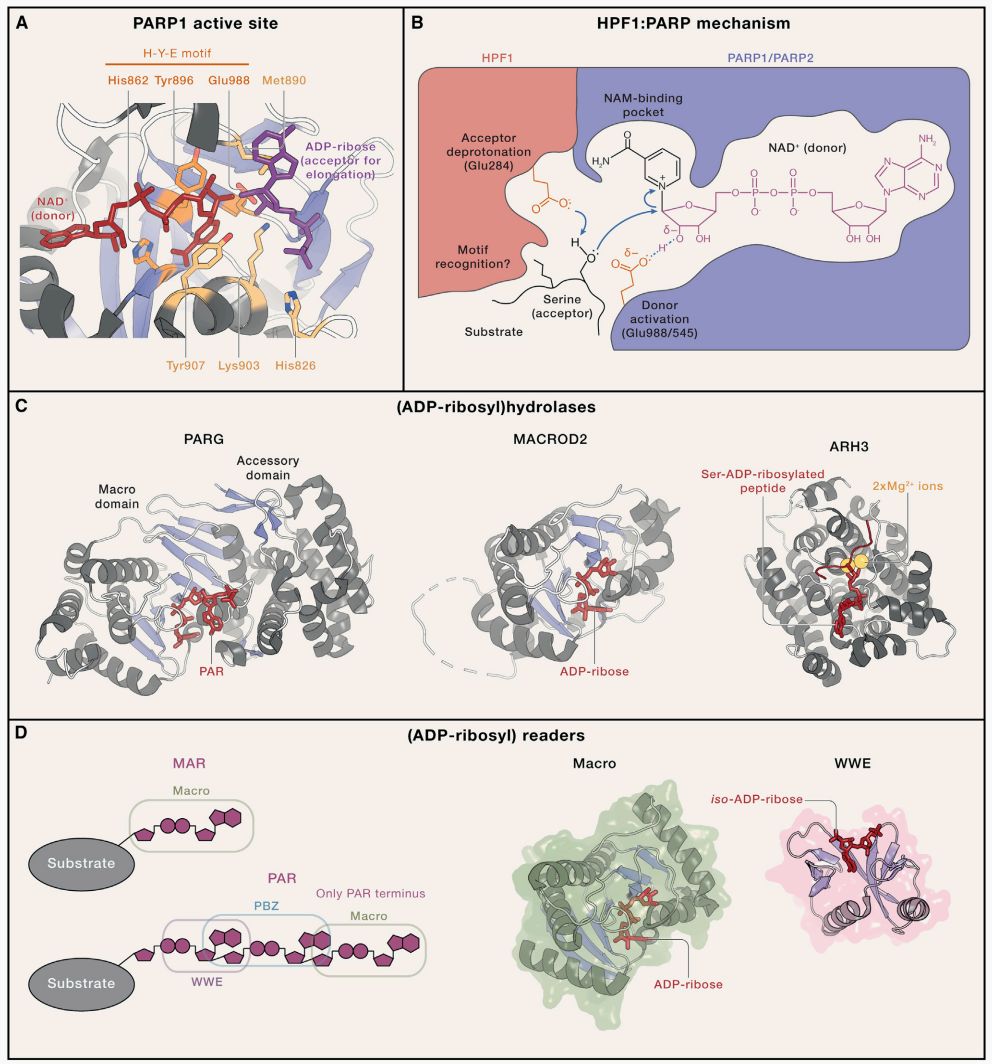
Suskiewicz MJ, Prokhorova E, Rack JGM, Ahel I. ADP-ribosylation from molecular mechanisms to therapeutic implications. Cell. 2023 Oct 12;186(21):4475-4495.
二、ADP-核糖基化的生物学功能
ADP-核糖基化通过对靶分子功能的精准调控,参与多种关键生物学过程,是维持细胞正常生理功能的核心机制之一:
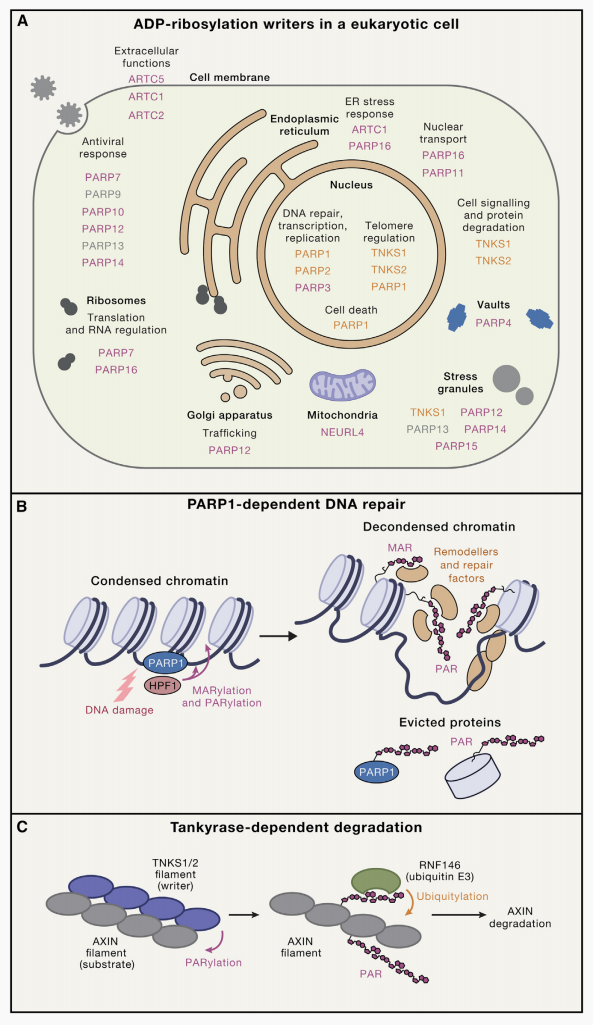
Suskiewicz MJ, Prokhorova E, Rack JGM, Ahel I. ADP-ribosylation from molecular mechanisms to therapeutic implications. Cell. 2023 Oct 12;186(21):4475-4495.
1. DNA损伤修复:这是ADP-核糖基化最核心的功能之一。当细胞受到紫外线、化学药物等外界因素影响导致DNA损伤时,PARP1等“写入者”会迅速被激活,在损伤位点催化PAR链的合成。PAR链作为信号分子,招募染色质重塑因子、DNA修复酶等下游蛋白,形成修复复合物,高效修复受损DNA,维持基因组的稳定性。
2. 转录与基因表达调控:ADP-核糖基化可通过修饰转录因子、组蛋白等关键分子,影响染色质的凝聚状态和转录复合物的组装,进而调控基因的转录活性。例如,对组蛋白的ADP-核糖基化修饰可导致染色质去浓缩,促进转录因子与启动子区域的结合,启动基因表达。
3. 细胞周期调控:在细胞周期的各个阶段,ADP-核糖基化通过调控周期蛋白、 CDK激酶等关键分子的活性,确保细胞周期的有序推进。异常的ADP-核糖基化修饰会导致细胞周期紊乱,进而引发细胞增殖异常或凋亡受阻。
4. 免疫应答调控:ADP-核糖基化在宿主的免疫防御中发挥重要作用。一方面,它可通过调控免疫细胞的活化、细胞因子的分泌等,参与适应性免疫和固有免疫应答;另一方面,病原体也可利用自身的ADP-核糖基化系统,干扰宿主的免疫反应,实现免疫逃逸。
三、ADP-核糖基化与疾病的关联及治疗应用
(一)与疾病的关联
由于ADP-核糖基化参与调控细胞生理功能的多个关键环节,其修饰异常必然会导致疾病的发生。目前已证实,ADP-核糖基化与多种疾病密切相关:
1. 癌症:异常的ADP-核糖基化修饰会导致DNA修复机制亢进、细胞增殖失控、凋亡受阻等,进而促进肿瘤的发生与发展。例如,PARP1在多种肿瘤细胞中高表达,通过增强DNA损伤修复能力,使肿瘤细胞对化疗药物产生耐药性。
2. 神经退行性疾病:在阿尔茨海默病、帕金森病等神经退行性疾病中,存在过度的ADP-核糖基化修饰,导致神经细胞的DNA损伤累积、线粒体功能异常,最终引发神经细胞死亡和认知功能障碍。
3. 感染性疾病:细菌和病毒等病原体可利用ADP-核糖基化作为“战争武器”,调控自身的生存与繁殖,同时干扰宿主的免疫防御。例如,某些细菌通过ADP-核糖基化修饰宿主细胞的关键蛋白,抑制宿主的吞噬作用和炎症反应;病毒则利用该机制对抗宿主的免疫监视,促进病毒复制。
(二)在疾病治疗中的应用
基于ADP-核糖基化与疾病的密切关联,以该过程为靶点的治疗策略已成为近年来的研究热点,其中PARP抑制剂(PARPi)的研发与应用取得了突破性进展:
1. 癌症治疗:PARPi通过抑制PARP酶的活性,阻断肿瘤细胞的DNA损伤修复途径。对于BRCA基因缺陷的肿瘤细胞,其自身的同源重组修复机制已受损,PARPi的应用会导致DNA损伤无法修复,最终引发肿瘤细胞凋亡。目前,已有多种PARPi被批准用于乳腺癌、卵巢癌、胰腺癌等肿瘤的临床治疗,显著改善了患者的预后。此外,PARPi与化疗、放疗的联合治疗方案也在临床试验中展现出良好的疗效,为肿瘤治疗提供了更多选择。
2. 非肿瘤性疾病治疗:在神经退行性疾病中,过度的ADP-核糖基化会导致神经细胞损伤,PARPi可通过抑制异常的修饰反应,减少DNA损伤累积,保护神经细胞功能,为这类疾病的治疗提供了新的思路。同时,针对感染性疾病,靶向病原体ADP-核糖基化系统的抑制剂有望成为新型抗菌、抗病毒药物,为应对耐药性病原体提供解决方案。
四、ADP-核糖基化的研究现状与未来展望
(一)研究现状
近年来,随着质谱分析、晶体结构解析、基因编辑等技术的发展,ADP-核糖基化的研究取得了显著进展。在分子机制方面,已明确了主要“写入者”“擦除者”“阅读者”的功能及作用模式,揭示了其在DNA修复、免疫应答等过程中的调控网络;在疾病关联方面,证实了ADP-核糖基化异常在多种疾病中的关键作用,为疾病的诊断提供了潜在标志物;在治疗应用方面,PARPi的成功上市验证了以ADP-核糖基化为靶点的治疗策略的可行性,推动了相关药物的研发进程。 然而,该领域仍存在诸多未解之谜:例如,不同“写入者”“擦除者”“阅读者”之间的协同调控机制尚未完全阐明;除蛋白质外,核酸等其他分子的ADP-核糖基化修饰功能仍需深入探索;针对不同疾病的特异性靶点筛选及药物研发仍面临挑战。
(二)未来展望
未来的研究将围绕以下方向展开:一是深入解析ADP-核糖基化的分子机制,特别是不同修饰形式的特异性调控网络,以及在不同细胞类型和生理病理状态下的功能差异;二是拓展ADP-核糖基化与疾病的关联研究,挖掘新的疾病相关靶点和诊断标志物;三是推动治疗药物的研发与优化,除了进一步优化PARPi的疗效和安全性外,开发针对其他核心调控元件的抑制剂、激动剂等,丰富治疗策略;四是探索ADP-核糖基化在病原体与宿主相互作用中的作用机制,为感染性疾病的治疗提供新靶点。 随着技术的不断进步和研究的持续深入,ADP-核糖基化这一“分子开关”的奥秘将被进一步揭开,其在生命科学研究和疾病治疗中的应用前景将更加广阔,为人类健康事业提供更有力的支撑。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


