免疫系统通过先天免疫与适应性免疫的协同作用实现对病原体的防御及内环境稳态的维持。先天免疫依赖模式识别受体快速响应入侵病原体,而适应性免疫则凭借T细胞与B细胞的高度特异性识别能力,形成精准且持久的免疫保护。B细胞作为适应性免疫的关键淋巴细胞亚群,其发育成熟过程的分子调控、抗原活化机制及功能执行模式一直是免疫学基础研究的核心方向。近年来,随着单细胞测序、流式细胞术等技术的发展,B细胞的异质性特征、发育过程中的基因重排规律及免疫应答调控网络等研究取得诸多突破,为深入理解体液免疫的分子机制提供了重要依据。
一、B细胞的起源与发育分化机制
(一)起源与命名
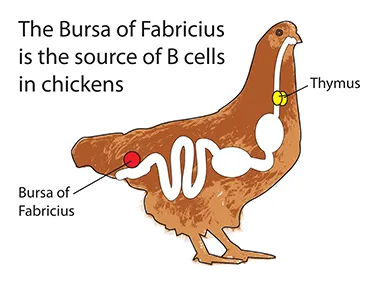
B细胞作为适应性免疫的三大淋巴细胞之一(另两类为T细胞和NK细胞),其命名源于1960-70年代的经典实验发现:Max Cooper和Robert Good通过手术切除鸟类的法氏囊(Bursa of Fabricius)后,发现鸡丧失了抗体产生能力,因此取该免疫器官首字母命名为"B细胞"。在人体中,B细胞起源于骨髓造血干细胞(HSC),其发育过程严格遵循基因调控的阶段性分化程序,最终形成具有抗原应答能力的成熟B细胞。
(二)发育分化的阶段性特征
B细胞的发育分化贯穿骨髓内的定向分化与外周淋巴器官的成熟活化两个阶段,各阶段具有明确的分子标志物表达谱和基因调控特征:
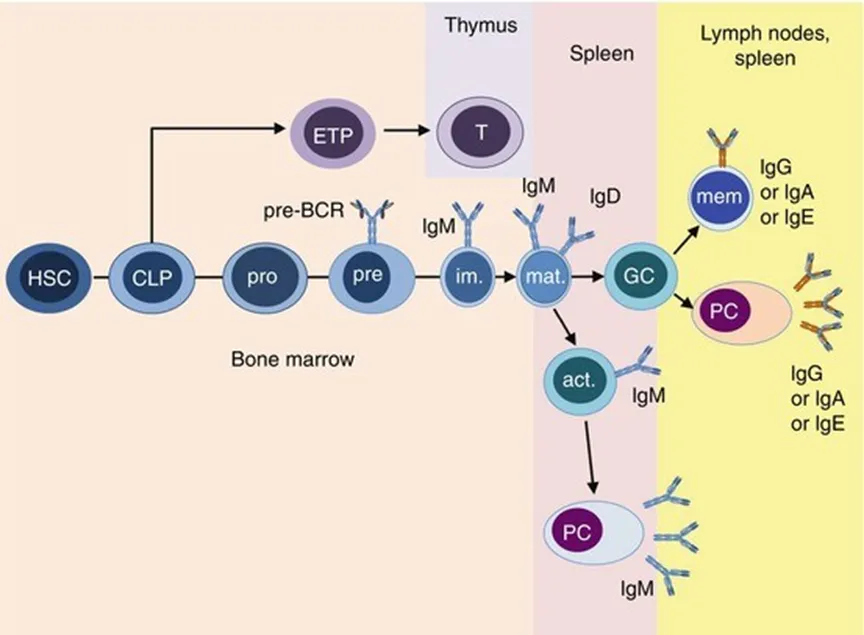
1. 骨髓内发育阶段:
造血干细胞首先分化为共同淋巴样前体细胞(CLP),进而定向分化为pro-B细胞。该阶段启动免疫球蛋白重链(IGH)的V(D)J基因重排,通过DH→JH及VH→DJH的有序重排形成功能性重链基因。随后进入pre-B细胞阶段,细胞表面瞬时表达前B细胞受体(pre-BCR),该受体信号可诱导轻链基因(IGK/IGL)的VJ重排,完成BCR的结构组装。pre-B细胞进一步分化为未成熟B细胞,表面首次表达完整的BCR(主要为IgM),并经历负选择过程——若其BCR识别自身抗原,则会被清除或失活,以建立免疫耐受。
2. 外周成熟与活化阶段:
未成熟B细胞迁移至脾脏、淋巴结等外周淋巴器官后,表面同时表达IgM和IgD,成为成熟B细胞。在抗原刺激下,成熟B细胞启动活化程序,通过克隆扩增形成大量同源B细胞群,随后分化为浆细胞和记忆B细胞。部分活化B细胞进入淋巴结滤泡的生发中心,经历体细胞超突变和抗体类别转换,实现BCR亲和力成熟,最终形成高亲和力抗体分泌型浆细胞。
(三)发育过程中的关键基因调控
B细胞发育过程受一系列转录因子和信号分子的精准调控:Pax5作为B细胞发育的关键转录因子,在pro-B细胞阶段启动表达,调控B细胞特异性基因的转录激活,维持B细胞谱系特性;EBF1、SOX4等转录因子参与早期B细胞的增殖与分化调控;IL7RA介导的信号通路在pro-B细胞和pre-B细胞阶段的存活与增殖中发挥重要作用。此外,免疫球蛋白基因的V(D)J重排过程受RAG1、RAG2等重组酶的调控,其重排的随机性与特异性共同决定了BCR库的多样性。
二、B细胞的表面受体与分子特征
(一)B细胞受体(BCR)的结构与功能
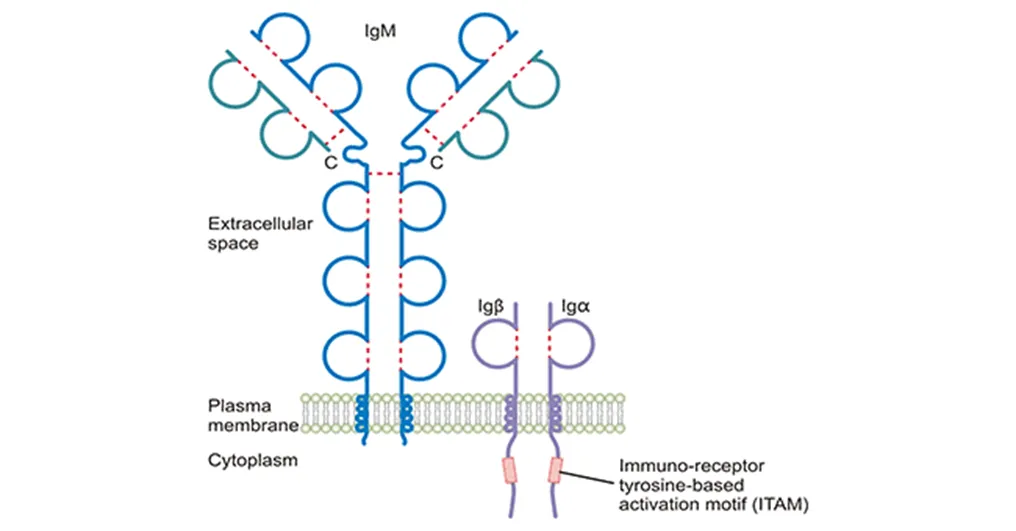
BCR是B细胞表面特异性识别抗原的核心分子,其结构与抗体的抗原识别区相似,赋予每个B细胞独特的抗原特异性。BCR由IgM重链和轻链组成,通过二硫键连接形成异二聚体,同时与跨膜复合物Igα/Igβ(CD79A/CD79B)非共价结合,构成完整的信号传导单位。BCR的胞内结构域与免疫受体酪氨酸激活基序(ITAM)相连,抗原结合后可启动下游信号传导,激活B细胞的增殖分化。 BCR具有双重生物学功能:一是特异性识别并结合抗原,通过内化作用将抗原加工为短多肽片段,再与MHC-Ⅱ分子结合呈递给辅助性T细胞;二是传递抗原识别信号,启动B细胞活化程序。BCR可变区的多样性由V(D)J基因重排产生,重排过程中碱基的随机插入、缺失及替换进一步增加了BCR库的多样性,确保机体能够识别众多不同结构的抗原分子。
(二)特征性表面标志物
B细胞在不同发育阶段表达特异性表面标志物,为细胞分型及功能研究提供了重要工具。pro-B细胞阶段表达CD34、CD117、IL7RA等标志物;pre-B细胞阶段表达CD179B、Vpreb、CD38等;未成熟B细胞表达CD19、CD24、IgM等;成熟B细胞则同时表达CD19、CD20、IgM和IgD。此外,BCMA作为浆细胞的特征性标志物,主要表达于晚期B细胞和浆细胞表面,是区分浆细胞与其他B细胞亚群的关键标志。这些标志物的动态表达模式反映了B细胞的发育成熟状态,为流式细胞术及单细胞测序等技术的细胞分型提供了基础。
三、B细胞的活化机制与调控网络
(一)活化途径的分子机制
B细胞的活化主要依赖两种途径,其分子机制存在显著差异:
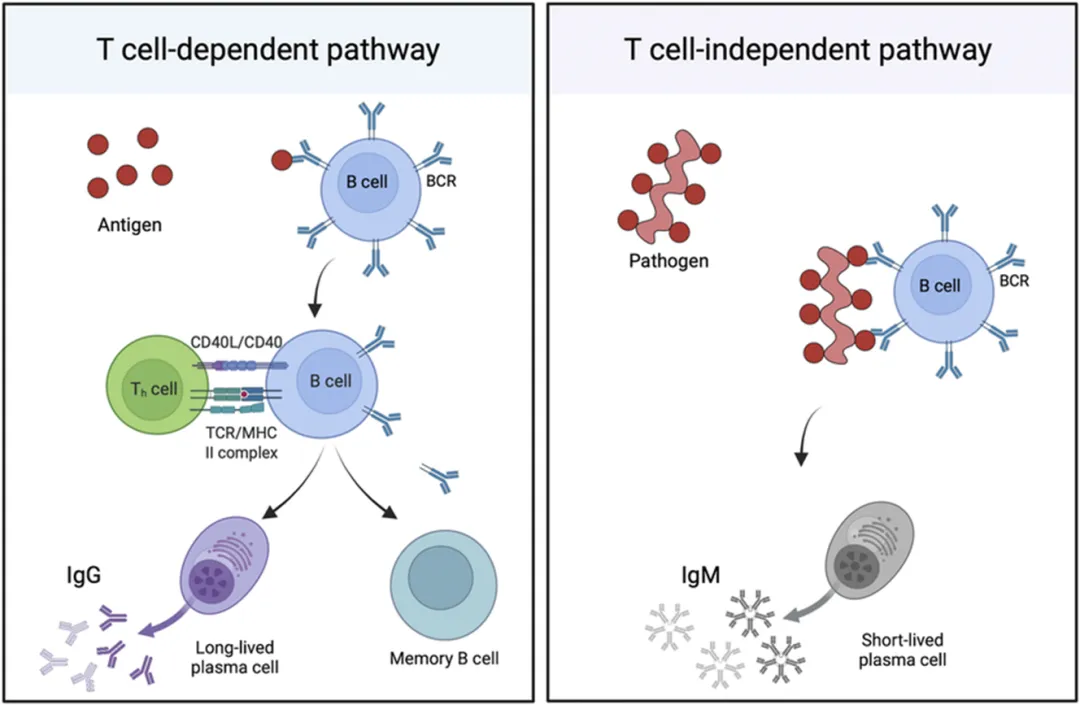
1. T细胞依赖途径:该途径是机体产生高亲和力抗体和记忆B细胞的主要方式。B细胞通过BCR特异性识别抗原后,将抗原内化加工为短多肽,与MHC-Ⅱ分子结合呈递给辅助性T细胞;辅助性T细胞表面的TCR识别MHC-Ⅱ-抗原肽复合物,同时其表面的CD40L与B细胞表面的CD40结合形成共刺激信号,此外辅助性T细胞分泌的IL-4、IL-6等细胞因子进一步激活B细胞。该途径激活的B细胞进入生发中心,经历克隆扩增、体细胞超突变和抗体类别转换,最终分化为高亲和力浆细胞和记忆B细胞。
2. 非T细胞依赖途径:主要针对具有重复基序的大分子抗原(如细菌多糖),这类抗原可同时交联多个B细胞表面的BCR,无需辅助性T细胞参与即可启动B细胞活化。该途径通过BCR交联激活下游信号通路,诱导B细胞快速分化为短寿命浆细胞,仅产生IgM类抗体,不发生抗体类别转换和亲和成熟。其反应速度快,可在抗原入侵早期提供快速免疫保护,但免疫记忆维持时间较短。
(二)活化调控的分子网络
B细胞的活化受到正调控信号与负调控信号的协同平衡,形成复杂的分子调控网络:正调控信号包括BCR介导的抗原识别信号、CD40-CD40L介导的共刺激信号及细胞因子信号(如IL-4、IL-6);负调控信号则主要由PD-1、CTLA-4等共抑制分子介导,可抑制B细胞过度活化,避免免疫应答紊乱。此外,抗原的性质、浓度及呈递方式也会影响B细胞的活化效率:低浓度抗原主要通过T细胞依赖途径激活B细胞,而高浓度重复基序抗原则更易通过非T细胞依赖途径启动免疫应答。
四、B细胞的核心生物学功能
(一)抗体产生与亲和成熟
产生特异性抗体是B细胞最核心的功能。活化后的B细胞分化为浆细胞,根据寿命可分为短寿命浆细胞和长寿命浆细胞。短寿命浆细胞主要来源于非T细胞依赖途径活化的B细胞,存活时间仅数天,但分泌抗体效率极高,每秒约产生2000个IgM抗体分子,可在抗原入侵早期快速清除病原体;长寿命浆细胞则来源于T细胞依赖途径的生发中心反应,通过体细胞超突变实现BCR亲和力成熟,可产生IgG、IgA或IgE等高亲和力抗体,在体内存活数年,持续提供免疫保护。抗体类别转换过程由细胞因子调控,如IL-4诱导IgG1和IgE产生,IFN-γ促进IgG2a产生,不同类别抗体通过不同效应机制清除病原体。
(二)抗原呈递功能
B细胞作为专职抗原呈递细胞,具有高度特异性的抗原呈递能力。与巨噬细胞、树突状细胞等其他抗原呈递细胞不同,B细胞通过BCR特异性结合抗原,可高效内化低浓度抗原并加工呈递,为辅助性T细胞提供精准的抗原信号。B细胞的抗原呈递功能在体液免疫与细胞免疫的协同调控中发挥关键作用,通过呈递抗原激活辅助性T细胞,进而促进自身活化与分化,形成免疫应答的放大效应。
(三)免疫记忆形成与维持
记忆B细胞是B细胞活化后产生的长寿命细胞亚群,可存活数年甚至数十年,主要定居于脾脏、淋巴结等外周淋巴器官。记忆B细胞表面表达类别转换后的Ig(如IgG、IgA或IgE),其BCR具有高亲和力。当机体再次接触相同抗原时,记忆B细胞可快速响应,无需经过生发中心反应即可直接分化为浆细胞,产生大量高亲和力抗体,启动继发性免疫应答。与初次免疫应答相比,继发性免疫应答具有反应速度快(潜伏期短)、抗体水平高、持续时间长等特点,是机体长期免疫保护的核心机制。
五、结论与展望
B细胞的发育分化、活化调控及功能执行涉及复杂的分子网络和细胞间相互作用,其作为体液免疫的核心细胞,在机体免疫应答中发挥不可替代的作用。近年来,随着单细胞测序、基因编辑等技术的应用,B细胞发育过程中的基因调控网络、BCR库多样性形成机制及免疫记忆维持的分子基础等研究取得了诸多进展。然而,B细胞亚群的异质性特征、不同微环境对B细胞功能的调控机制、免疫耐受建立过程中B细胞的选择机制等问题仍需进一步探索。未来,通过整合多组学技术与功能验证实验,深入解析B细胞的生物学特性及调控网络,将为理解免疫相关疾病的发病机制提供新的视角,同时为免疫治疗策略的优化提供理论基础。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


