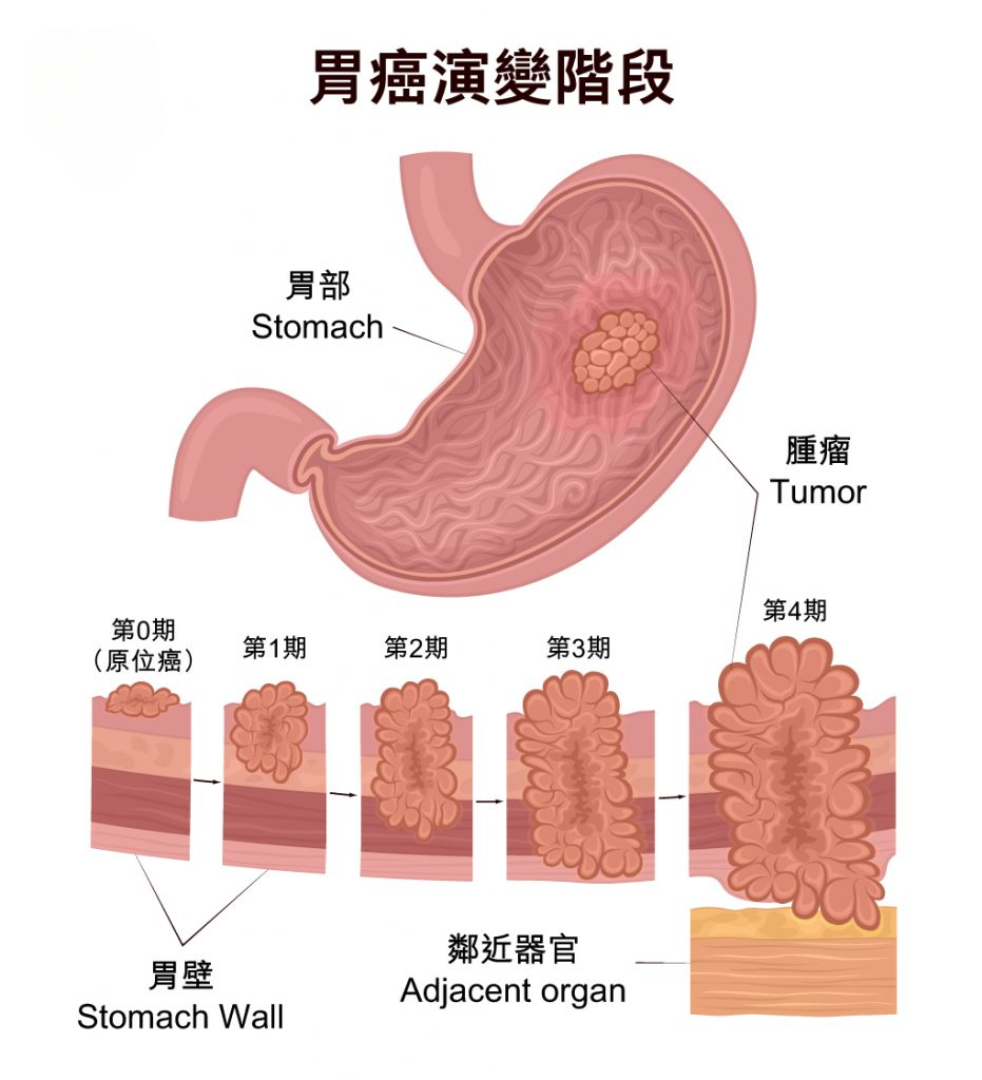
一、疾病背景:异质性与精准诊疗挑战
胃癌的发生发展是一个多步骤、多因素参与的复杂过程,涉及遗传、表观遗传改变以及幽门螺杆菌感染、饮食习惯等环境因素的交互作用。根据Lauren分型,胃癌主要分为肠型和弥漫型,二者在流行病学、分子特征及临床预后上存在显著差异。这种高度的肿瘤内及肿瘤间异质性,使得传统“一刀切”的治疗模式效果有限。因此,构建基于分子标志物的精准诊疗体系,是实现个体化治疗、改善患者预后的核心方向。世界卫生组织及国际癌症研究机构的最新分类已日益强调分子特征在胃癌分型中的重要性。

二、核心生物标志物体系
目前,胃癌的临床诊疗与研究中,生物标志物主要分为以下几类:
1、治疗预测性生物标志物:
👉HER2:首个在胃癌中获批的靶点,用于指导曲妥珠单抗等靶向药物的使用。其检测通常通过免疫组织化学与荧光原位杂交进行。
👉PD-L1与MSI-H/dMMR:作为免疫检查点抑制剂疗效的预测标志物。微卫星高度不稳定性或错配修复缺陷状态提示肿瘤具有较高的肿瘤突变负荷,可能对免疫治疗响应更佳。
👉Claudin 18.2:一种紧密连接蛋白,在部分胃癌亚型中高表达,已成为新兴的靶向治疗靶点,相关靶向药物临床研究进展迅速。
👉NTRK基因融合、EGFR扩增等:尽管发生率较低,但在特定患者群体中具有重要的治疗指导价值。
2、预后相关生物标志物:
👉EB病毒阳性:与独特的分子特征和相对较好的预后相关。
👉肿瘤突变负荷、特定基因如TP53、ARID1A的突变状态等,也与疾病进展和预后评估密切相关。
三、靶点检测的关键技术平台
高效、精准、多重的生物标志物检测技术是实施精准医疗的基石。传统单一检测方法已难以满足多靶点并行分析的需求。
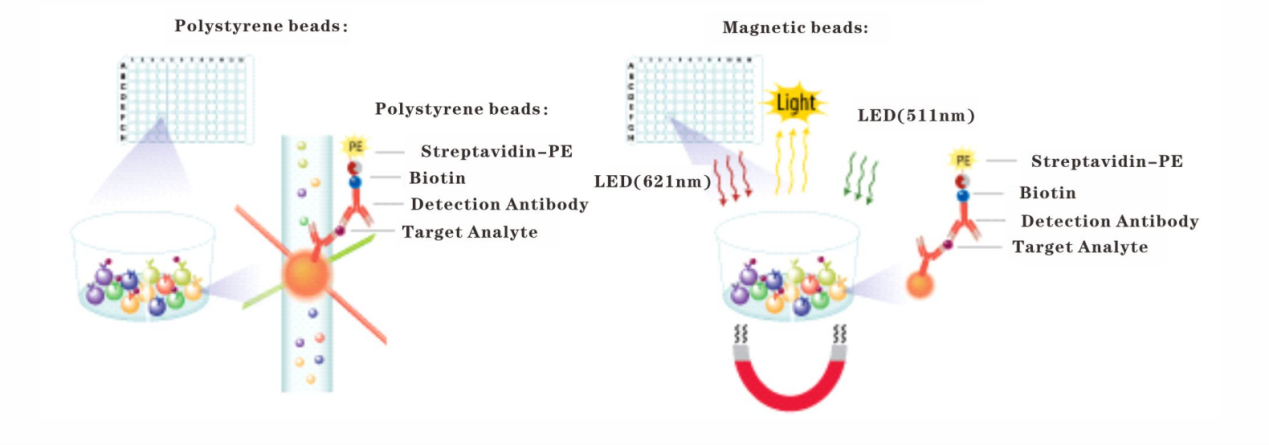
多重蛋白检测技术(如Luminex与MSD):
✔️Luminex(流式荧光技术):基于编码微球与流式检测原理,可同时对单一样本中多达数百种蛋白生物标志物进行定量检测。其在胃癌中的应用包括:大规模筛查血清/血浆中的细胞因子、趋化因子谱,以寻找与免疫治疗应答或毒性相关的特征谱;验证从组学数据中发现的候选蛋白标志物。
✔️MSD(电化学发光技术):采用电化学发光原理,具有高灵敏度、宽动态范围、低背景噪音等优势。其多因子检测板在胃癌研究中广泛应用于磷酸化信号通路蛋白分析、肿瘤微环境相关蛋白(如多种免疫检查点分子)的精准定量,为理解肿瘤信号网络和免疫状态提供了强有力的工具。
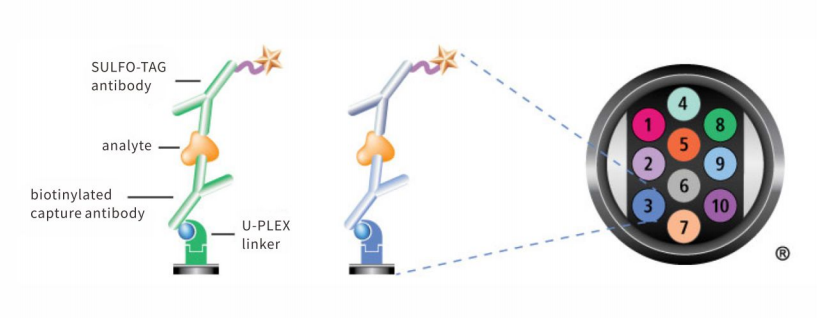
相较于传统的酶联免疫吸附试验,这两种技术实现了从“单一”到“多重”、从“相对低通量”到“高效率”的跨越,显著提升了研究深度与临床转化效率。
四、前沿技术:单细胞测序与空间组学在胃癌中的应用
为了深入解析胃癌异质性的细胞起源和空间组织结构,单细胞测序与空间组学技术正引领着胃癌研究进入新维度。
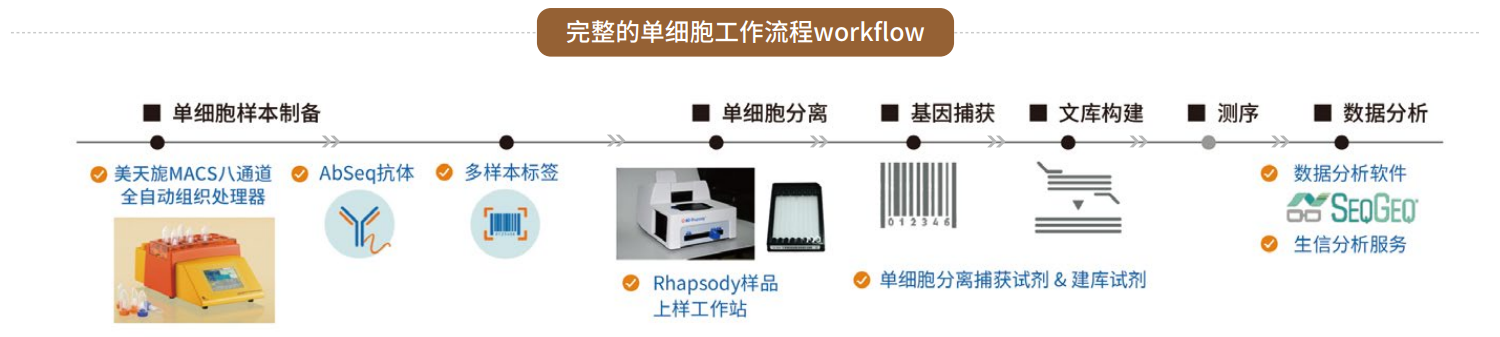
✔️单细胞测序技术:
该技术能够在单个细胞水平解析肿瘤细胞、免疫细胞、基质细胞等所有肿瘤微环境组成细胞的转录组、基因组或表观基因组特征。在胃癌中,其应用揭示了:
👉肿瘤细胞亚群的异质性及其与耐药性的关系。
👉肿瘤浸润免疫细胞的功能状态,如耗竭性T细胞、调节性T细胞、肿瘤相关巨噬细胞的不同亚型,为设计联合免疫治疗策略提供了新思路。
👉罕见的干细胞样细胞或耐药细胞亚群,为根除肿瘤提供了潜在靶点。
✔️空间组学技术:
单细胞测序“解构”了细胞,但丢失了其空间位置信息。空间组学技术(如基于原位杂交或原位测序的方法)则完美弥补了这一缺陷,能够直接在组织切片上保留空间位置的同时,检测数百至数千个基因的表达。在胃癌研究中,其价值在于:
👉描绘肿瘤生态系统的空间架构:明确不同功能细胞亚群在肿瘤核心区、侵袭前沿、淋巴滤泡等特定区域的分布规律。
👉解析细胞间相互作用网络:鉴定肿瘤细胞与特定免疫细胞、成纤维细胞之间的空间邻近关系,推断其潜在的免疫逃逸或促癌通讯机制。
👉指导生物标志物的精准解读:揭示同一生物标志物(如PD-L1)在不同空间区域表达的临床意义差异。

五、总结与展望
胃癌的精准医疗已进入一个多组学、多维度整合的时代。从传统的单一靶点检测,到Luminex、MSD等实现的多重蛋白定量,再到单细胞测序与空间组学提供的超高分辨率细胞图谱与空间信息,技术平台的进步正持续推动着我们对胃癌生物学本质的认知。未来,通过整合基因组、转录组、蛋白组及空间信息,构建多维度的胃癌分子分型系统,将有助于更早地识别高危人群,更准确地预测治疗反应,并开发出更具针对性的新型联合疗法。这些技术的临床转化与标准化应用,是最终实现胃癌个体化精准诊疗、提升患者长期生存率的关键所在。
六、胃癌相关生物标志物检测哪里有?
LabEx为您提供专业、系统的胃癌相关生物标志物检测与分析解决方案。我们整合多技术平台(包括免疫组化、ELISA、化学发光、液相芯片及高通量测序等),可全面检测与胃癌发生、发展、预后及治疗响应相关的关键分子标志物,涵盖血清肿瘤标志物(如CEA、CA19-9、CA72-4、PG I/II等)、HER2/EGFR等治疗靶点蛋白、微卫星不稳定性(MSI)、EB病毒(EBER)检测、以及ctDNA基因突变与甲基化分析等。
| 货号 | Panel名称 | 种属 | 检测指标 |
| LXLTH14-3 | 人免疫肿瘤学检查点14因子Panel | Human | TIM-3,CD152/CTLA4,BTLA,CD28,IDO/IDO1,LAG-3,PD-1,PD-L2,CD27,CD137 (4-1BB),GITR,HVEM,CD80,PD-L1 |
| LXMH07-9 | 人CAR-T细胞治疗7因子Panel1 | Human | IFN-γ,TNF-α,TIGIT,PD-L1/B7-H1,CD28,CTLA-4,LAG3 |
| LXMH131-1 | 人肿瘤免疫因子131因子Panel | Human | FGF-23,G-CSF,GM-CSF,Granzyme B,IFN-γ,IL-10,IL-13,IL-15,IL-16,IL-17F,IL-2,IL-23,IL-4,IL-5,IL-6,IL-7,MIF,TNF-α,VEGF-A,M-CSF,IL-29/IFN-λ1,Insulin,IFN-α2/IFNA2/IFN-α2a,FSH,VEGF-D,PYY (Total),ProMMP-9,Perforin,LIGHT/TNFSF14,IL-33,IL-31,IL-21,IL-17E/IL-25,Granzyme A,Ghrelin (Active),IL-22,IL-17A/F,ICOS,GLP-1 (Active),C-Peptide,TNFRII/TNFRSF1B,TNFRI/TNFRSF1A,TLR1,TIGIT,RAGE/AGER,Proinsulin,PD-L1/B7-H1,PD1 (epitope 2),PD1 (epitope 1),OX40/TNFRSF4,MIP-5,Luteinizing Hormone/LH,IL-9,IL-17D,IL-17C,ICOS-L/B7-H2,gp130/sIL-6Rβ,GLP-1 (Inactive) |
| LXRLDH27-1 | 人综合筛选Express 27因子Panel | Human | CCL11/Eotaxin,FGF-23,FGF basic/FGF2/bFGF,G-CSF,GM-CSF,Granzyme B,IL-10,IL-12/IL-23 p40,IL-12 p70,IL-13,IL-15,IL-16,IL-17/IL-17A,IL-18/IL-1F4,IL-1ra/IL-1F3,IL-2,IL-23,IL-4,IL-5,IL-6,IL-7,IL-8/CXCL8,CXCL10/IP-10/CRG-2,CXCL11/I-TAC,CCL2/JE/MCP-1,CCL7/MCP-3/MARC,CCL22/MDC,MIF,CD138/Syndecan-1,CD253/TRAIL/TNFSF10,VEGF,VEGF-R2/KDR/FLK1,Serpin E1/PAI-1,M-CSF,CCL27/CTACK,CCL25/TECK,CCL24/Eotaxin-2/MPIF-2,CCL1/I-309/TCA-3,CX3CL1/Fractalkine,CCL17/TARC,Insulin,VEGF-C,TIM-1/KIM-1/HAVCR,CD141/Thrombomodulin/BDCA-3,SOST/Sclerostin,SCF/c-kit Ligand/KITLG,Prolactin |












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


