当我们谈论癌症时,很多人首先想到的是癌细胞的“无限增殖”能力,但实际上,肿瘤的恶性进展并非癌细胞的“孤军奋战”。在肿瘤周围的微环境中,存在一群被癌细胞主动“招募”或诱导“改造”的细胞群体,它们如同“帮凶”一般,通过多种机制助力肿瘤生长、侵袭扩散,并帮助其抵抗临床治疗。其中,癌相关成纤维细胞(CAF, Cancer-Associated Fibroblasts)作为肿瘤微环境中数量丰富、功能关键的细胞类型,是推动肿瘤进展的重要“共犯”。
一、CAF的定义、功能特征与微环境作用
CAF是肿瘤微环境(Tumor Microenvironment, TME)中一类被持续激活的成纤维细胞亚型,区别于静止状态的正常成纤维细胞,其在乳腺癌、肺癌、结直肠癌等多种实体瘤组织中均有广泛分布,是构成肿瘤间质的核心组分。
作为具有高度异质性的细胞群体,CAF可通过多途径调控肿瘤进展:一方面,通过分泌转化生长因子(TGF)、成纤维细胞生长因子(FGF)等细胞因子和生长因子,直接促进肿瘤细胞增殖与存活;另一方面,释放的外泌体可携带核酸、蛋白等生物活性物质,实现细胞间信号传递,间接调控肿瘤恶性表型。同时,CAF还能通过分泌基质金属蛋白酶(MMPs)重塑细胞外基质(ECM),打破组织屏障,为肿瘤侵袭转移创造条件,且可通过调控免疫细胞浸润与功能,介导肿瘤免疫逃逸。
与正常成纤维细胞相比,CAF的促肿瘤活性显著增强,其不仅自身具备活跃的功能表型,还能通过与肿瘤细胞、免疫细胞、内皮细胞等微环境组分的动态交互,重塑肿瘤微环境的稳态,形成利于肿瘤进展的“促癌微环境”,加速肿瘤恶性演进。
二、CAF的起源与异质性基础
CAF的起源具有显著复杂性、多样性,且这种多元起源是其高度异质性的核心原因之一。目前研究证实,CAF可来源于多种不同的细胞类型,涵盖固有细胞与募集细胞两大类:固有细胞包括组织局部的静止态成纤维细胞、上皮细胞(经上皮-间质转化形成)、内皮细胞;募集细胞则包括骨髓来源的间充质干细胞(MSCs)、造血干细胞(HSCs)、癌症干细胞(CSCs),以及脂肪细胞、周细胞、星状细胞(如肝脏星状细胞活化后转化)等。
不同来源的CAF,其分化过程受特异性信号通路调控,例如TGF-β、Wnt、Notch等信号通路可介导不同前体细胞向CAF转化,进而赋予各CAF亚群独特的生物学特征、功能表型及分泌谱,使其在肿瘤进展中发挥差异化作用,这也为后续针对性靶向CAF治疗带来了挑战与机遇。
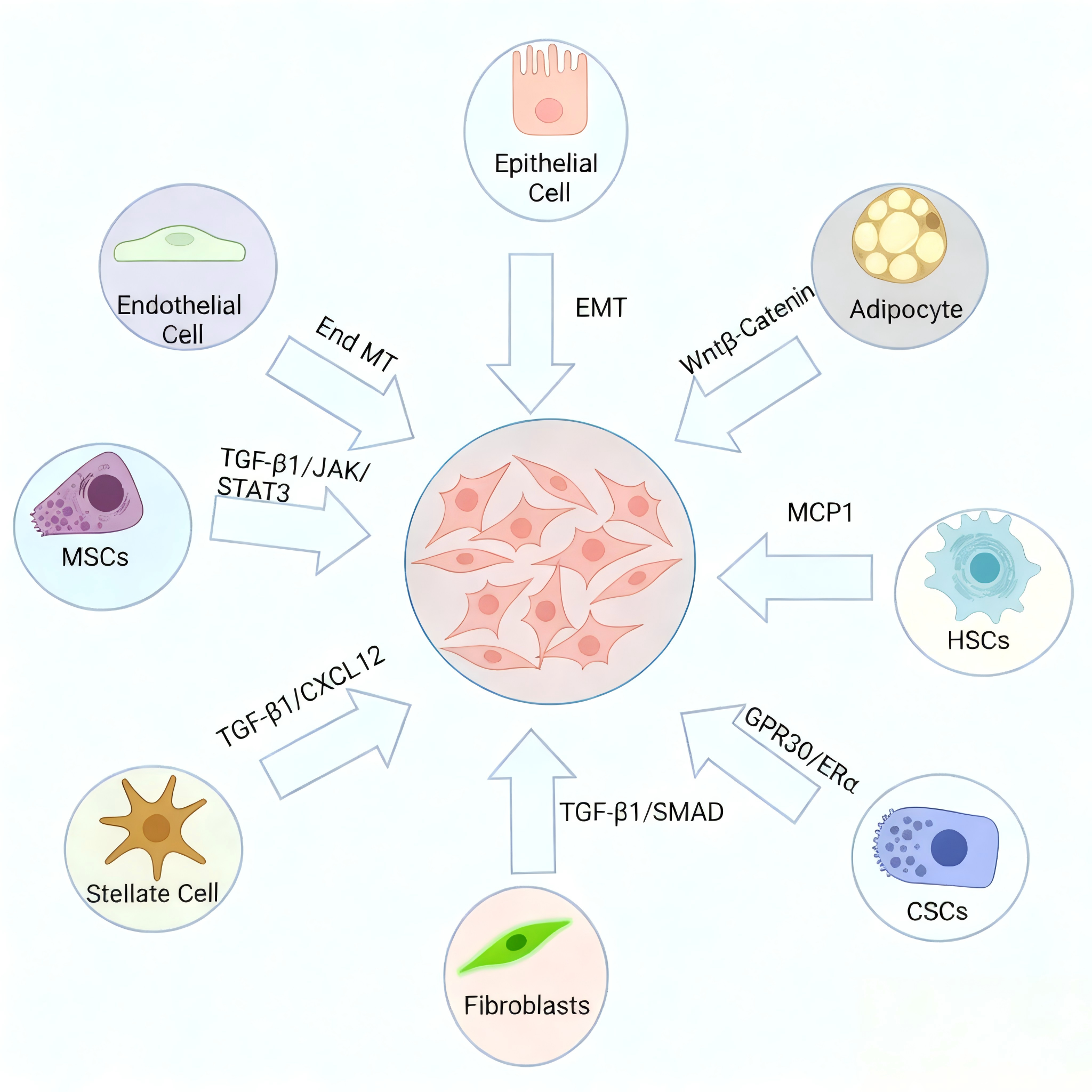 CAFs 的起源
CAFs 的起源
三、CAFs与TME的动态互作
癌相关成纤维细胞(CAFs)作为肿瘤微环境(TME)中最活跃的间质细胞之一,与TME内各类组分形成紧密的双向动态互作网络,这种互作关系贯穿癌症发生、发展及转移的全过程,通过多维度机制共同驱动肿瘤恶性进展,具体主要体现在以下三个方面:
a)肿瘤细胞分泌的细胞因子调控CAFs活化与功能
肿瘤细胞可通过分泌多种关键细胞因子,如转化生长因子-β(TGF-β)、白细胞介素-6(IL-6)、血小板衍生生长因子(PDGF)等,精准诱导局部静止态成纤维细胞向活化型CAFs转化。活化后的CAFs会启动特异性分泌程序,释放大量促肿瘤因子,包括表皮生长因子(EGF)、成纤维细胞生长因子(FGF)等生长因子、CXCL家族趋化因子及基质金属蛋白酶(MMPs)等基质重塑酶。这些因子一方面可直接作用于肿瘤细胞,显著增强其增殖活性、侵袭能力及迁移潜能;另一方面通过旁分泌效应反哺肿瘤细胞,进一步强化其促CAFs活化的能力,形成“肿瘤细胞-CAFs”双向促癌的恶性循环,加速肿瘤进展。
b)CAFs主导细胞外基质(ECM)结构重塑,构建促癌微环境
CAFs是肿瘤组织中ECM重塑的核心执行者,通过合成与分泌胶原蛋白、纤维连接蛋白、层粘连蛋白等ECM核心成分,同时释放MMPs、金属蛋白酶组织抑制剂(TIMPs)等调控因子,动态调控ECM的合成、降解与交联过程。这种重塑不仅改变ECM的物理特性,使其硬度增加、排列更致密,为肿瘤细胞提供机械支撑与运动轨迹,助力肿瘤细胞突破组织屏障实现侵袭转移;还会通过调控ECM的成分比例,影响肿瘤血管内皮细胞的迁移与增殖,间接促进肿瘤血管新生,同时降低化疗药物及免疫治疗药物向肿瘤核心区域的渗透效率,增强肿瘤的治疗抵抗性。
c)CAFs调控免疫细胞功能,塑造免疫抑制性肿瘤免疫微环境(TIME)
CAFs通过分泌CXCL12、IL-8、TGF-β、吲哚胺2,3-双加氧酶(IDO)等多种免疫调控因子,对TME内的免疫细胞群体进行精准调控,尤其影响肿瘤相关巨噬细胞(TAMs)、肿瘤相关中性粒细胞(TANs)、树突状细胞(DCs)及淋巴细胞的功能表型。例如,诱导TAMs向M2型免疫抑制表型极化、抑制DCs的抗原提呈能力,同时直接抑制效应性T细胞的活化与增殖,还可招募调节性T细胞(Tregs)富集于肿瘤组织。这些调控作用共同塑造了免疫抑制性TIME,帮助肿瘤细胞有效逃避免疫监视与免疫清除,为肿瘤的免疫逃逸提供关键支撑。
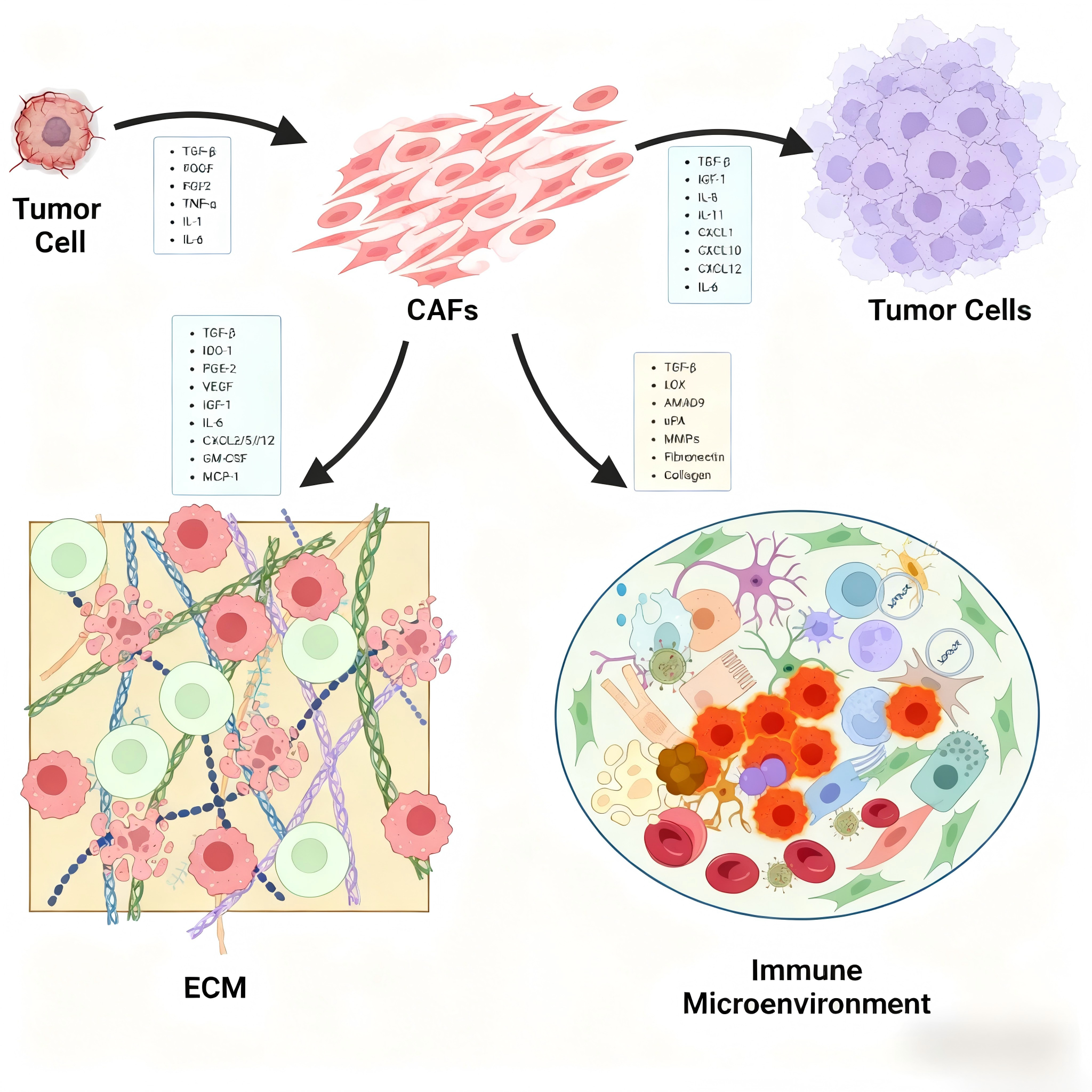 CAFs与TME的动态互作
CAFs与TME的动态互作
四、CAFs的分类
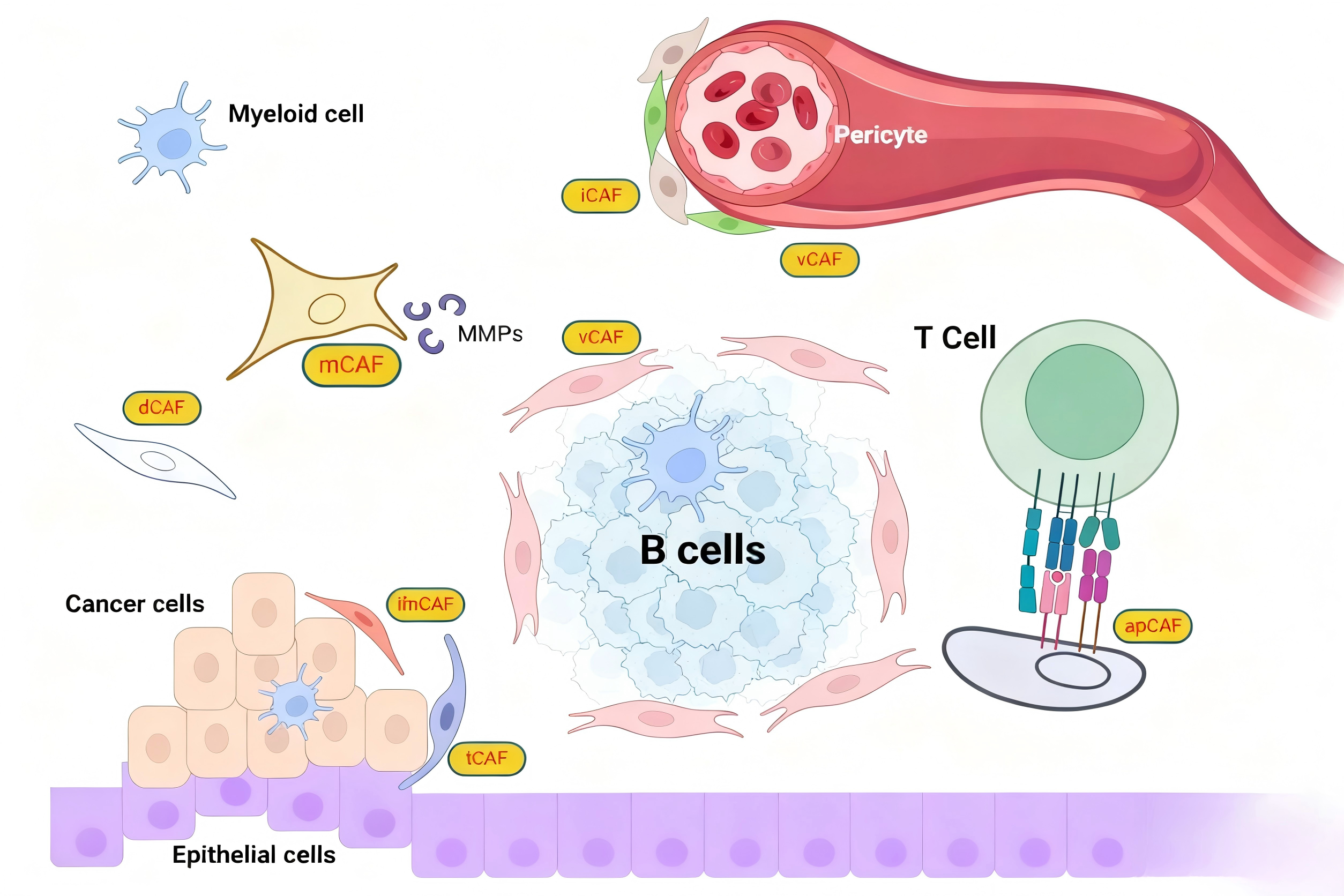
由于癌相关成纤维细胞(CAFs)具有高度异质性,研究者根据其在肿瘤微环境(TME)中的功能表型、分泌特征及定位差异,将其划分为多种亚型。不同CAF亚型在调控肿瘤恶性进展、免疫应答平衡及肿瘤组织结构稳定性等方面,扮演着独特且不可替代的角色,具体分类及功能如下:
iCAFs(炎性型CAFs)
iCAFs是一类以分泌炎性因子为核心特征的亚型,主要通过释放白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、肿瘤坏死因子α(TNF-α)等炎症相关细胞因子,调控TME内的炎性反应强度与方向,间接为肿瘤生长营造有利的炎性微环境,并参与免疫抑制调控。从分布来看,iCAFs通常富集于肿瘤边缘区域,除分泌炎性因子外,还能通过趋化作用招募巨噬细胞、中性粒细胞等免疫细胞,进一步重塑局部炎症微环境,加速肿瘤边缘侵袭与扩散。
rCAFs(调节型CAFs)
rCAFs的核心功能聚焦于调控肿瘤细胞的基础生物学行为,包括对肿瘤细胞增殖速率、分化状态及核心信号通路(如MAPK、PI3K/Akt)的调控作用。目前关于rCAFs的具体作用机制仍有待深入探索,但其在维持肿瘤组织稳态、调控肿瘤细胞与间质细胞互作平衡方面的潜在功能已被证实,可能成为干预肿瘤进展的潜在靶点。
dCAFs(发育型CAFs)
dCAFs的功能特征与胚胎发育相关信号通路密切关联,其激活与Wnt、Notch、Hedgehog等经典胚胎发育信号通路的异常激活密切相关。这类CAFs可能通过“发育重演”机制,模拟胚胎组织发育过程中的调控模式,为肿瘤细胞提供增殖优势与侵袭潜能,这一特征也揭示了肿瘤发生发展与正常组织发育过程之间潜在的分子机制相似性,为探索肿瘤起源提供了新的视角。
tCAFs(TGF-β型CAFs)
tCAFs以持续性高表达并分泌转化生长因子-β(TGF-β)为主要标识,而TGF-β作为多功能细胞因子,在肿瘤进展中发挥关键促癌作用:不仅能诱导免疫细胞向免疫抑制表型转化,强化免疫抑制微环境;还能促进上皮-间质转化(EMT),增强肿瘤细胞的侵袭与转移能力;同时可调控肿瘤细胞的耐药相关基因表达,提升肿瘤对化疗、靶向治疗的抵抗性,是介导肿瘤免疫逃逸与远处转移的核心介质之一。
vCAFs(血管型CAFs)
vCAFs是参与肿瘤血管生成与重塑的关键亚型,主要通过与血管内皮细胞、周细胞形成动态互作网络,调控新生血管的形成、成熟及肿瘤内血流动态。一方面,vCAFs可分泌血管内皮生长因子(VEGF)、成纤维细胞生长因子(FGF)等促血管生成因子,直接诱导内皮细胞增殖与血管芽生;另一方面,通过物理接触与旁分泌信号调控血管壁稳定性,为肿瘤组织提供充足的氧气、营养物质及代谢废物排出通道,保障肿瘤快速生长与转移需求。
ifnCAFs(干扰素型CAFs)
ifnCAFs的核心特征是能够合成并分泌干扰素(IFN)家族细胞因子,包括I型干扰素(IFN-α/β)及II型干扰素(IFN-γ)等,推测其可能参与TME内的抗病毒样免疫反应及免疫稳态调控。目前关于ifnCAFs的具体功能仍未完全明确,但其在部分癌症类型(如肺癌、结直肠癌)中可能通过调节免疫细胞活性,参与免疫微环境平衡调控,其作用机制有待进一步验证。
apCAFs(抗原呈递型CAFs)
apCAFs是一类具有潜在抗原呈递功能的特殊CAF亚型,其核心特征是可表达主要组织相容性复合体II类(MHC II)分子,打破了传统认知中“抗原呈递仅由免疫细胞完成”的局限。在特定TME条件下,apCAFs可通过MHC II分子与T细胞直接互作,参与T细胞活化或抑制调控,为理解肿瘤免疫调控网络提供了全新视角,同时因其独特的抗原呈递潜能,有望成为调节免疫疗法响应效率的新型靶点。
五、总结
综上,癌相关成纤维细胞(CAFs)作为肿瘤微环境中极具异质性的核心间质细胞,堪称推动肿瘤进展的“幕后推手”。其并非直接参与癌变过程,却通过多维度机制为癌细胞“保驾护航”——既可为肿瘤细胞提供增殖、侵袭所需的因子信号,又能主导细胞外基质重塑构建促癌微环境,还可调控免疫细胞功能塑造免疫抑制状态,全方位助力肿瘤恶性演进。尽管CAFs本身并非癌细胞,却是癌细胞依赖的关键“帮凶”,其复杂的亚型特征与功能异质性,既成为临床癌症治疗的重要阻力,也为开发针对性靶向疗法提供了多元潜在突破口,为改善癌症治疗效果开辟了新方向。
六、成纤维细胞(包括正常成纤维细胞及癌相关成纤维细胞(CAF))分泌的因子种类丰富,可根据功能分为以下六大类
每类典型因子列举如下:
-
细胞因子(炎性调控为主)
IL-6,IL-8,TGF-β,TNF-α,CXCL12,CCL2
-
生长因子(促增殖、血管生成为主)
FGF(成纤维细胞生长因子),VEGF(血管内皮生长因子),PDGF(血小板衍生生长因子),EGF(表皮生长因子)
-
基质重塑相关酶类
MMPs(基质金属蛋白酶),TIMPs(金属蛋白酶组织抑制剂)
-
细胞外基质(ECM)结构成分
胶原蛋白,纤维连接蛋白,层粘连蛋白,纤连蛋白
-
免疫调控因子
IDO(吲哚胺 2,3 - 双加氧酶),IFN(干扰素,主要为 ifnCAFs 分泌)
-
外泌体携带的功能性分子
微小 RNA(miRNA),环状 RNA(circRNA),功能性蛋白
七、成纤维细胞分泌因子检测哪里有?
乐备实提供的多因子检测平台(Luminex、MSD)可以检测成纤维细胞相关分泌因子。
| 货号 |
产品名 |
指标 |
| LXMH10-1 |
人炎症10因子Panel |
IFN-γ,IL-1β,IL-2,IL-4,IL-6,IL-8,IL-10,IL-12p70,IL-13,TNF-α |
| LXLBH40-1 |
人趋化因子/细胞因子-40因子Panel |
6Ckine/CCL21,BCA-1/CXCL13,CTACK/CCL27,ENA-78/CXCL5,Eotaxin/CCL11,Eotaxin-2/CCL24,Eotaxin-3/CCL26,Fractalkine/CX3CL1,GCP-2/CXCL6,GM-CSF,GRO-α (Gro-a/KC/CXCL1),Gro-β/CXCL2,I-309/CCL1,IFN-γ,IL-1β,IL-2,IL-4,IL-6,IL-8/CXCL8,IL-10,IL-16,IP-10/CXCL10,I-TAC/CXCL11,MCP-1/CCL2,MCP-2/CCL8,MCP-3/CCL7,MCP-4/CCL13,MDC/CCL22,MIF,MIG/CXCL9,MIP-1α/CCL3,MIP-1δ/CCL15,MIP-3α/CCL20,MIP-3β/CCL19,MPIF-1/CCL23,SCYB16/CXCL16,SDF-1α+β/CXCL12,TARC/CCL17,TECK/CCL25,TNF-α |
参考文献:
[1] X. Lan, W. Li, K. Zhao, J. Wang, S. Li, and H. Zhao, “Revisiting the role of cancer-associated fibroblasts in tumor microenvironment,” 2025, Frontiers Media SA. doi: 10.3389/fimmu.2025.1582532.
乐备实(上海优宁维生物科技股份有限公司旗下全资子公司),是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、PLA蛋白互作、多色免疫组化、DSP空间多组学等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。

 CAFs 的起源
CAFs 的起源 CAFs与TME的动态互作
CAFs与TME的动态互作












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


