摘要:
脓毒症是由感染引发宿主免疫反应失调,进而导致严重器官功能障碍、病死率极高的危重症,探寻安全有效的干预手段迫在眉睫。鉴于现有脓毒症相关药物临床试验多以失败告终,本研究通过噬菌体筛选技术,研发并验证了一种新型长效 C5a 阻断环状肽 Cp1,其通过靶向中和炎症上游关键分子 C5a,阻断其介导的炎症级联放大反应。感染早期应用 Cp1,可高效抑制炎症因子瀑布效应,遏制失控性全身炎症的发生发展,为脓毒症的防治提供新方向。
体外及体内研究验证,Cp1 对 C5a 具有高亲和力与高阻断选择性,且血浆稳定性优异,可实现长效全身循环。在盲肠结扎穿孔(CLP)脓毒症模型中,Cp1 显著降低血浆与腹腔灌洗液(PLF)内炎症因子、趋化因子的表达,改善先天免疫损伤;单次给药即可显著降低模型小鼠的细菌负荷,缓解器官功能障碍,延长其生存时间。综上,新型环状肽药物 Cp1 在脓毒症的预防与治疗中展现出显著优势,兼具良好的应用前景与成本竞争力。
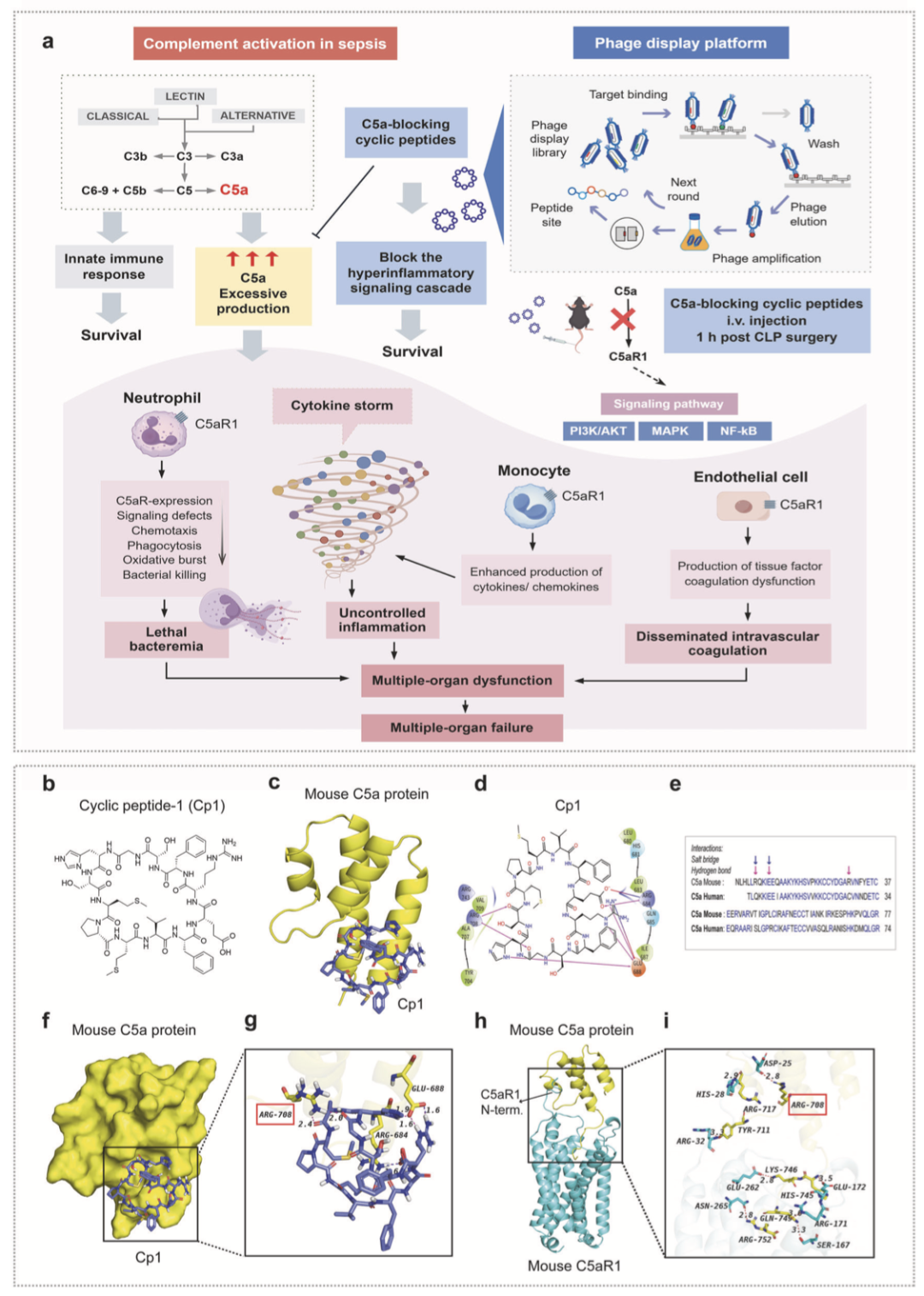
实验结果 1 分子对接与结合模式分析解析 mC5a 与 Cp1 的相互作用机制。
为阐明 Cp1 相较其线性对照肽 K1 具备更高结合亲和力与特异性的结构基础,本研究采用分子对接及结合模式分析,系统解析了 mC5a 蛋白与 Cp1 的分子相互作用模式。分子对接结果以多维度图示呈现,包括 mC5a-Cp1 复合物的卡通示意图(图 1c)、二维相互作用图(图 1d)、蛋白表面结合图(图 1f)及三维精细结构模型(图 1g)。其中,mC5a 蛋白主链骨架以黄色标识,氮原子、氧原子与氢原子分别以蓝色、亮红色及白色渲染,Cp1 则以紫色棒状模型展示;氢键与盐桥相互作用分别以洋红色虚线与蓝色虚线标示。此外,小鼠 C5a 与人源 C5a 的序列比对结果,明确了潜在介导 Cp1 结合选择性的关键氨基酸残基(图 1e)。
结构分析显示,Cp1 与 mC5a 之间形成 6 个氢键与 2 个盐桥。具体而言,Cp1 的多个羰基作为氢键受体,与 mC5a 的 ARG708 残基形成两条氢键,键长分别为 2.0Å 与 2.4Å;Cp1 咪唑环上的氮原子作为氢键供体,与 mC5a 的 GLU688 残基形成键长为 1.9Å 的氢键;Cp1 的羧基氧作为氢键受体,与 mC5a 的 ARG684 残基形成 1.6Å 的氢键;Cp1 的多个氨基作为氢键供体,与 GLU688 残基形成两条键长均为 1.6Å 的氢键。同时,Cp1 还分别与 mC5a 的 ARG684 及 GLU688 残基形成两条盐桥。与之相比,K1 与 mC5a 的结合位点存在显著差异,其形成的氢键相互作用强度显著偏弱,键长分别为 2.6Å、3.1Å、2.9Å、3.0Å、2.9Å 与 2.9Å。
研究进一步解析了 mC5a 与 C5aR1 的结合模式(图 1h、i),三维结构模型显示二者共形成 7 条氢键。值得注意的是,Cp1 与 mC5a 的 ARG708 所形成的两条高亲和力氢键(2.0Å、2.4Å),可竞争性干扰 mC5a 的 ARG708 与 C5aR1 的 ASP25 之间的相互作用(键长 2.8Å),进而有效阻断 mC5a-C5aR1 的信号传导。综上,Cp1 与 mC5a 的相互作用强度显著优于线性肽 K1,其独特的结合位点可更高效地阻断 mC5a 与受体 C5aR1 的结合,这为 Cp1 结合亲和力的提升提供了核心结构依据。从分子机制层面,环状肽的环化策略可增强肽 - 蛋白相互作用间的静电屏蔽效应,同时 C5a 蛋白的疏水区域可协同降低 Cp1 的溶剂可及性,最终赋予其优异的血浆稳定性。
实验结果 2 新型 C5a 靶向阻断肽的筛选与鉴定
以重组小鼠 C5a 蛋白为包被抗原,借助噬菌体展示肽库技术,从十二肽随机库中开展靶向结合肽的高通量筛选。经三轮亲和富集与筛选后,随机挑选八十个阳性单克隆进行 DNA 测序,最终获得七条特异性候选结合序列。
以重组小鼠 C5a 蛋白为包被抗原,借助噬菌体展示肽库技术,从十二肽随机库中开展靶向结合肽的高通量筛选。经三轮亲和富集与筛选后,随机挑选八十个阳性单克隆进行 DNA 测序,最终获得七条特异性候选结合序列。
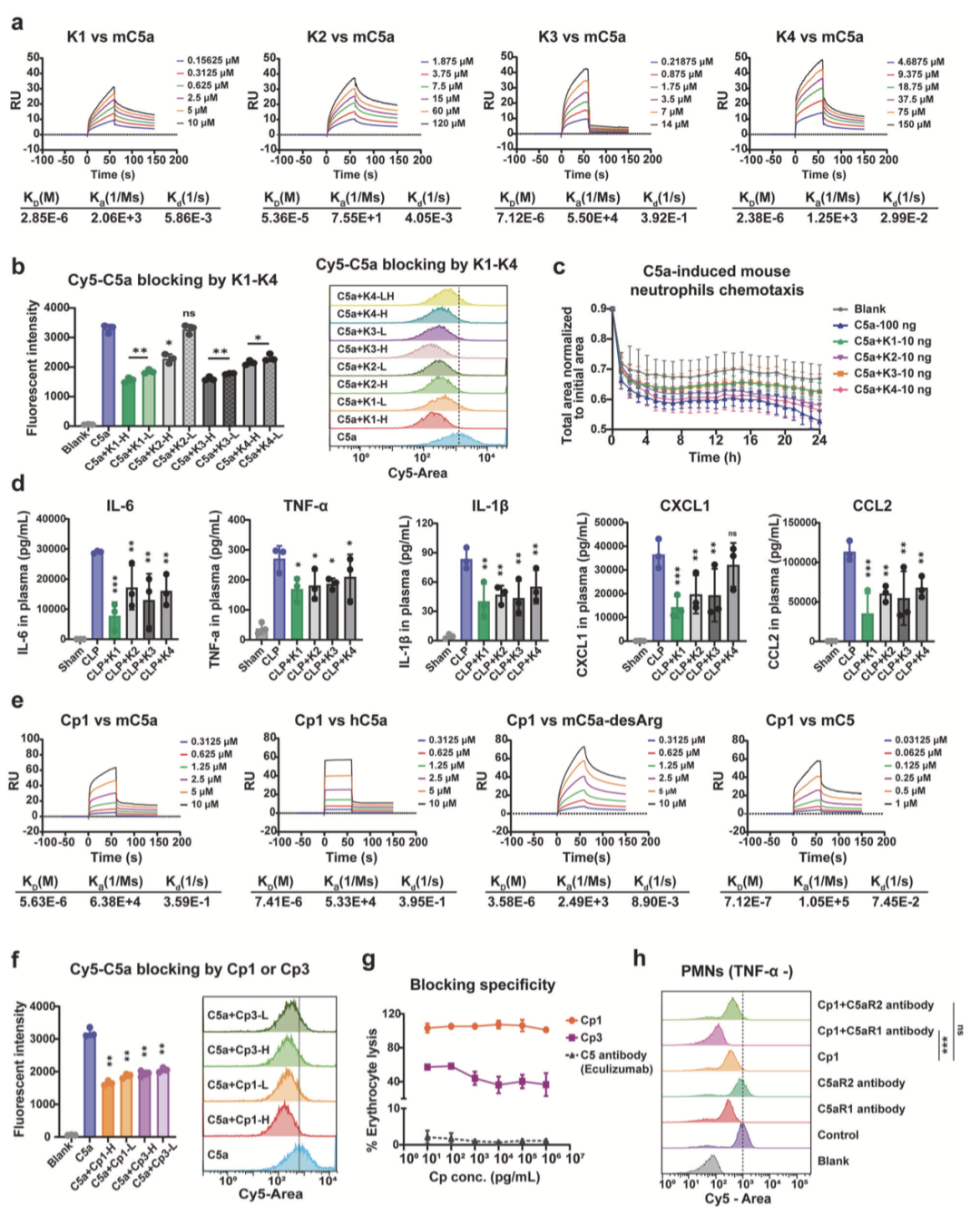
采用生物层干涉技术(BLI)进行初步亲和力快速筛查,测得候选线性肽 K1–K5 的平衡解离常数(KD)分别为 5.94×10⁻⁶ M、1.73×10⁻⁵ M、1.10×10⁻⁴ M、8.50×10⁻⁴ M 及 1.09×10⁻² M。在此基础上,通过表面等离子体共振技术(SPR)对亲和力相对优异的线性肽 K1–K4 开展精确验证,其与小鼠 C5a 的 KD 值分别为 2.85×10⁻⁶ M、5.36×10⁻⁵ M、7.12×10⁻⁶ M 和 2.38×10⁻⁶ M(图 2a)。
综合亲和力与成药性评估,K1 与 K3 的水溶性显著优于 K2、K4,更适用于脓毒症小鼠模型的系统性给药研究,因此被选定为后续结构优化的先导序列。
实验结果 3 线性靶向肽的 C5a 阻断活性验证
为评估候选线性肽对 C5a 的功能性阻断效应,采用高表达 C5aR1 的小鼠中性粒细胞,开展竞争性结合实验。流式细胞术检测结果表明,K1 与 K3 对 Cy5 标记 C5a 的竞争性阻断效能显著优于 K2 和 K4(图 2b)。
在 C5a 介导的中性粒细胞趋化实验中,借助 IncuCyte ZOOM® 活细胞成像系统,对体系内总残留细胞面积进行实时动态监测,结果进一步证实,K1 和 K3 的体外阻断活性显著强于 K2 与 K4(图 2c)。
构建小鼠脓毒症模型并进行体内药效评价,给药 24 小时后采用酶联免疫吸附试验(ELISA)检测血浆中炎症细胞因子及趋化因子水平,结果显示 K1 和 K3 的体内抗炎作用同样优于 K2 和 K4(图 2d)。综合体外阻断效能与体内抗炎活性,选定 K1 与 K3 作为后续结构优化与功能验证的先导肽。
实验结果4 环化策略对线性肽结合亲和力、阻断特异性及血浆稳定性的影响
为提升线性肽K1、K3的结合亲和力、结构稳定性及体内阻断效力,作者对其进行头尾环化修饰,得到环状变体Cp1、Cp3。表面等离子体共振技术检测显示,Cp1、Cp3与mC5a的结合亲和力KD值分别为5.63×10⁻⁶、3.23×10⁻⁶(图2e);Cp1与人源C5a(KD=7.41×10⁻⁶)的结合动力学特性与mC5a相近,且可结合小鼠C5a-desArg(KD=3.58×10⁻⁶)及小鼠C5(KD=7.12×10⁻⁷)(图2e),体外竞争性结合实验进一步验证了二者对mC5a的阻断效力(图2f)。
溶血实验评估Cp1结合特异性显示,阳性对照依库珠单抗可完全抑制溶血,Cp1组羊红细胞近100%溶血,表明其结合C5a不干扰C5裂解及终末膜复合物(MAC)形成(图2g);而Cp3组出现部分溶血,提示其结合特异性弱于Cp1(图2g)。流式细胞术结果证实(图2h),Cp1可选择性阻断C5a-C5aR1相互作用,不影响抗C5aR1抗体对Cy5-C5a与中性粒细胞结合的抑制作用。
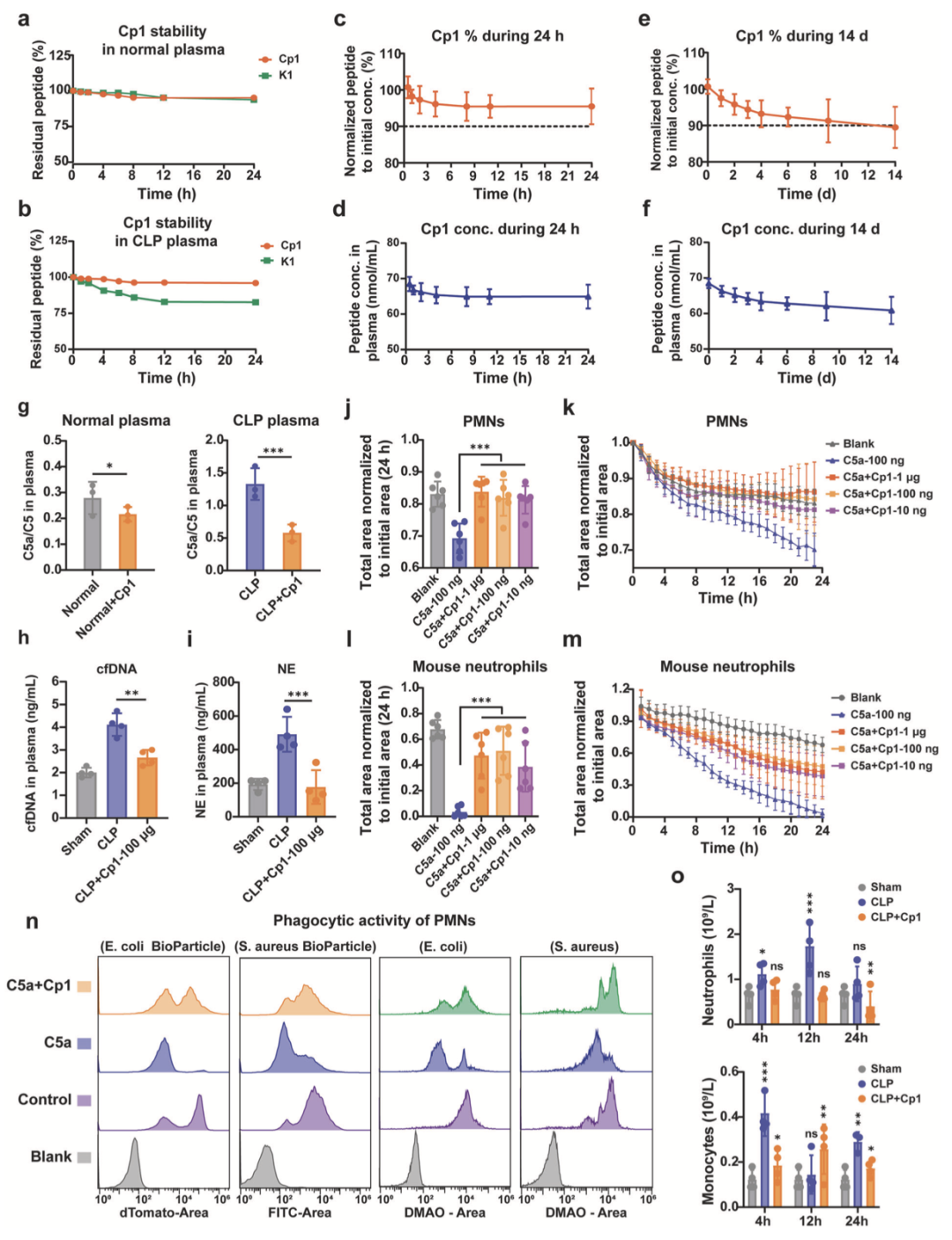
37℃条件下,采用正常小鼠及CLP模型小鼠50%(v/v)血浆评估Cp1与K1的稳定性,HPLC结果显示,二者在正常血浆中稳定性相当,而环化修饰显著提升K1在CLP血浆中的稳定性,孵育24小时后Cp1保留率超95%(图3a, b)。正常小鼠药代动力学研究显示(100μg/20g Cp1),Cp1在24小时内缓慢消除,给药14天后血浆初始浓度(68 nmol/mL)保留率仍达90%(图3c-f)。
实验结果5 Cp1处理能有效抑制C5a驱动的中性粒细胞招募与活化
通过测定正常小鼠及CLP模型小鼠血浆中C5a/C5比值,评估Cp1对C5a的体内中和效应。结果显示,Cp1处理可降低C5a/C5比值,且该效应在CLP模型小鼠中更为显著,证实Cp1能有效中和体内小鼠C5a(图3g)。
中性粒细胞是脓毒症病理生理级联反应的关键效应细胞,其功能贯穿疾病全程。补体裂解产物C5a通过C5a-C5aR轴调控中性粒细胞的活化、趋化及吞噬功能。采用qPCR和ELISA法,测定100μg/20g剂量Cp1给药后血浆游离DNA(cfDNA)及中性粒细胞弹性蛋白酶(NE)水平。图3h、i定量结果显示,Cp1给药可显著降低血浆cfDNA(↓68%)和NE(↓100%)水平,直接证实其可抑制中性粒细胞活化及呼吸爆发,抑制率以假手术组(设为0%)为基准计算。
趋化实验采用IncuCyte ZOOM®活细胞成像系统进行监测与定量分析,图3k、m中y轴“各组初始面积归一化总面积”指同一视野内各时间点细胞总面积与0小时初始面积的比值,比值越高提示细胞迁移活性越低。结果显示,Cp1以剂量依赖性方式抑制C5a驱动的PMNs及小鼠中性粒细胞募集,证实其对C5a具有有效阻断作用(图3k、m);图3j、l分别为图3k、m的24小时定量结果。
采用流式细胞术,借助红色大肠杆菌生物颗粒™和绿色金黄色葡萄球菌生物颗粒™定量分析PMNs吞噬功能,随后利用活体大肠杆菌(革兰氏阴性菌)和金黄色葡萄球菌(革兰氏阳性菌)进一步验证。C5a刺激6小时后,生物颗粒及活菌实验中C5a诱导的荧光信号均显著降低,该效应可通过Cp1预孵育缓解(图3n)。等效C5a剂量下,PMN对金黄色葡萄球菌的吞噬效率下降幅度小于大肠杆菌,推测其原因在于:金黄色葡萄球菌清除依赖C5a非敏感途径,而大肠杆菌清除高度依赖补体-活性氧轴,该轴可被C5a干扰。上述结果共同表明,Cp1能有效缓解C5a诱导的PMN吞噬功能障碍。
实验结果 6 Cp1 处理显著抑制 CLP 诱导脓毒症小鼠血浆及腹腔冲洗液(PLF)中炎症因子与趋化因子的表达
血液学分析显示 CLP 术后不同组别中性粒细胞与单核细胞的动态变化。CLP 组循环中性粒细胞数量术后 4h 较假手术组升高 70%,12h 达峰值,较假手术组升高 265%;Cp1 处理组中性粒细胞无显著激增,12h 绝对计数较 CLP 组下降 63%。CLP 组绝对单核细胞计数 4h 达首峰,较假手术组升高 148%;Cp1 处理组单核细胞峰值延迟至 12h,较假手术组升高 69%,计数较 CLP 组 4h 峰值降低 38%(图 3o)。
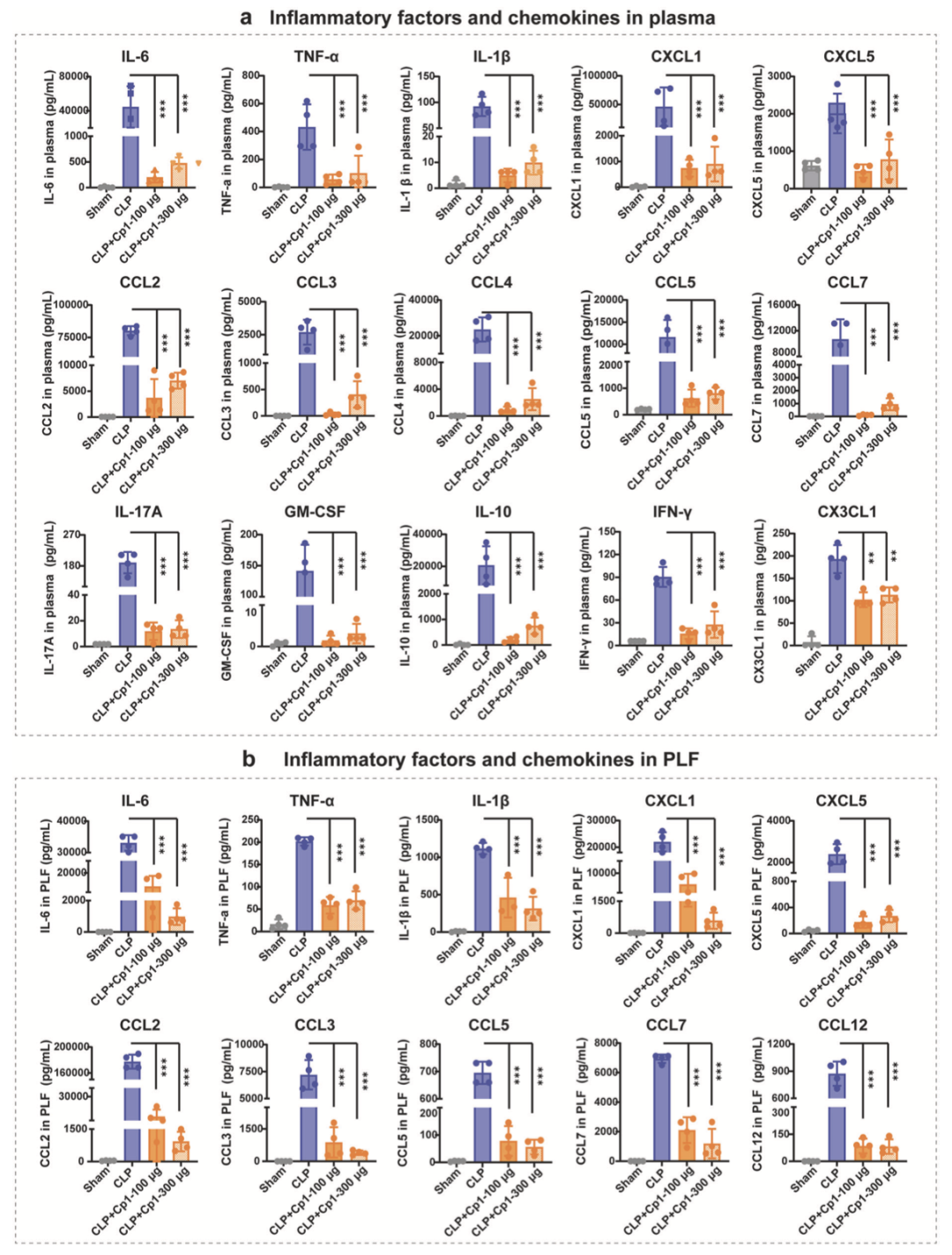
通过定量检测血浆及腹腔冲洗液中促炎细胞因子与趋化因子,评估 Cp1 对 C5a 介导炎症级联反应的抑制作用。CLP 术后 24h,100μg/20g Cp1 处理使血浆促炎因子 IL-6、TNF-α、IL-1β 分别下降 99%、86%、94%;单核细胞趋化因子 CCL2、CCL3、CCL4、CCL5、CCL7 分别下降 21.7 倍、81.9 倍、24.8 倍、18.6 倍、102.3 倍;中性粒细胞趋化因子 CXCL1、CXCL5 分别下降 61.7 倍、4.3 倍;IL-17A、IFN-γ、GM-CSF、CX3CL1 水平亦显著降低(图 4a)。腹腔冲洗液中,Cp1 处理使 IL-6、TNF-α、IL-1β 分别下降 73%、77%、62%,CXCL1、CXCL5、CCL2、CCL3、CCL5、CCL7、CCL12 分别下降 75%、94%、96%、87%、89%、69%、90%(图 4b),抑制率以假手术组为 0% 基准计算。
Cp1 对血浆细胞因子的抑制作用显著优于等剂量 K1。100μg/20g K1 使血浆 IL-6、TNF-α、IL-1β 分别降低 3.7 倍、1.5 倍、2.0 倍(图 2d);而同剂量 Cp1 分别降低 220.5 倍、7.5 倍、18.6 倍(图 4a),验证了环化修饰的体内优势。300μg 高剂量 Cp1 亦可显著抑制血浆及肝脏组织中炎症因子与趋化因子表达(图 4)。
剂量滴定结果显示,100μg 为具有显著药理活性的最低有效剂量,后续动物实验均采用该剂量。图 3o 与图 4 结果共同证实,Cp1 通过阻断 C5a 介导的先天免疫细胞募集与过度活化,有效抑制脓毒症小鼠体内炎症因子与趋化因子的表达,缓解早期炎症反应。
实验结果7 Cp1治疗可有效预防CLP诱导的脓毒症小鼠出现器官功能障碍
脓毒症高死亡率主要源于重要器官损伤及急性衰竭。Cp1治疗可有效降低血清丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)水平,提示其对肝功能具有保护作用(图5a)。与未治疗CLP小鼠相比,Cp1处理组血清肾损伤标志物尿素(UREA)和肌酐(CREA)水平显著降低(图5b)。血清乳酸脱氢酶(LDH)和乳酸(LAC)升高提示组织损伤,Cp1处理组二者水平显著下降,进一步证实其强大的器官保护效能(图5c)。
脓毒症中补体-凝血系统相互作用促进疾病进展,常伴随消耗性凝血病,表现为凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)升高,凝血酶时间(TT)延长及纤维蛋白原(Fbg)异常。靶向阻断C5a可同时抑制过度炎症反应及脓毒症相关凝血功能障碍。如图5d所示,Cp1通过靶向阻断C5a,显著减轻脓毒症对凝血及纤溶系统的病理损伤。
此外,Cp1可有效保护脓毒症小鼠肺损伤,显著改善脓毒症诱导的肺血管渗漏,减轻肺泡出血、隔膜增厚及炎症浸润等标志性病理改变(图5e)。与CLP组相比,Cp1处理后循环内皮损伤标志物VCAM-1、E-选择素和PAI-1水平分别下降100%、71%和93%(图5f)。同时,Cp1处理组肺内皮完整性显著改善,表现为肺湿干比(W/D比)下降85%、HAS渗漏量(BALF/血清比)下降83%及伊文思蓝渗漏量(肺液/血清比)下降54%,上述指标共同证实Cp1对内皮细胞的保护作用(图5g–i)。
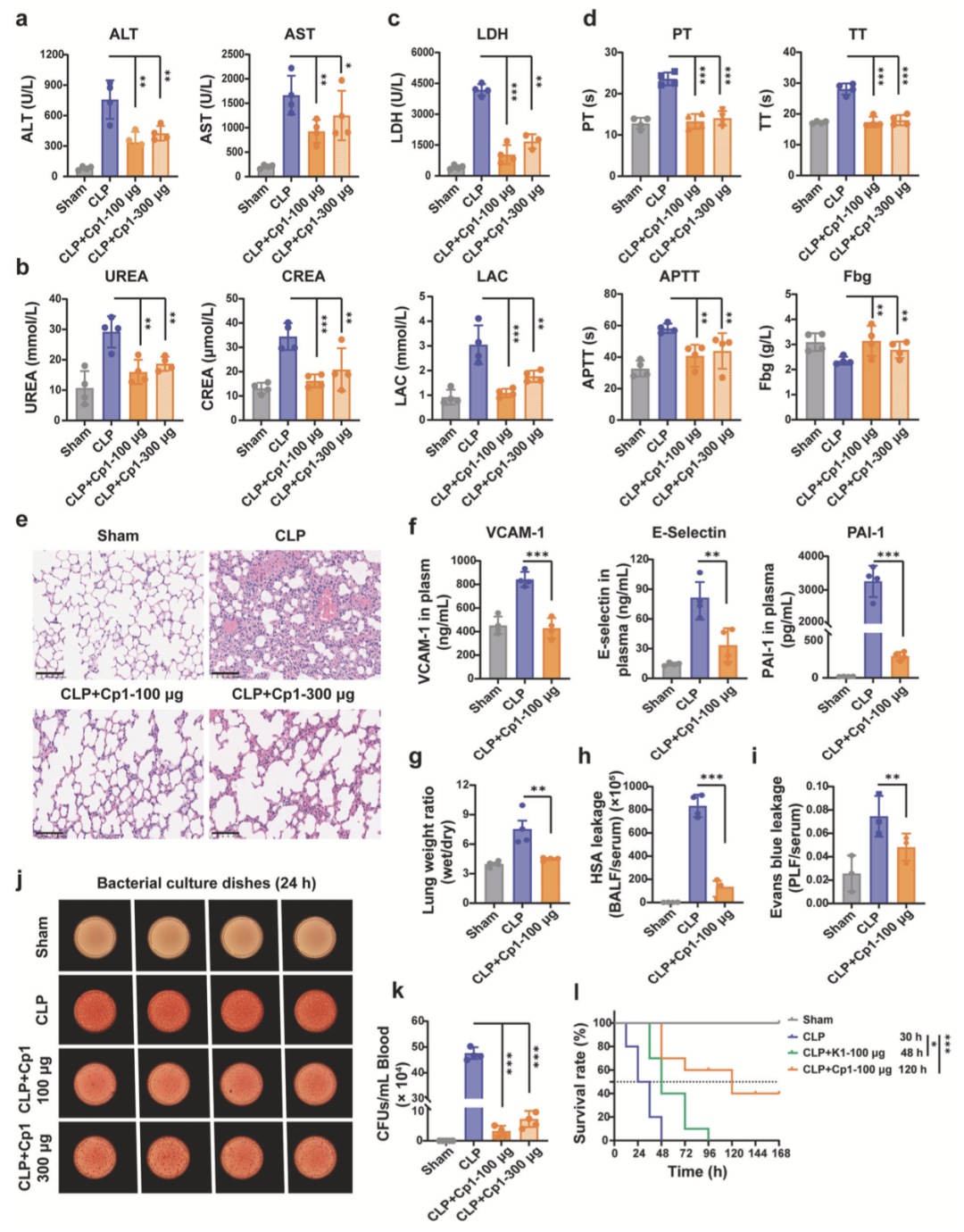
实验结果8 Cp1治疗能有效控制细菌负荷,并显著延长CLP诱导的脓毒症小鼠的存活时间
为评估Cp1对脓毒症期间全身细菌播散的调控效果,对CLP模型小鼠外周血样本进行定量细菌培养。24小时细菌培养及菌落形成单位(CFU)计数结果显示(图5j, k),与CLP组相比,100μg和300μg剂量Cp1处理分别使脓毒症小鼠细菌负荷降低93%和86%,提示Cp1通过早期靶向阻断C5a介导免疫调节,可恢复机体免疫平衡,并显著增强脓毒症小鼠的细菌清除能力。
采用Kaplan-Meier法,分析单次给予100μg/20g剂量Cp1或K1后脓毒症小鼠的存活情况,以确认动物死亡为判定标准。结果显示(图5l),CLP组、CLP+K1组及CLP+Cp1组的7天存活率分别为0%、0%和60%;三组中位生存时间分别为30小时、48小时和120小时。CLP+Cp1组存活率及中位生存时间显著提升,证实Cp1的有效干预作用,提示C5a阻断是脓毒症预防与治疗的可行策略。
实验结果9 Cp1治疗可有效清除继发感染
为探究短期药物暴露对继发感染反应的影响,比较CLP术后24小时Cp1组与CLP对照组的LPS反应性(图6a)。结果显示(图6b),LPS刺激2小时后,Cp1组IL-6水平较CLP对照组显著升高,提示脓毒症中期(24小时)的Cp1暴露,可对CLP处理小鼠的LPS反应性发挥有益调节作用。
为评估长期药物暴露对继发感染反应的影响,LPS模型小鼠经Cp1暴露14天后,进行活菌静脉注射(图6c)。菌落计数结果显示(图6d、e),与未处理对照组相比,Cp1长期(14天)暴露后,仍可有效清除新发感染。
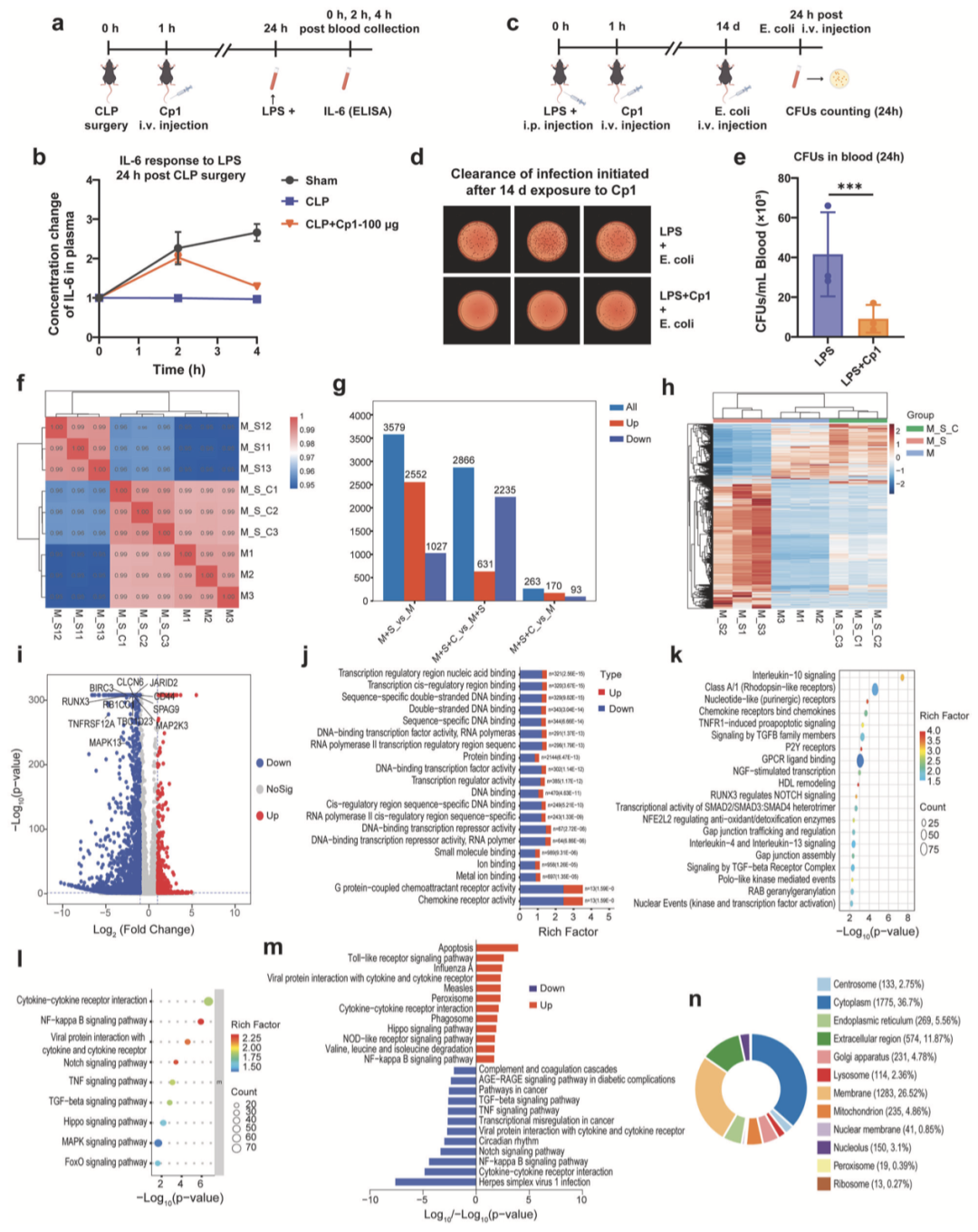
实验结果10 Cp1处理可阻断并重塑C5a诱导的外周单核细胞基因表达改变
为探究Cp1靶向阻断C5a-C5aR1对下游信号通路的调控效应,于人外周血单核细胞(PBMCs)经C5a刺激后进行RNA测序分析。差异表达基因(DEGs)筛选标准为|log2FoldChange|≥1且P<0.05。如图6f所示,各组样本均表现出高度组内一致性。C5a刺激可诱导PBMCs中2552个DEGs上调(图6g);而经Cp1预处理后,2235个DEGs显著下调(图6g),使Cp1处理组基因表达谱与未处理对照组趋于一致(图6h)。
火山图进一步标注了Cp1预孵育后关键下调DEGs,其功能与炎症调节、促炎细胞因子分泌、免疫细胞招募增强及白细胞存活延长相关(图6i)。GO富集分析显示,DEGs中排名前20的分子功能(MF)术语中,G蛋白偶联趋化因子受体活性下调具有最高统计学显著性,为Cp1对C5a-C5aR1轴的精准阻断提供了强有力的基因水平证据(图6j)。
Reactome通路富集分析泡状图显示,与GPCR配体结合相关的DEGs发生最显著改变,进一步证实Cp1的精准阻断作用(图6k)。KEGG信号通路富集分析表明,这些DEGs与C5a关键下游信号级联显著重叠,包括炎症反应、细胞凋亡及细胞迁移通路(图6l, m)。
此外,亚细胞定位分析显示,差异表达基因主要分布于膜结合区及细胞外区室,提示该基因表达改变可能源于Cp1预孵育介导的细胞外受体相关信号通路重塑(图6n)。综上,生物信息学分析证实,Cp1处理可阻断并重塑PBMCs中C5a诱导的基因表达谱,为本研究体外及体内实验结果提供了具有说服力的转录组水平依据。
实验结果11 Cp1表现出令人满意的生物安全性
通过体外及体内实验,系统评估新型环状肽药物Cp1的生物安全性特征。细胞毒性检测结果显示,梯度浓度Cp1孵育后,细胞活力未发生显著下降。血浆细胞因子谱分析及血液学检测表明,Cp1未诱发免疫毒性及急性骨髓抑制。血液生化分析与组织病理学检查进一步证实,Cp1未引发肝肾功能毒性及组织损伤。综合上述实验数据,证实Cp1具备良好的生物安全性。
脓毒症相关的炎症因子检测哪里有?
LabEx提供脓毒症相关炎症因子、趋化因子检测服务:
| 货号 | 产品名 | 检测指标 |
| LXLBH10-1 | 人炎症10因子Panel | IL-1 β/IL-1F2,IL-2,IL-4,IL-6 ,IL-8/CXCL8,IL-10,IL-12 p70,IL-13,TNF-α,IFN-γ |
| LXLBM31-1 | 小鼠趋化因子-31因子Panel | BCA-1/CXCL13,CTACK/CCL27,ENA-78/CXCL5,Eotaxin/CCL11,Eotaxin-2/CCL24,Fractalkine/CX3CL1,GM-CSF,I-309/CCL1,IFN-γ,IL-1β,IL-2,IL-4,IL-6,IL-10,IL-16,IP-10/CXCL10,I-TAC/CXCL11,KC/CXCL1,MCP-1/CCL2,MCP-3/CCL7,MCP-5/CCL12,MDC/CCL22,MIP-1α/CCL3,MIP-1β/CCL4,MIP-3α/CCL20,MIP-3β/CCL19,RANTES/CCL5,SCYB16/CXCL16,SDF-1α/CXCL12,TARC/CCL17,TNF-α |
| LXLBR10-1 | 大鼠炎症10因子Panel | IL-1 β/IL-1F2,IL-2,IL-4,IL-5,IL-6 ,IL-10,IL-12p70,CXCL1/GRO/α/KC/CINC-1,IFN-γ,TNF-α |












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


