一、引言
(一)NAFLD的全球流行现状与临床挑战
非酒精性脂肪性肝病(NAFLD)是一种以肝脏脂肪变性、胰岛素信号障碍为核心特征的慢性代谢性疾病,其发病与饮食结构转变、生活方式改变密切相关。近年来,全球NAFLD患病率持续攀升,在成人群体中尤为显著,已成为威胁人类健康的重要公共卫生问题。然而,NAFLD的发病机制尚未完全阐明,目前尚无获批用于临床治疗的特效药物,开发安全有效的干预策略已成为亟待解决的医学难题。
(二)肠肝轴在NAFLD中的作用机制
大量研究证实,肠道微生物群通过"肠肝轴"在NAFLD的发生发展中发挥关键调控作用。肠道菌群结构失衡及其代谢产物异常可直接或间接诱导肝脏脂质堆积、炎症反应及胰岛素抵抗,NAFLD及非酒精性脂肪性肝炎(NASH)患者均存在不同程度的肠道菌群紊乱,这为从"肠道-肝脏"调控角度干预NAFLD提供了重要理论依据。
Bao Y, Shang X, et al. Stevia rebaudiana root polysaccharide modulates liver metabolism, bile acid, and gut microbiota improving HFD-induced NAFLD: Potential roles of ACSL1 and FADS2. Phytomedicine. 2025 Jun;141:156680.
(三)甜菊根多糖的研究基础与科学问题
甜叶菊作为菊科多年生植物,自1887年被发现以来一直作为天然甜味剂广泛应用。甜菊根多糖(SRRP)是从甜菊根中提取的水溶性菊粉型多糖,平均分子量为5400 Da,化学结构包含果糖与葡萄糖主链,且存在Glcp-(1→、Fruf-(2→和→1)-Fruf-(2→)三种特征性化学键。前期研究已证实SRRP具有调节肠道微生物组成、改善血糖血脂的潜在功效,但其一降低血脂的具体机制及对NAFLD的干预作用与分子路径尚未得到充分解析,这也是本研究的核心切入点。

二、材料与方法
(一)实验动物与模型构建
选取健康雄性小鼠,随机分为正常饮食组(NC组)、高脂饮食组(HFD组)、SRRP低剂量组(SRRP-L组)、SRRP中剂量组(SRRP-M组)、SRRP高剂量组(SRRP-H组)及阳性对照组(ATV组)。除NC组给予普通饲料外,其余各组均给予高脂饲料构建NAFLD模型。从实验第9周开始,SRRP各剂量组通过灌胃方式给予相应浓度SRRP干预,ATV组给予阳性药物,持续干预至第16周。
(二)检测技术与方法
1. 病理与生化指标检测:采用H&E染色、油红O染色观察小鼠附睾脂肪组织及肝脏组织病理形态;通过生化检测试剂盒测定血清TC、TG、LDL、HDL、ALT、AST及肝脏SOD、GSH-PX、MDA、ox-LDL等指标水平。
2. 炎症因子检测:采用酶联免疫吸附试验(ELISA)检测血清中IL-6、IL-1β、MCP-1、TNF-α等促炎因子表达水平。
3. 肠道菌群分析:收集小鼠粪便样本,提取微生物总DNA,通过16S rRNA基因测序解析肠道微生物群落结构及多样性。
4. 代谢组学检测:采用UPLC-MS/MS技术定量分析小鼠肝脏组织差异代谢物及血清胆汁酸谱。
5. 分子机制验证:通过Western Blot实验检测肝脏组织中ACSL1、FADS2等关键代谢酶的蛋白表达水平。
(三)统计学分析
所有实验数据采用SPSS 22.0软件进行统计分析,计量资料以"均值±标准差(mean±S.D.)"表示,组间比较采用单因素方差分析(ANOVA),P<0.05表示差异具有统计学意义。
三、结果
(一)SRRP降低NAFLD小鼠体重与血脂,改善葡萄糖代谢
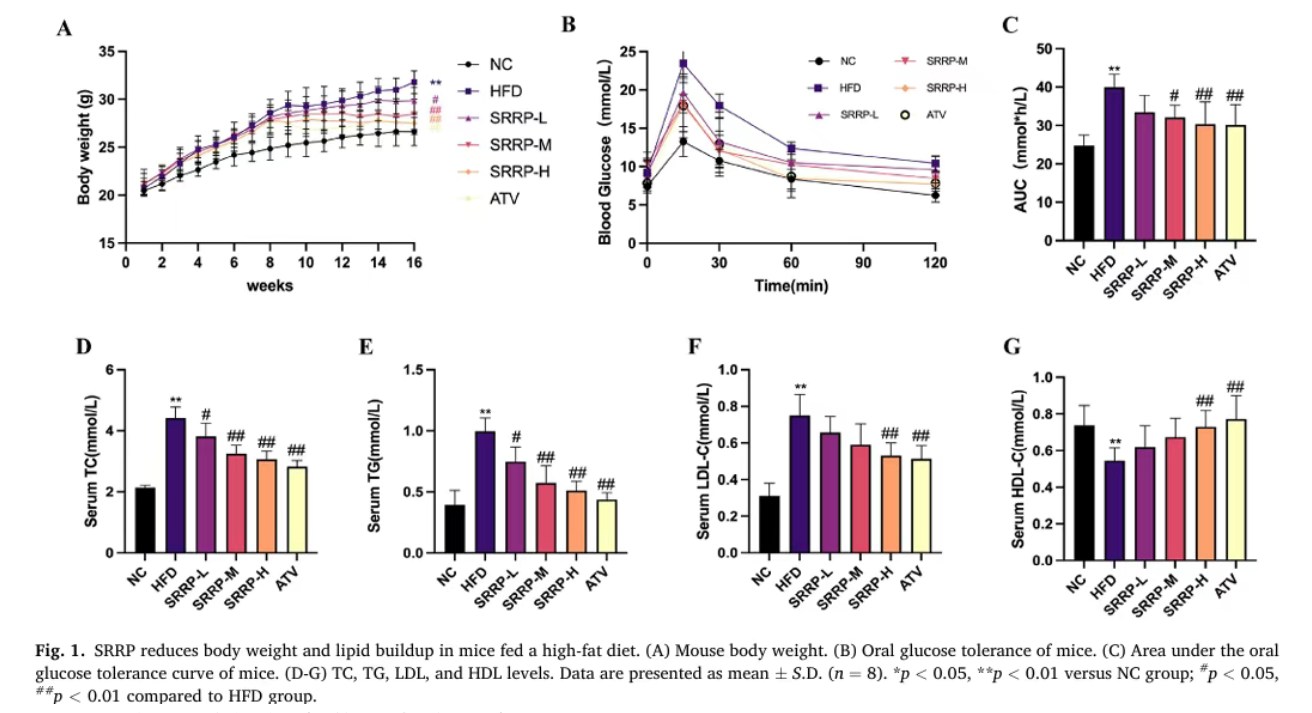
干预至第16周,SRRP-H组小鼠体重显著低于HFD组,且接近NC组水平。生化检测结果显示,HFD组小鼠血清TC、TG、LDL水平显著升高,HDL水平降低,而SRRP高剂量干预可显著逆转这一趋势,使血脂指标恢复至接近正常水平。同时,SRRP干预明显缓解了高脂饮食引发的葡萄糖代谢障碍,增强了小鼠血糖调节能力(口服葡萄糖耐量试验结果显示AUC值显著降低)。
Bao Y, Shang X, et al. Stevia rebaudiana root polysaccharide modulates liver metabolism, bile acid, and gut microbiota improving HFD-induced NAFLD: Potential roles of ACSL1 and FADS2. Phytomedicine. 2025 Jun;141:156680.
(二)SRRP减轻肝脏氧化应激与炎症反应
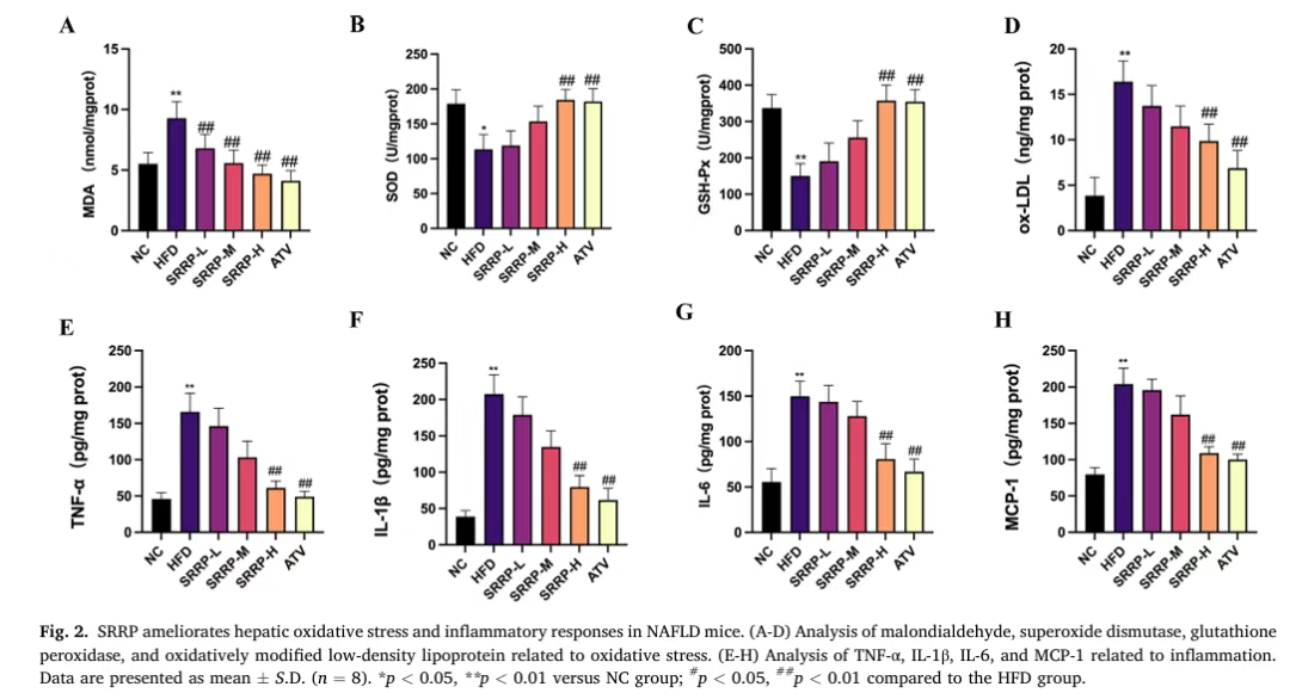
HFD组小鼠肝脏SOD、GSH-PX活性显著降低,MDA、ox-LDL水平显著升高,表明肝脏存在明显氧化损伤;SRRP以剂量依赖性方式逆转了这些变化,有效增强肝脏抗氧化能力。ELISA检测结果显示,HFD组小鼠血清IL-6、IL-1β、MCP-1、TNF-α等促炎因子水平显著上调,而SRRP干预可显著降低这些炎症标志物表达,减轻肝脏炎症状态。
Bao Y, Shang X, et al. Stevia rebaudiana root polysaccharide modulates liver metabolism, bile acid, and gut microbiota improving HFD-induced NAFLD: Potential roles of ACSL1 and FADS2. Phytomedicine. 2025 Jun;141:156680.
(三)SRRP减少白色脂肪堆积与肝脏脂质沉积
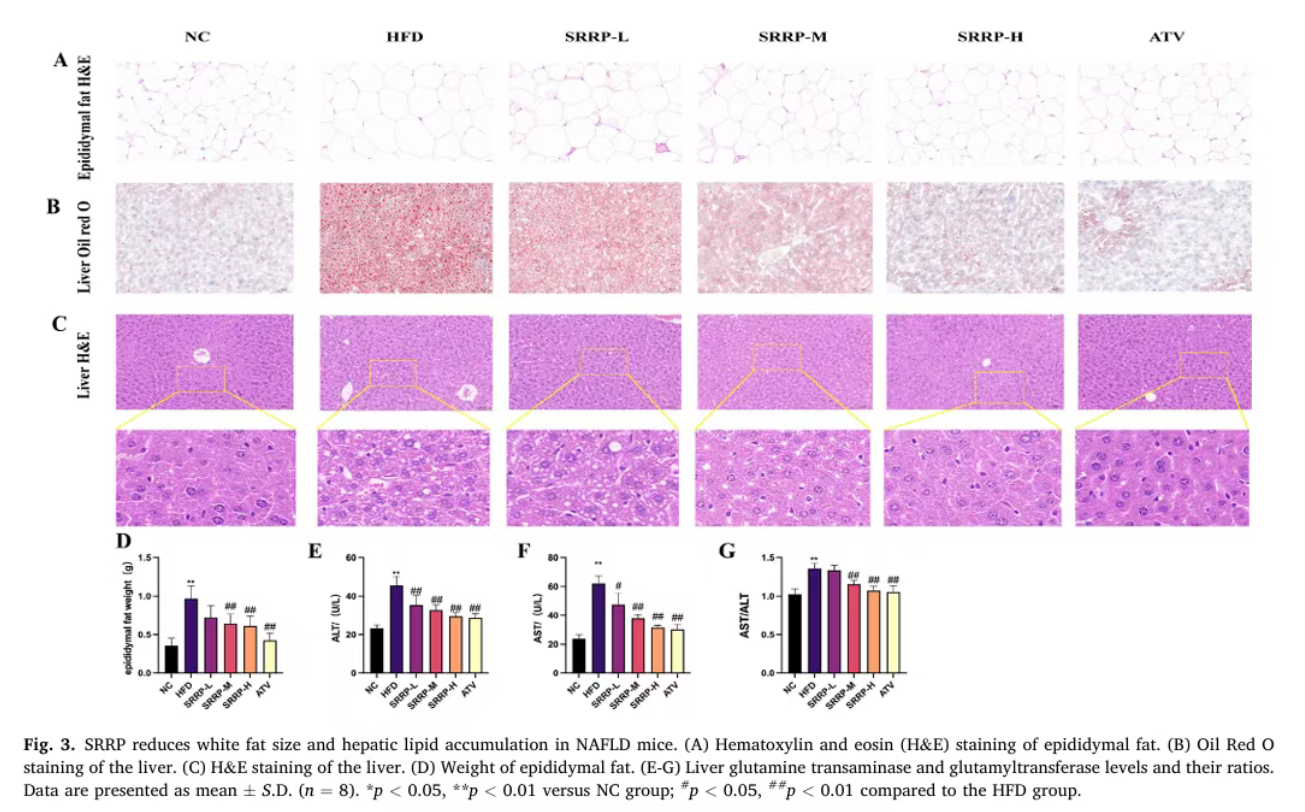
H&E染色结果显示,SRRP干预可有效减小HFD诱导的小鼠白色脂肪液泡直径,降低附睾脂肪重量;H&E染色与油红O染色观察发现,SRRP显著减少了肝内脂质沉积。同时,SRRP还能改善高脂饮食诱导的ALT、AST水平及AST/ALT比值升高,减轻肝脏损伤。
Bao Y, Shang X, et al. Stevia rebaudiana root polysaccharide modulates liver metabolism, bile acid, and gut microbiota improving HFD-induced NAFLD: Potential roles of ACSL1 and FADS2. Phytomedicine. 2025 Jun;141:156680.
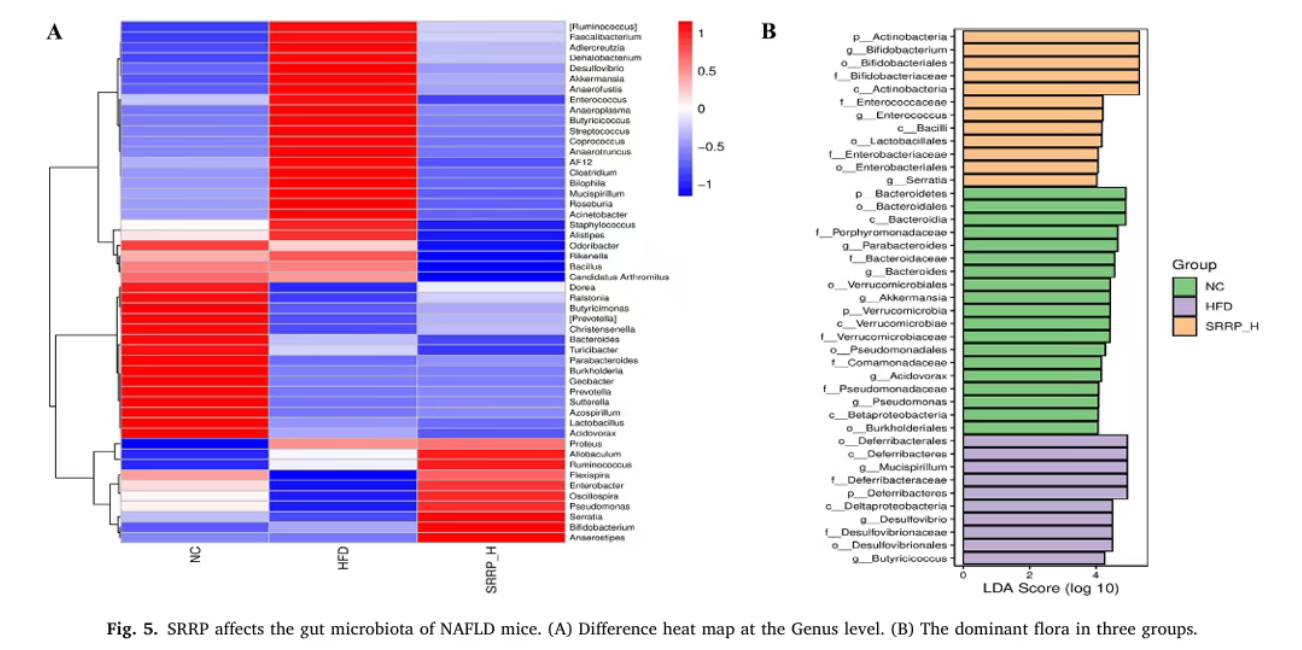
(四)SRRP重塑肠道菌群结构,改善菌群失调
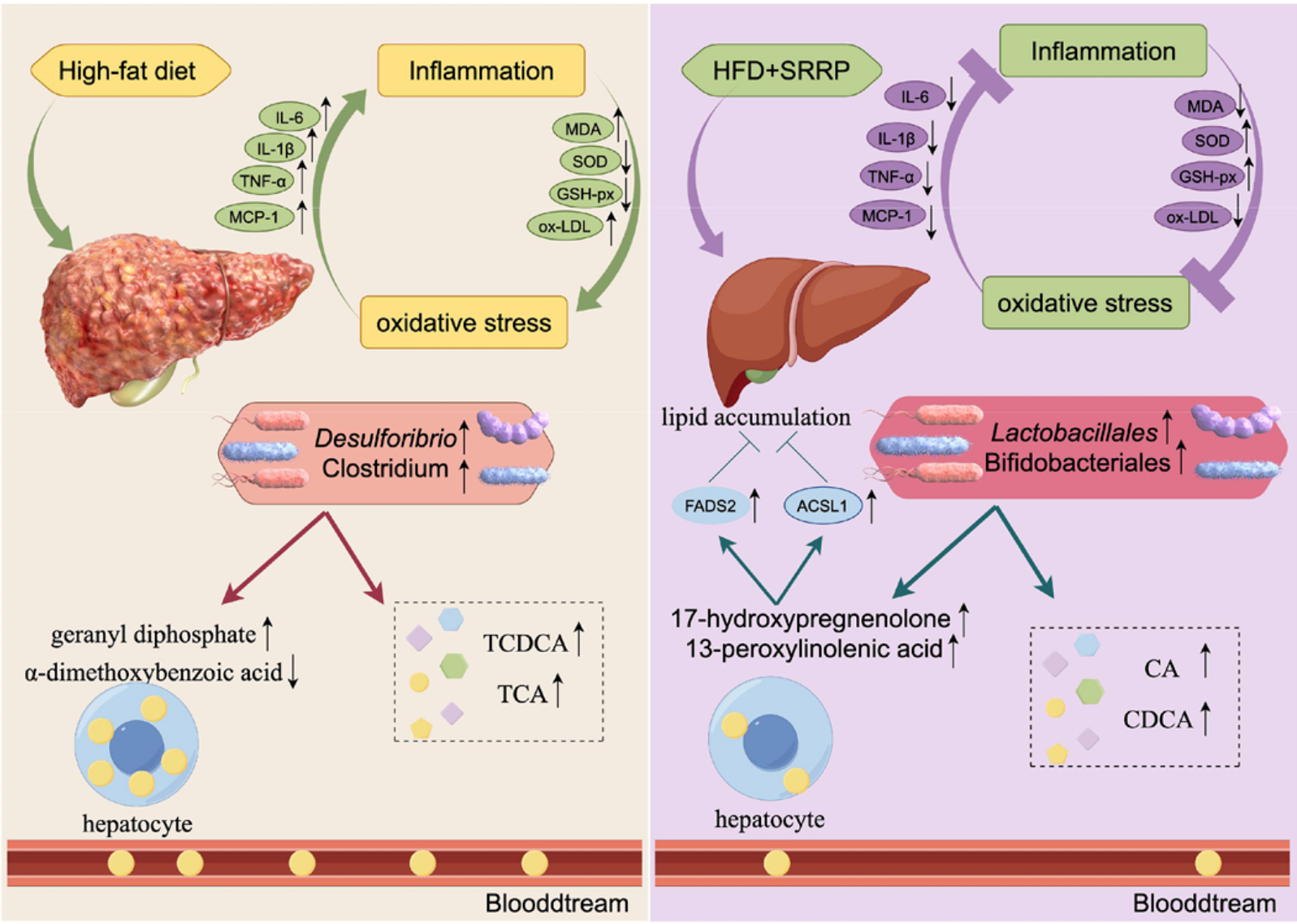
16S rRNA测序结果显示,HFD组与NC组小鼠肠道菌群β多样性存在显著差异,菌群聚类模式完全不同;SRRP干预后,小鼠肠道菌群结构向NC组趋近。门水平分析表明,SRRP显著降低了HFD诱导升高的厚壁菌门/拟杆菌门比值;物种组成分析显示,SRRP干预可显著减少脱硫弧菌属、梭菌属等有害菌丰度,同时富集阿克曼菌、丁酸单胞菌属等有益菌,增强肠道屏障功能。
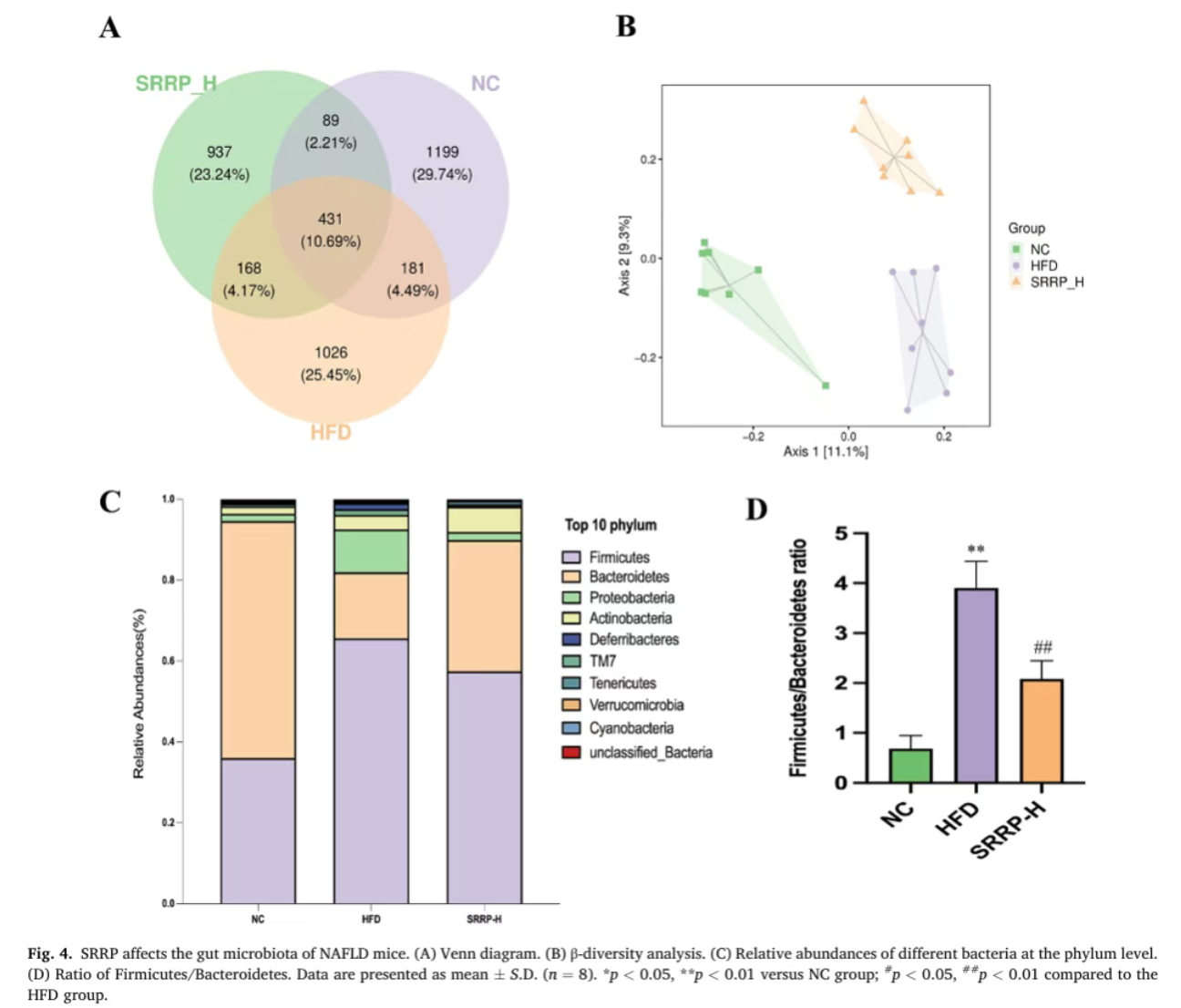
Bao Y, Shang X, et al. Stevia rebaudiana root polysaccharide modulates liver metabolism, bile acid, and gut microbiota improving HFD-induced NAFLD: Potential roles of ACSL1 and FADS2. Phytomedicine. 2025 Jun;141:156680.
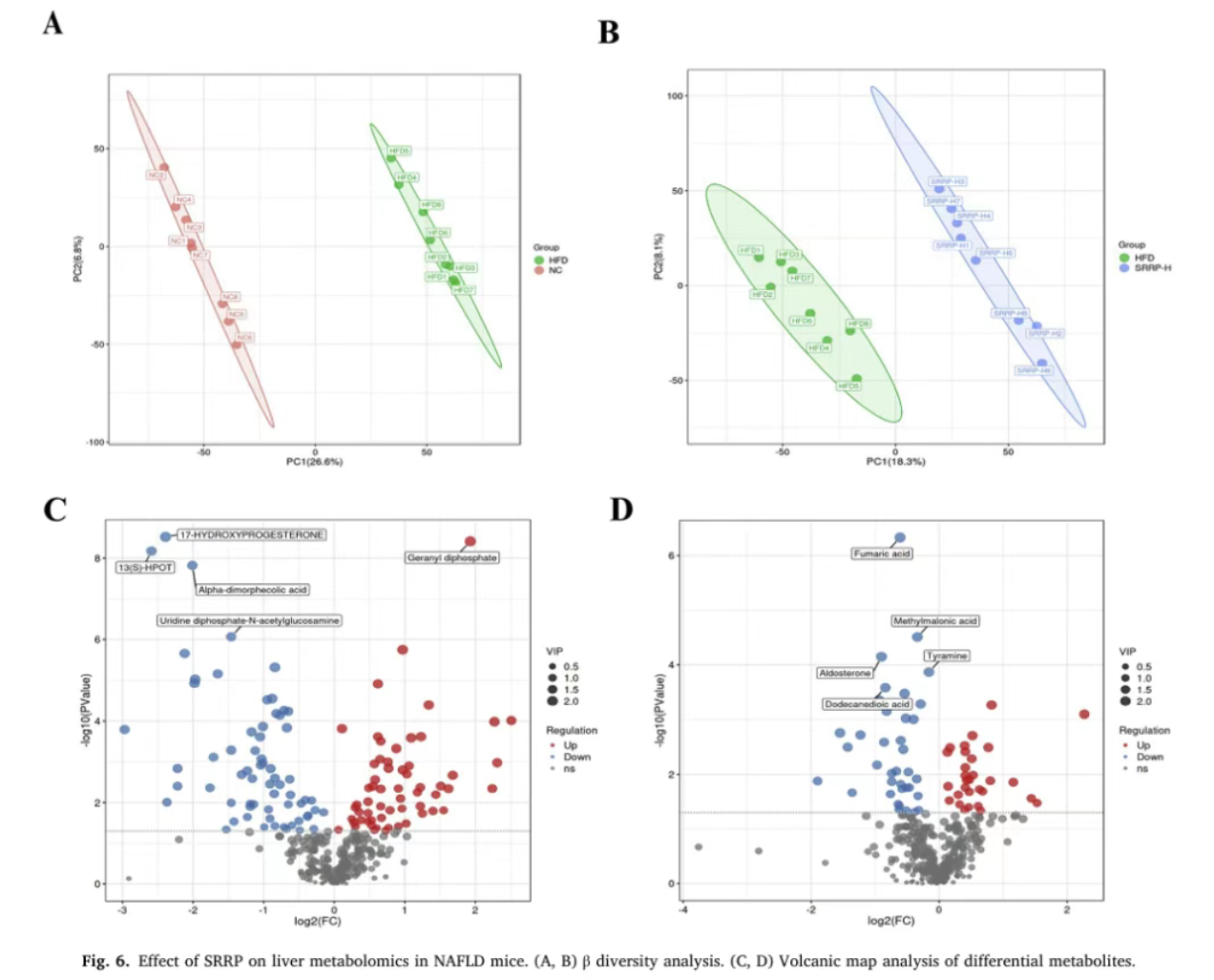
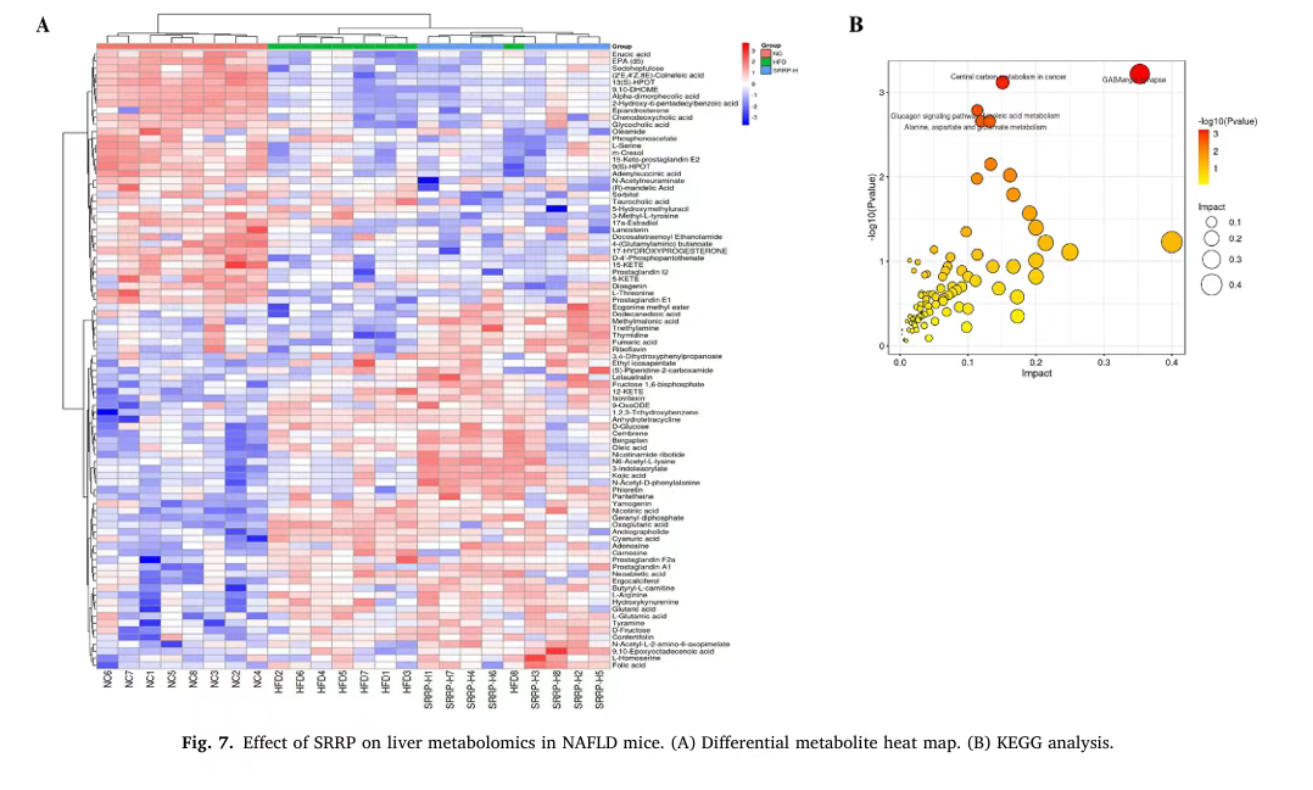
(五)SRRP调节肝脏代谢组,靶向亚油酸代谢途径
PLS-DA分析显示,NC组与HFD组、HFD组与SRRP-H组之间代谢物差异显著(R²Y均接近1,Q²>0.7)。共鉴定出NC组与HFD组间125种差异代谢物,HFD组与SRRP-H组间67种差异代谢物,其中不饱和脂肪酸占比最高且与脂质代谢密切相关。差异代谢物富集分析表明,SRRP主要影响γ-氨基丁酸能突触、中枢碳代谢、亚油酸代谢等通路,其中亚油酸代谢途径是SRRP干预的核心靶点。
Bao Y, Shang X, et al. Stevia rebaudiana root polysaccharide modulates liver metabolism, bile acid, and gut microbiota improving HFD-induced NAFLD: Potential roles of ACSL1 and FADS2. Phytomedicine. 2025 Jun;141:156680.
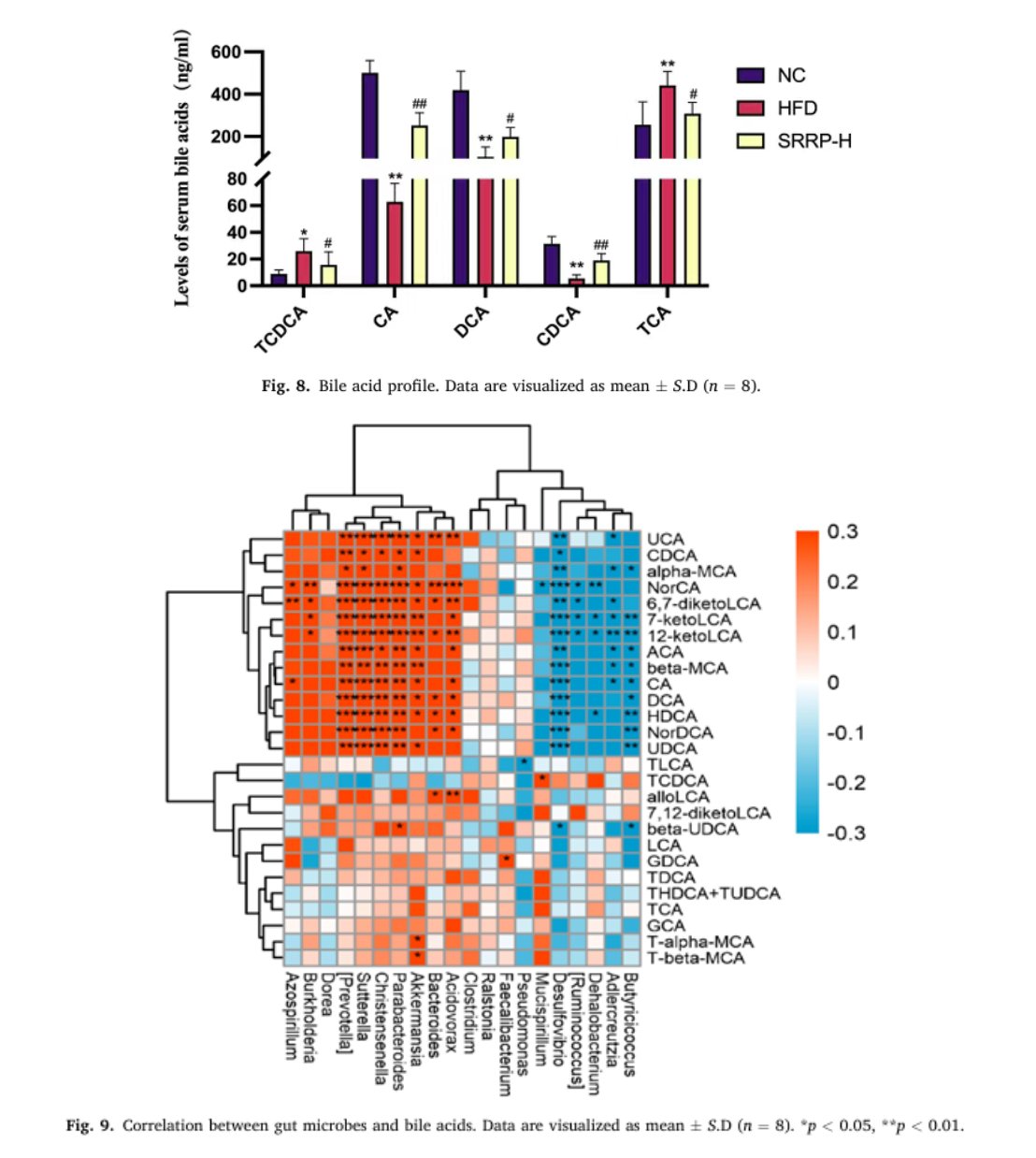
(六)SRRP调节胆汁酸代谢,构建"菌群-胆汁酸-肝脏"调控闭环
UPLC-MS/MS检测结果显示,SRRP干预显著降低了血清中具有肝脏毒性的结合胆汁酸(如TCDCA)含量,同时升高了非结合胆汁酸(如CA、CDCA)水平,改善胆汁酸肠肝循环。相关性分析表明,CA、DCA、CDCA三种非结合胆汁酸水平与副拟杆菌属(有益菌)呈显著正相关,与脱硫弧菌属(有害菌)呈显著负相关,提示SRRP通过调节肠道菌群间接影响胆汁酸代谢,形成调控闭环。
Bao Y, Shang X, et al. Stevia rebaudiana root polysaccharide modulates liver metabolism, bile acid, and gut microbiota improving HFD-induced NAFLD: Potential roles of ACSL1 and FADS2. Phytomedicine. 2025 Jun;141:156680.
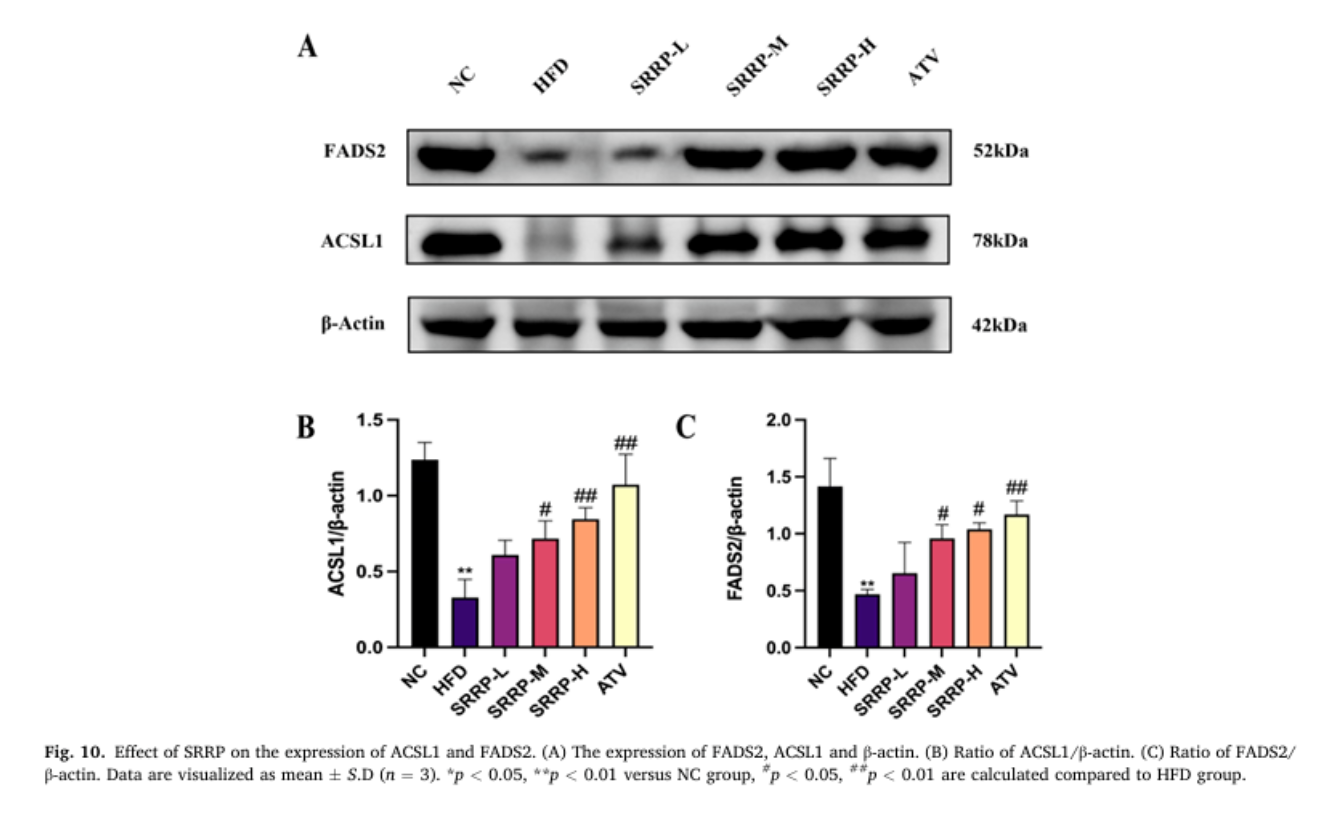
(七)SRRP上调ACSL1、FADS2表达,优化脂质代谢
Western Blot实验证实,与HFD组相比,SRRP干预显著上调肝脏中ACSL1与FADS2的蛋白表达水平。ACSL1可促进脂肪酸β氧化,FADS2参与不饱和脂肪酸合成,二者共同作用将饱和脂肪酸代谢为不饱和脂肪酸,优化脂质代谢流,减少肝脏脂质堆积。
Bao Y, Shang X, et al. Stevia rebaudiana root polysaccharide modulates liver metabolism, bile acid, and gut microbiota improving HFD-induced NAFLD: Potential roles of ACSL1 and FADS2. Phytomedicine. 2025 Jun;141:156680.
Bao Y, Shang X, et al. Stevia rebaudiana root polysaccharide modulates liver metabolism, bile acid, and gut microbiota improving HFD-induced NAFLD: Potential roles of ACSL1 and FADS2. Phytomedicine. 2025 Jun;141:156680.
Bao Y, Shang X, et al. Stevia rebaudiana root polysaccharide modulates liver metabolism, bile acid, and gut microbiota improving HFD-induced NAFLD: Potential roles of ACSL1 and FADS2. Phytomedicine. 2025 Jun;141:156680.
四、讨论
本研究首次系统阐明SRRP通过“肝脏代谢-胆汁酸-肠道菌群”多维协同调控网络改善HFD诱导NAFLD的创新机制:肝脏层面激活ACSL1、FADS2酶优化脂质代谢,胆汁酸层面调节肠肝循环减少毒性蓄积,肠道菌群层面重塑群落结构并通过“菌群-胆汁酸”互作协同护肝,三者共同减轻肝脏脂质沉积、氧化应激与炎症反应,最终改善NAFLD病理状态。 此类代谢性疾病机制研究的开展,高度依赖多维度技术平台的支撑。
LabEx作为专业的生物标志物发现平台,具备16S rRNA测序(肠道菌群解析)、UPLC-MS/MS代谢组学(胆汁酸与代谢物分析)、Western Blot(关键蛋白验证)、ELISA(炎症因子检测)等30+核心技术平台,可提供从基因、蛋白、细胞到组织水平的全链条实验服务。其标准化操作流程、严格质控体系及高效数据分析能力,能为类似NAFLD干预机制研究、天然产物活性验证等课题提供精准可靠的技术支持。
本研究为甜菊根资源深度开发奠定了科学基础。未来,在天然产物干预代谢性疾病的相关研究中,LabEx的单细胞测序、空间多组学、抗体芯片等先进技术,可进一步助力科研人员深入探索作用靶点、解析调控通路,加速临床转化进程,为该领域研究提供全方位、专业化的技术赋能。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


