恶性肿瘤严重威胁人类健康,传统治疗手段如手术、放疗、化疗及早期免疫疗法,在疗效、特异性或毒副作用方面存在局限。近年来,以个体化新抗原为靶点的mRNA疫苗,因其高度特异性、良好安全性及快速制备潜能,已成为肿瘤免疫治疗领域极具前景的研究方向。本文旨在综述其核心原理、关键技术环节、当前挑战与未来发展趋势。
一、肿瘤新抗原:个性化疫苗的理论基石
新抗原是由肿瘤细胞基因组突变产生的全新肽段,其并非源于正常组织。
1、来源与特性:新抗原主要源于基因非同义突变,也可由基因融合、移码突变或病毒整合等事件产生。这些突变导致蛋白质序列改变,经细胞内抗原加工提呈后,形成被主要组织相容性复合体(MHC)分子呈递至细胞表面的独特肽段。
2、免疫识别优势:由于新抗原不存在于正常组织,针对它们的T细胞在胸腺发育过程中未经历中枢性免疫耐受删除,因此在患者体内可能预先存在反应性T细胞克隆。以此为新靶点,可激发特异性强、毒性低的抗肿瘤免疫应答,理论上能够精准杀伤肿瘤细胞而避免对正常组织的攻击。
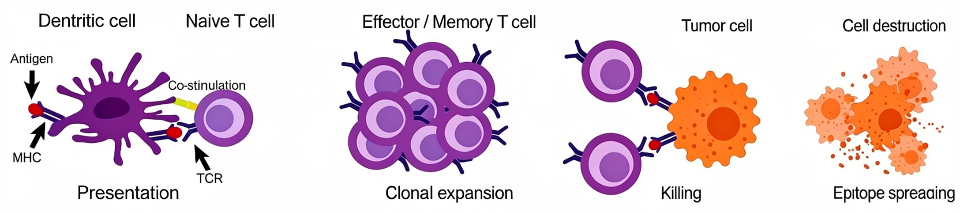
二、个性化mRNA疫苗的核心技术流程
从患者样本到疫苗成品的个体化制备,是一套高度整合的复杂流程。
👉肿瘤样本测序与新抗原鉴定:首先获取患者的肿瘤组织与正常组织(通常为血液)样本,进行全外显子组测序和转录组测序。通过生物信息学比对,筛选出肿瘤特异性突变。随后,利用算法预测突变肽段与患者特定MHC分子的结合亲和力,并结合免疫原性预测模型,最终优选出最可能激发有效免疫反应的新抗原候选序列。
👉mRNA疫苗的分子设计:选定新抗原序列后,将其编码核酸整合至mRNA分子中。现代设计策略包括:优化密码子以增强翻译效率;引入非复制型信使RNA结构,确保高稳定性与安全性;在序列两端添加必要的非翻译区以调控表达;并采用共同递送策略,将多个新抗原序列编码于单一或混合mRNA分子中。
👉递送系统的选择与优化:裸露mRNA易被降解,需借助递送系统才能高效进入细胞质。脂质纳米颗粒是目前最主流的递送平台,其能有效包裹并保护mRNA,通过内吞作用协助其进入抗原提呈细胞,并具备良好的生物相容性与可工业化生产特性。
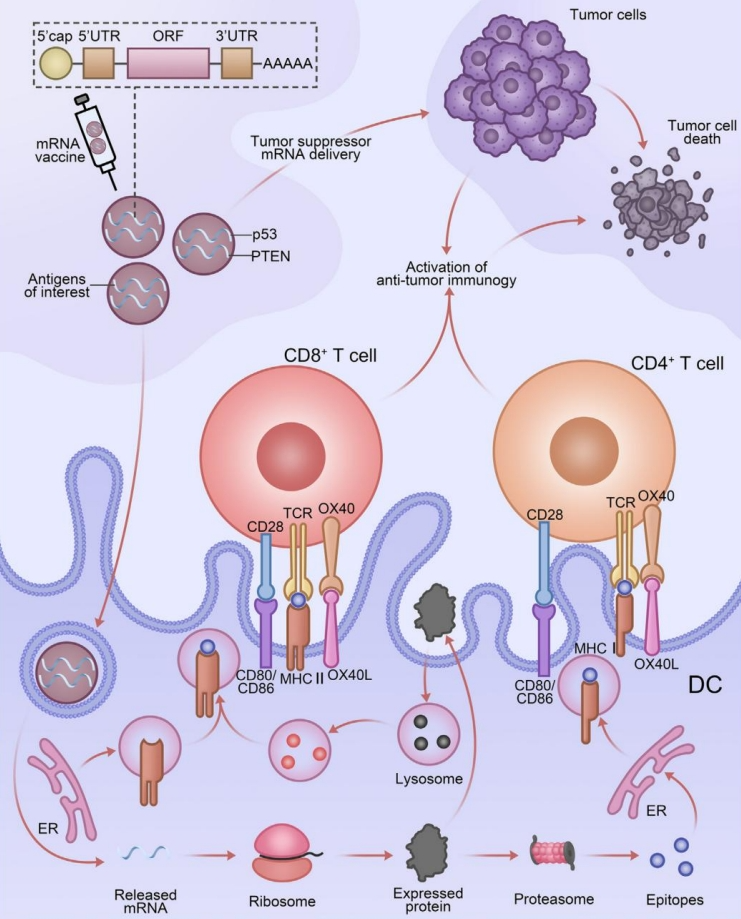
三、临床前与临床研究现状
基础研究与早期临床试验初步验证了该策略的可行性。
1、临床前证据:在多种小鼠肿瘤模型中,个性化新抗原mRNA疫苗已展现出诱导强大且特异性T细胞应答、抑制肿瘤生长、甚至清除已建立肿瘤的能力。研究同时表明,该疫苗与免疫检查点抑制剂等疗法具有协同增效作用。
2、临床探索进展:针对黑色素瘤、结直肠癌、胰腺癌等实体瘤的早期临床试验结果显示,个性化mRNA疫苗具有良好的安全性与耐受性,未报告严重不良反应。在免疫原性方面,这些疫苗能成功诱导针对大部分接种新抗原的多功能CD4+和CD8+ T细胞应答。部分研究观察到疫苗治疗后肿瘤缩小或疾病稳定等初步疗效信号。
四、当前面临的挑战与未来方向
尽管前景广阔,该技术走向广泛应用仍需克服多重障碍。
1、关键技术挑战:
❗ 新抗原预测准确性:现有生物信息学算法对新抗原的预测仍存在假阳性与假阴性,亟需结合更深入的免疫肽组学验证与人工智能模型优化。
❗ 制造周期与成本:从样本采集到疫苗成品的全流程耗时较长、成本高昂,是实现普惠应用的瓶颈。
❗ 肿瘤免疫抑制微环境:实体瘤的免疫抑制环境可能限制疫苗诱导效应细胞的浸润与功能。
❗ 疗效评估标准:需要建立更可靠的生物标志物体系来动态监测免疫应答并预测临床结局。
2、未来发展趋势:
❔ 技术平台整合:将新抗原疫苗与免疫检查点抑制剂、过继性细胞疗法、靶向治疗等手段联合应用,是增强疗效的明确趋势。
❔ 生产工艺革新:推动“一站式”自动化生产平台与质量控制体系的建立,以缩短周期、降低成本。
❔ 应用场景前移:探索在术后辅助治疗或高风险人群预防性干预中的应用潜力,以清除微转移灶或预防复发。
❔ 基础研究深化:进一步阐明新抗原免疫应答的精细调控机制,以及影响疫苗疗效的宿主与肿瘤因素。
五、结论
肿瘤新抗原个性化mRNA疫苗代表了精准医疗与免疫治疗融合的前沿方向。它通过靶向个体独有的肿瘤突变,为实现高效、低毒的抗肿瘤免疫应答提供了创新路径。尽管在预测技术、生产工艺、临床验证及联合策略方面仍存在挑战,但随着相关基础科学、生物技术与临床转化研究的不断深入,这一治疗模式有望在未来为更多肿瘤患者带来新的希望。持续的多学科协作与技术创新将是推动该领域突破的关键。
六、肿瘤相关因子检测哪个公司有?












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


