溃疡性结肠炎(UC)为慢性复发性炎症性肠病,长期病程可增高结直肠癌发生风险。现有治疗药物存在耐药性与严重不良反应等局限,亟需研发安全有效的新型干预策略。
NLRP3 炎症小体过度激活是 UC 发病的核心机制,可通过介导 caspase-1 活化,促进 IL-1β、IL-18 释放,进而加剧肠道炎症损伤。药食同源药材青梅(Prunus mume)传统上具有调节胃肠功能的作用,但其活性物质及作用靶点尚未明确。
南京中医药大学团队首次证实,青梅来源胞外囊泡样颗粒(PM-EVLPs)口服后可特异性靶向炎症结肠组织,通过其负载的 miR159 阻断 NEK7-NLRP3 相互作用,抑制 NLRP3 炎症小体活化,显著改善实验性结肠炎,为 UC 治疗提供了新型天然纳米药物候选。
标题:Prunus mume derived extracellular vesicle-like particles alleviate experimental colitis via disrupting NEK7-NLRP3 interaction and inflammasome activation
中文译名:青梅来源胞外囊泡样颗粒通过阻断 NEK7-NLRP3 相互作用、抑制炎症小体活化缓解实验性结肠炎
期刊:Journal of Nanobiotechnology
影响因子:12.6
发表时间:2025 年 7 月 21 日
💯研究思路💯
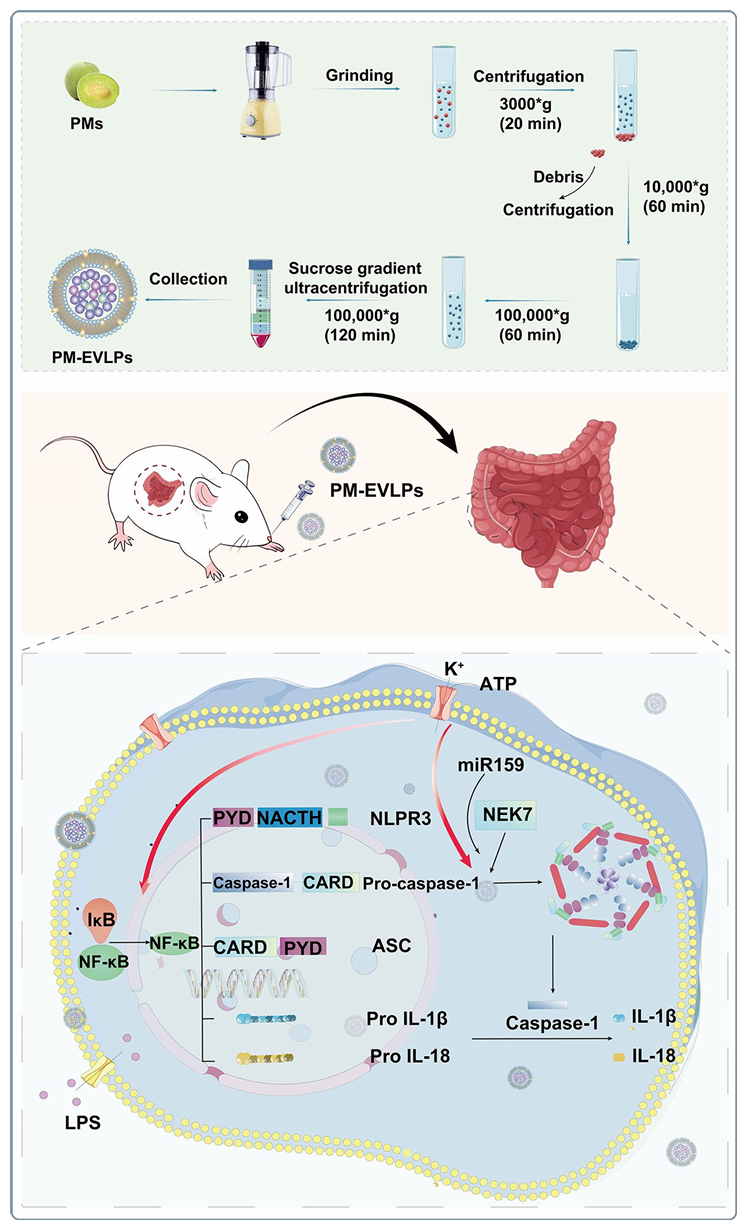
首先采用超速离心联合蔗糖梯度离心法分离纯化青梅来源胞外囊泡样颗粒(PM-EVLPs),并完成其表征分析;其次利用DSS及TNBS诱导的小鼠结肠炎模型,系统评估PM-EVLPs的体内治疗效能及安全性;通过体内生物分布实验与细胞摄取实验,明确PM-EVLPs的靶向组织及靶细胞特异性;随后在细胞水平深入探究PM-EVLPs对NLRP3炎症小体激活的调控作用及潜在分子机制;通过成分分离与miRNA筛选技术,鉴定PM-EVLPs中的核心活性成分;最后验证关键活性miRNA的体内治疗效应,完善作用机制闭环。
💯研究结果💯
1.PM-EVLPs的分离纯化与表征
采用梯度离心联合蔗糖密度梯度纯化法,从青梅果汁中分离获得青梅来源胞外囊泡样颗粒(PM-EVLPs)(Fig.1A)。纳米颗粒追踪分析(NTA)显示,其平均粒径约为124nm;透射电子显微镜(TEM)观察可见典型杯状结构;zeta电位检测结果约为-27mV(Fig.1B-D)。成分分析表明,PM-EVLPs主要包含miRNA、蛋白质及脂质,其中miRNA占比最高,平均长度约20nt(Fig.1E-G)。此外,PM-EVLPs在模拟胃肠液中具有良好稳定性,具备口服给药的应用潜力。
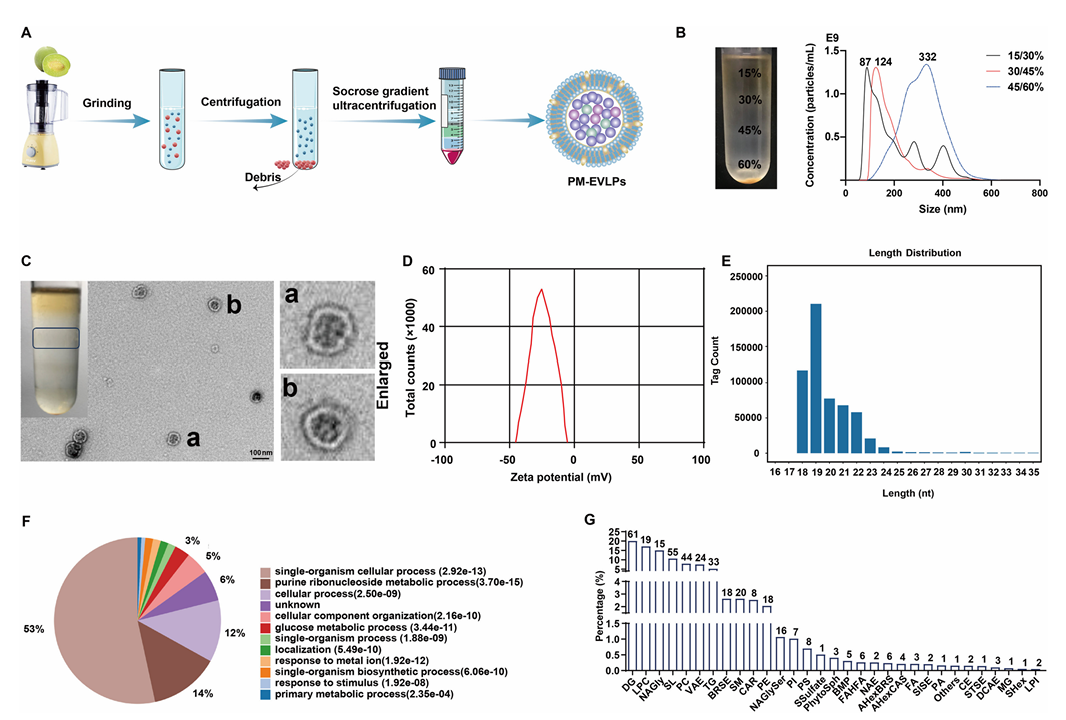
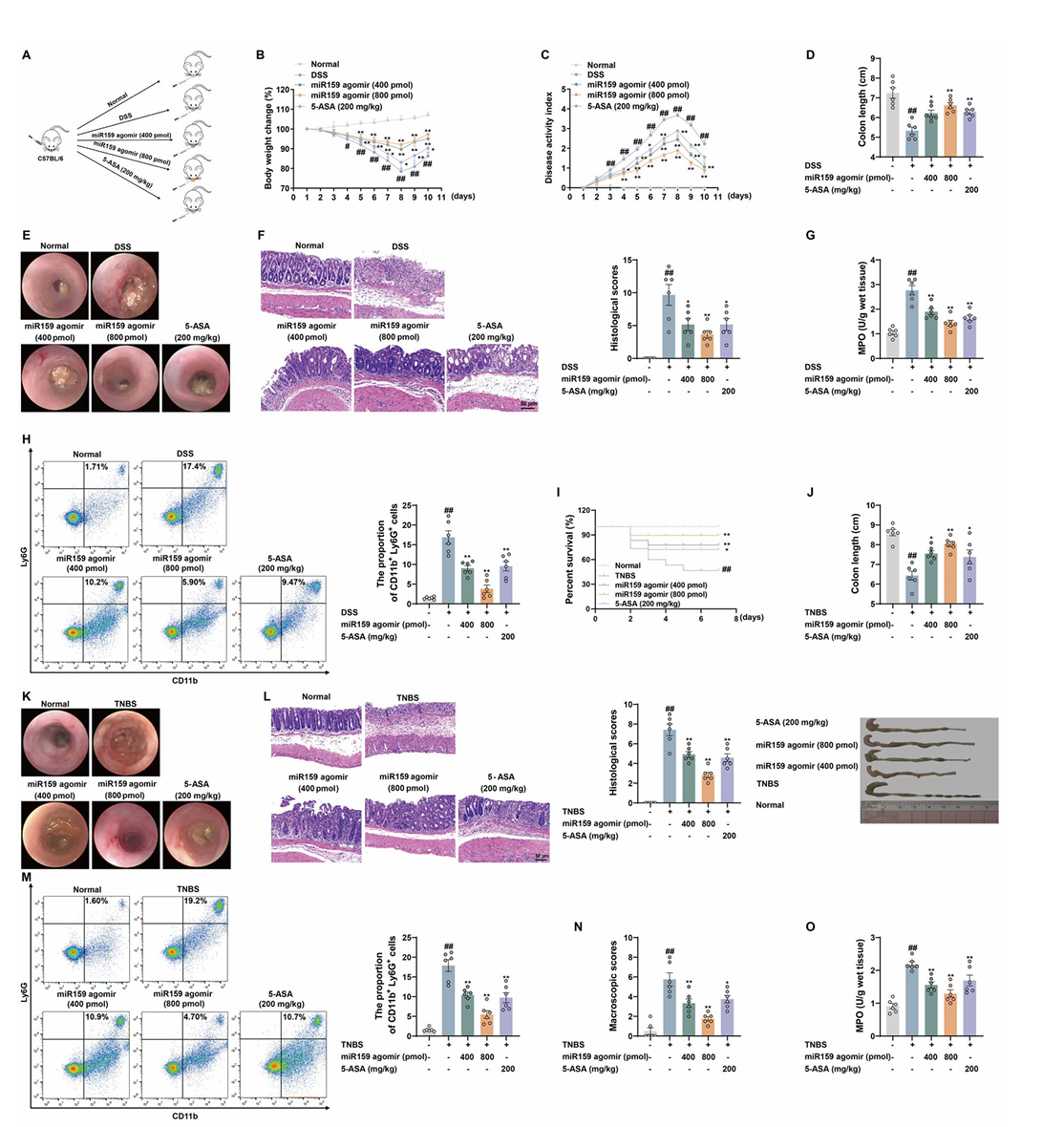
2.PM-EVLPs口服给药对小鼠实验性结肠炎的缓解作用
在DSS诱导的小鼠结肠炎模型中,口服PM-EVLPs可呈剂量依赖性改善小鼠体重下降趋势,降低疾病活动指数(DAI),增加结肠长度,同时显著降低髓过氧化物酶(MPO)活性、减少中性粒细胞浸润(Fig.2B-H)。高分辨率内镜及组织病理学检测结果显示,PM-EVLPs能够有效减轻结肠上皮损伤、黏膜水肿及炎症细胞浸润程度(Fig.2F-G)。
在TNBS诱导的结肠炎模型中,PM-EVLPs同样表现出显著的治疗效应,可提高小鼠存活率,明显改善结肠组织损伤及肠道炎症反应(Fig.2J-P)。安全性评估结果表明,PM-EVLPs对小鼠主要脏器无明显毒性作用,且不会影响机体免疫细胞比例,提示其口服给药具有良好的生物安全性。
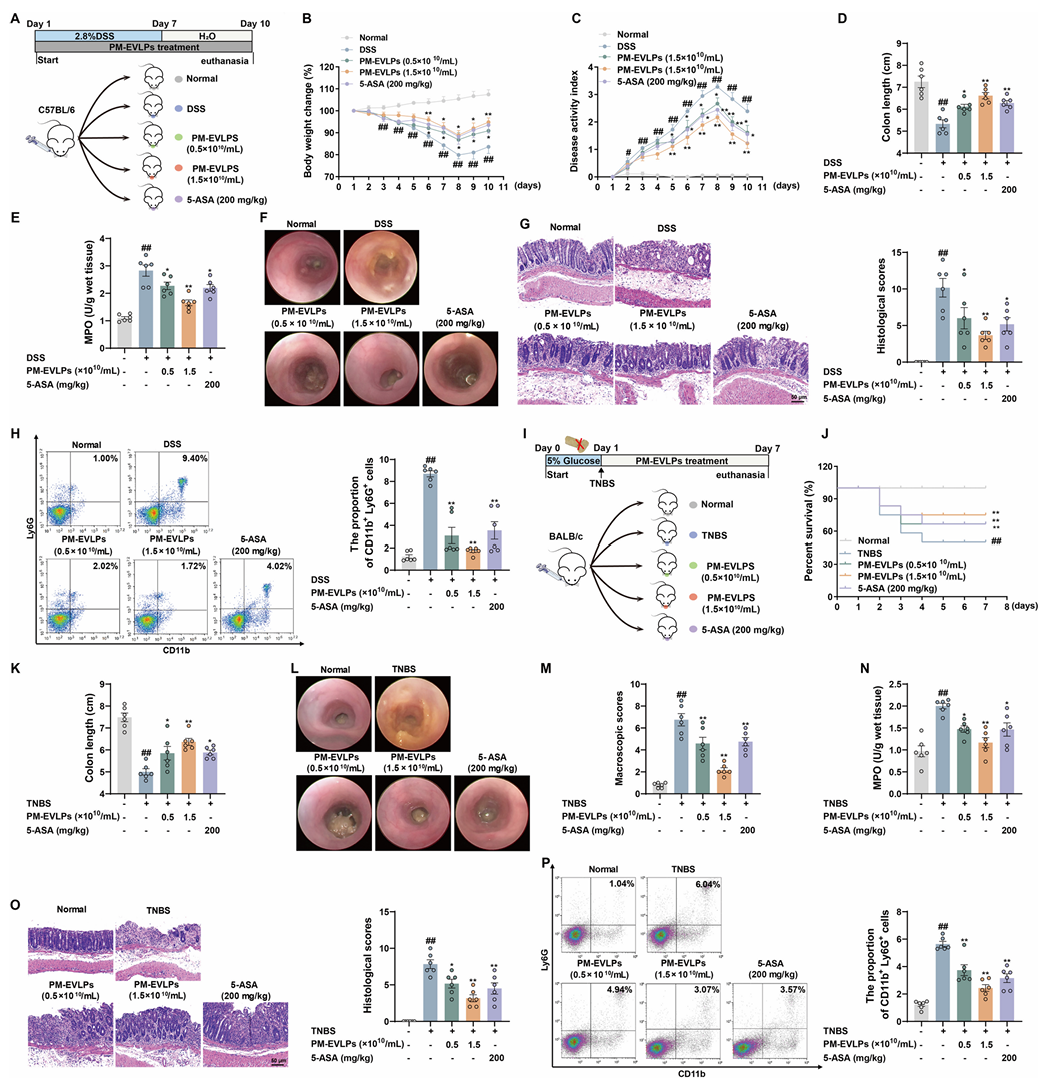
3.PM-EVLPs特异性靶向结肠巨噬细胞
体内生物分布显示,DiR标记的PM-EVLPs口服后在DSS结肠炎小鼠中优先富集于炎症结肠组织,24h达峰值,48h基本清除(Fig.3A)。免疫荧光显示其主要定位于结肠黏膜层固有层(Fig.3B)。细胞摄取实验表明,巨噬细胞(BMDMs和THP-1细胞)对PM-EVLPs的摄取效率显著高于T细胞(Fig.3C-D)。结肠组织共定位实验证实,PM-EVLPs可被F4/80⁺巨噬细胞内化(Fig.3E)。
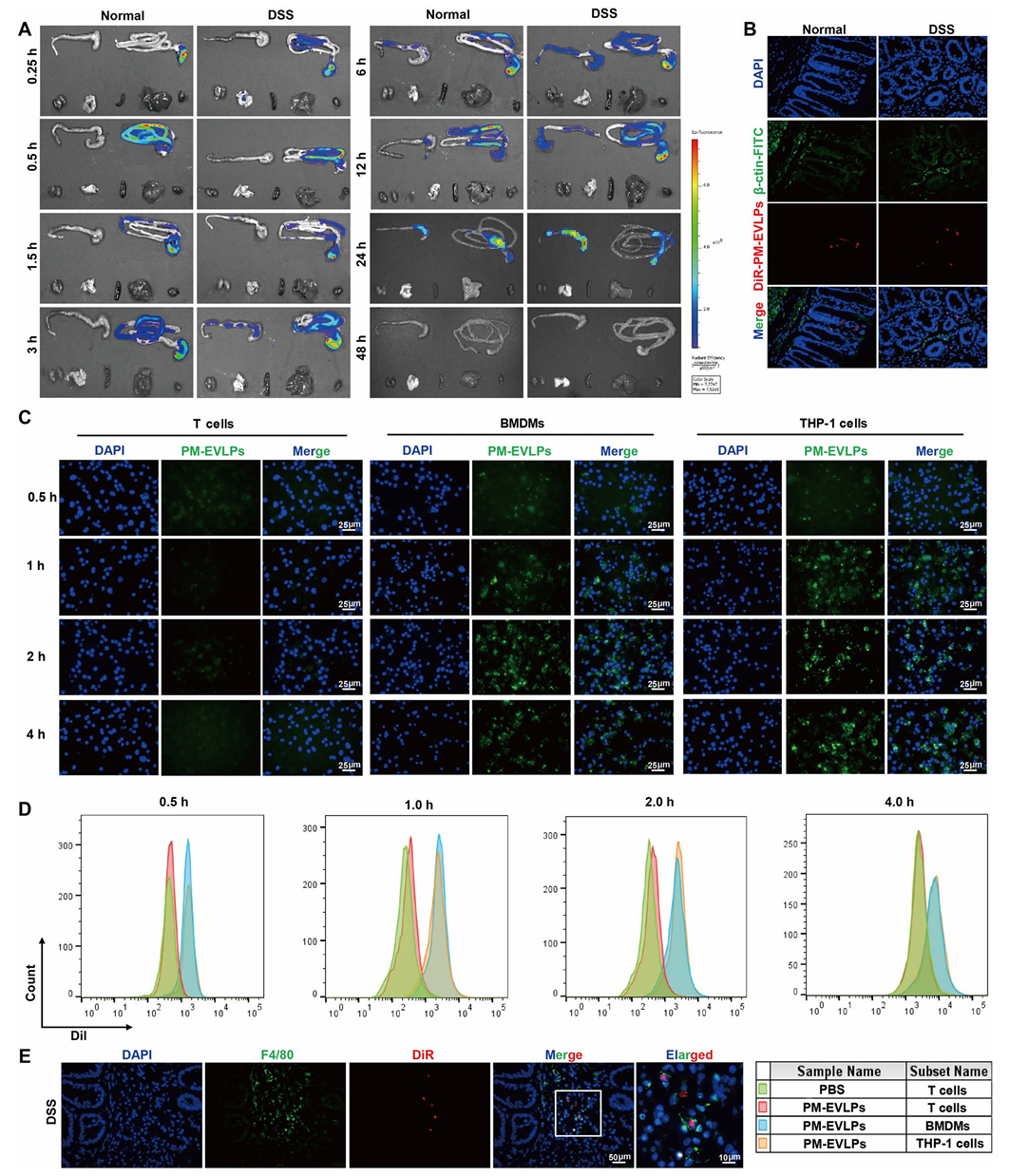
4.巨噬细胞是PM-EVLPs发挥抗结肠炎作用的关键靶细胞
氯膦酸脂质体清除小鼠巨噬细胞后,PM-EVLPs对DSS及TNBS诱导结肠炎的保护作用显著减弱,表现为DAI评分升高、结肠缩短、炎症浸润加重(Fig.4A-G、H-N),证实巨噬细胞是PM-EVLPs发挥抗结肠炎效应的关键靶细胞。
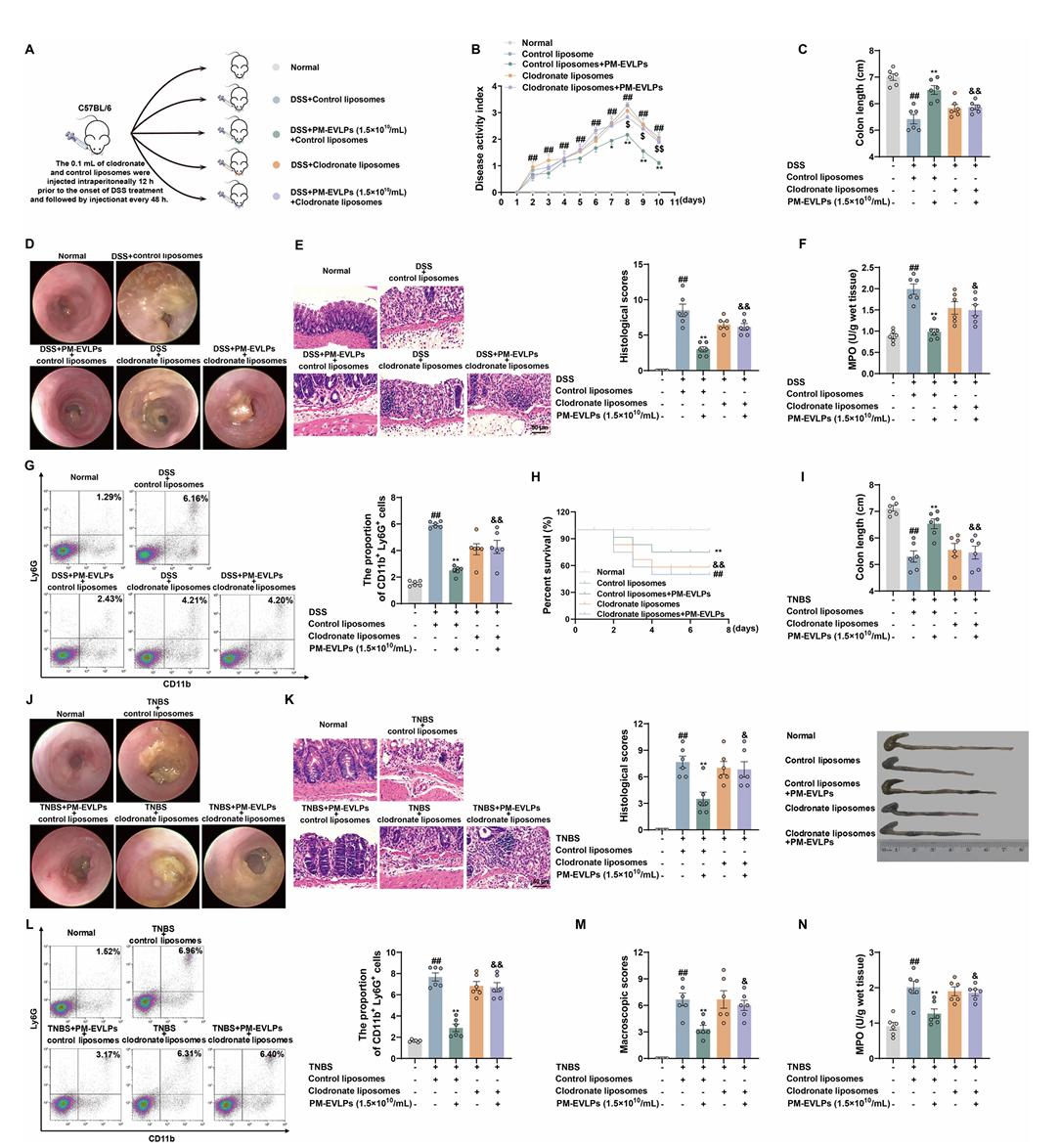
5.PM-EVLPs 选择性抑制巨噬细胞 NLRP3 炎症小体激活
PM-EVLPs 可显著降低结肠炎小鼠结肠巨噬细胞中 cleaved caspase-1、IL-1β 及 IL-18 的表达(Fig.5A-B),但对结肠上皮细胞 NLRP3 炎症小体无明显抑制作用(Fig.5C-D)。体外实验显示,PM-EVLPs 可抑制 LPS+ATP、尼日利亚菌素或 MSU 诱导的 BMDMs、THP-1 细胞 NLRP3 炎症小体激活,减少炎症因子分泌(Fig.5E-J),且对 AIM2、NLRP1、NLRC4 炎症小体无明显影响,具有选择性。
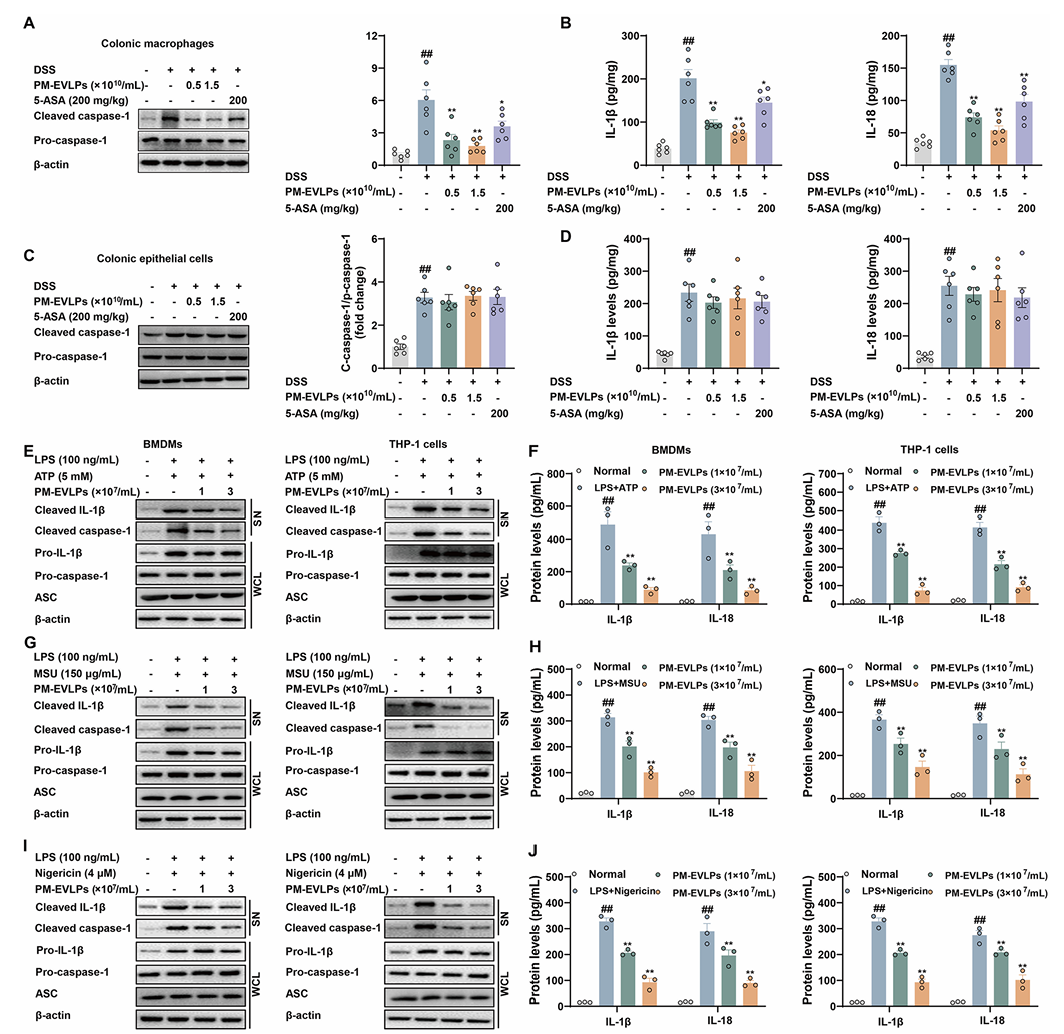
6.PM-EVLPs 通过破坏 NEK7-NLRP3 相互作用抑制炎症小体组装
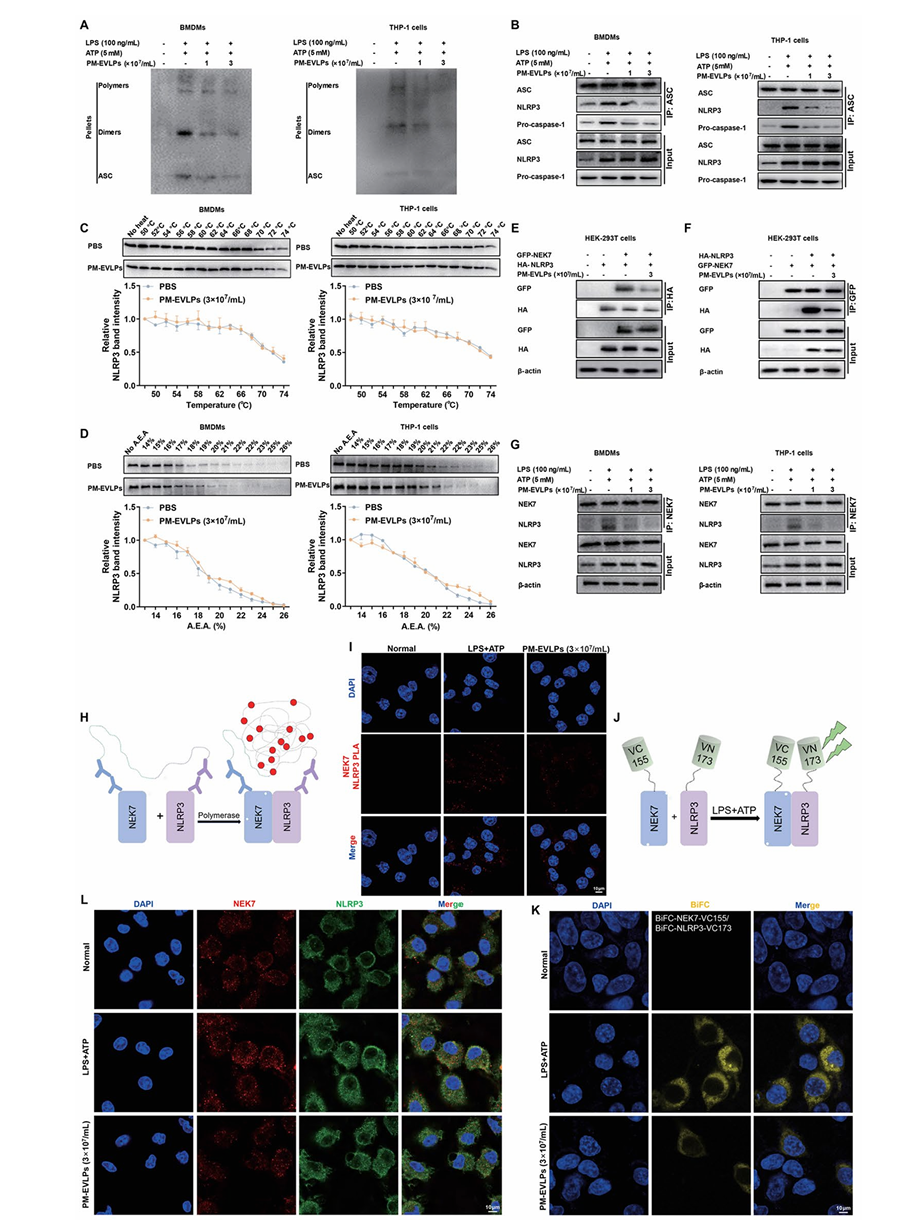
PM-EVLPs 不影响 NLRP3 炎症小体激活的启动信号(NF-κB 通路),对线粒体 ROS 生成、K⁺外流及 Ca²⁺内流亦无显著作用。Co-IP 结果显示,PM-EVLPs 可抑制 ASC 寡聚化及 NLRP3/ASC/pro-caspase-1 复合物形成(Fig.6A-B)。CETSA 与 SIP 实验表明,PM-EVLPs 不直接结合 NLRP3(Fig.6C-D)。PLA、BiFC 及免疫荧光实验证实,PM-EVLPs 可显著抑制 NEK7 与 NLRP3 的相互作用(Fig.6E-L),进而阻断炎症小体组装。

7.PM-EVLPs 中的 miR159 是抑制 NLRP3 炎症小体的关键成分
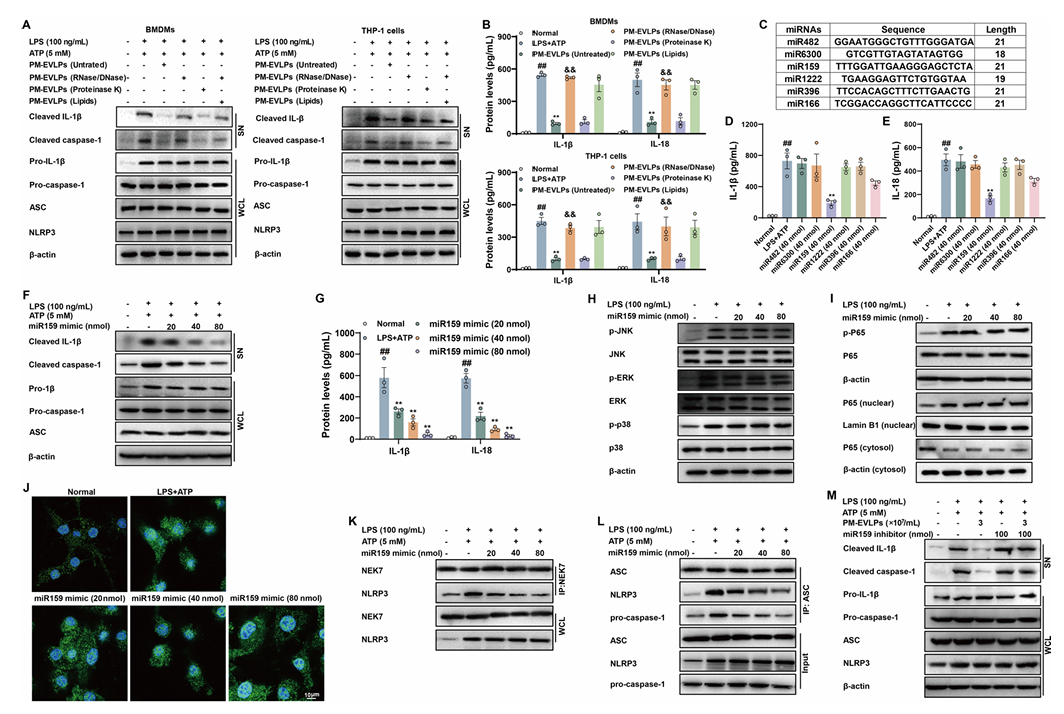
成分筛选显示,DNase I/RNase 处理可消除 PM-EVLPs 的抗炎活性,而蛋白酶 K 或脂质提取对其活性无明显影响(Fig.7A-B),提示活性成分为 RNA。miRNA 测序共鉴定出 94 种 miRNA,其中 miR159、miR482 等丰度最高(Fig.7C)。体外实验表明,仅 miR159 模拟物可重现 PM-EVLPs 的作用,呈剂量依赖性抑制 NLRP3 炎症小体激活,降低 IL-1β、IL-18 分泌(Fig.7D-G)。miR159 不影响 NF-κB 与 MAPK 通路,可抑制 NEK7-NLRP3 相互作用及炎症小体组装(Fig.7H-L);miR159 抑制剂可逆转 PM-EVLPs 的抗炎效应(Fig.7M)。

8.miR159 体内给药可缓解实验性结肠炎
miR159 激动剂口服给药可呈剂量依赖性改善 DSS 诱导结肠炎小鼠的体重下降、DAI 升高及结肠缩短,减轻结肠上皮损伤与炎症浸润(Fig.8A-H)。在 TNBS 模型中,miR159 激动剂同样可提高小鼠存活率,改善结肠炎症与组织损伤(Fig.8I-O),证实 miR159 是 PM-EVLPs 发挥抗结肠炎作用的关键活性成分。

💯文章总结💯
1. 首次从青梅中分离鉴定出具有抗结肠炎活性的PM-EVLPs,其口服给药安全有效;
2. 明确PM-EVLPs可特异性靶向炎症结肠巨噬细胞,而非其他免疫细胞或上皮细胞;
3. 阐明PM-EVLPs通过破坏NEK7-NLRP3相互作用,选择性抑制NLRP3炎症小体激活,对其他炎症小体无影响;
4. 鉴定miR159为PM-EVLPs的关键活性成分,其单独给药即可发挥抗结肠炎治疗作用。
该研究明确了青梅抗结肠炎的物质基础与分子机制,为UC治疗提供了新型天然纳米药物,同时为植物来源EVLPs在炎症性疾病中的应用提供了实验支撑。
本文核心创新在于“药食同源+纳米医学”的跨界结合:以传统药用水果青梅为原料,分离天然纳米载体PM-EVLPs,兼具良好生物相容性与靶向性;聚焦NLRP3炎症小体关键靶点,层层递进阐明其通过miR159破坏NEK7-NLRP3相互作用的独特机制,为UC治疗提供了新思路。
💯结肠炎相关重点炎症因子💯
| 分类 | 指标(因子) | 因子作用 |
|---|---|---|
| 经典促炎细胞因子 | TNF-α、IL-1β、IL-6、IL-17A、IFN-γ、IL-23、IL-18 | 驱动肠道炎症核心,诱导肠上皮凋亡、破坏肠屏障、招募免疫细胞、放大炎症级联反应,是结肠炎黏膜损伤与慢性化的关键介质 |
| 趋化因子 | CCL2、CCL3、CCL4、CCL5、CCL20、CXCL1、CXCL2、CXCL8、CXCL9、CXCL10、CXCL11 | 特异性招募单核 / 巨噬细胞、T 细胞、中性粒细胞等免疫细胞向肠黏膜炎症部位浸润,决定炎症分布与浸润强度 |
| 抗炎 / 调节性细胞因子 | IL-10、TGF-β、IL-4、IL-13、IL-35、IL-27 | 抑制促炎因子释放、调节免疫细胞分化、维持肠道免疫耐受,拮抗肠道炎症,其表达不足或功能缺陷会导致炎症失控 |
| 炎症小体相关因子 | NLRP3、NLRP6、NLRC4、Caspase-1 | 感知肠道损伤与病原信号,激活下游促炎因子(IL-1β、IL-18)成熟释放,启动并放大肠道初始炎症反应 |
| 肠道屏障与损伤相关因子 | ZO-1、Occludin、Claudin-1、MLCK、HMGB1、iNOS、COX-2 | 调控肠黏膜紧密连接完整性,反映肠屏障损伤程度;介导氧化应激、组织损伤,参与炎症放大与黏膜修复失衡 |
| 髓系细胞相关介质 | MMP-2、MMP-9、MPO、ROS、NO、LTB4 | 降解肠道细胞外基质加重组织溃疡,标记中性粒细胞浸润程度,介导氧化损伤与脂质炎症介质释放,加剧黏膜破坏 |
💯结肠炎相关因子检测哪个公司有?💯
LabEx乐备实提供Luminex、MSD等多因子检测技术,可助力检测结肠炎相关炎症因子指标:
| 货号 | 产品名 | 指标 |
| LXLBM31-1 | 小鼠趋化因子-31因子Panel | BCA-1/CXCL13,CTACK/CCL27,ENA-78/CXCL5,Eotaxin/CCL11,Eotaxin-2/CCL24,Fractalkine/CX3CL1,GM-CSF,I-309/CCL1,IFN-γ,IL-1β,IL-2,IL-4,IL-6,IL-10,IL-16,IP-10/CXCL10,I-TAC/CXCL11,KC/CXCL1,MCP-1/CCL2,MCP-3/CCL7,MCP-5/CCL12,MDC/CCL22,MIP-1α/CCL3,MIP-1β/CCL4,MIP-3α/CCL20,MIP-3β/CCL19,RANTES/CCL5,SCYB16/CXCL16,SDF-1α/CXCL12,TARC/CCL17,TNF-α |
| LXLBH10-1 | 人炎症10因子Panel | IL-1 β/IL-1F2,IL-2,IL-4,IL-6 ,IL-8/CXCL8,IL-10,IL-12 p70,IL-13,TNF-α,IFN-γ |
更多指标请查看乐备实官网~












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


