造血干细胞(HSCs)的衰老会引发克隆性造血、髓系恶性肿瘤及免疫功能衰退等一系列病理变化,严重影响机体健康。本研究发表于《Cell Stem Cell》,通过对不同年龄小鼠HSCs的溶酶体特性分析,揭示了溶酶体功能异常在HSCs衰老过程中的核心作用。研究发现,衰老HSCs的溶酶体呈现"高酸化-低质量-高活性"三联异常,由加工异常的线粒体DNA(mtDNA)驱动的cGAS-STING信号通路介导了衰老相关炎症反应。通过伴胞霉素A(ConA)抑制液泡型ATP酶(v-ATPases),可有效恢复溶酶体完整性、减轻炎症反应、改善基因组稳定性,并逆转衰HSCs的功能衰退,使其竞争性增殖能力、自我更新能力及分化平衡趋近年轻状态。该研究为开发造血系统抗衰老干预策略提供了新靶点,有望为老年性贫血、免疫衰退及血液系统疾病的治疗开辟新路径。
一、材料与方法
(一)实验动物
选取年轻(Y)和老年(O)小鼠作为研究对象,分离骨髓中的造血干细胞,根据基质金属蛋白酶(MMP)水平分为MMP-low和MMP-high两个亚群。
(二)主要实验技术
采用共聚焦成像技术观察溶酶体形态及分布;流式细胞术分析溶酶体pH值、数量及活性指标;Western blot检测组织蛋白酶、mTOR通路相关蛋白及表观遗传修饰因子表达;单细胞RNA测序分析基因表达谱变化;体内移植实验评估HSCs的竞争性增殖和自我更新能力。
(三)药物处理
使用伴胞霉素A(ConA)特异性抑制v-ATPase活性,mtDNA复制抑制剂ddC阻断mtDNA合成,蛋白酶抑制剂Leupeptin抑制溶酶体蛋白水解活性,分别处理老年小鼠HSCs,设置DMSO对照组。
二、结果
(一)衰老造血干细胞的溶酶体三联异常特征
对不同年龄小鼠HSCs的溶酶体特性分析显示,与年轻HSCs相比,老年HSCs的溶酶体呈现显著异常:一是溶酶体pH值降低,出现过度酸化现象;二是溶酶体数量减少且膜结构受损,完整性遭到破坏;三是溶酶体降解活性异常增强。这种"高酸化-低质量-高活性"的三联异常在MMP-low和MMP-high两个亚群的老年HSCs中均有体现,表明溶酶体功能障碍是HSCs衰老的共性特征。
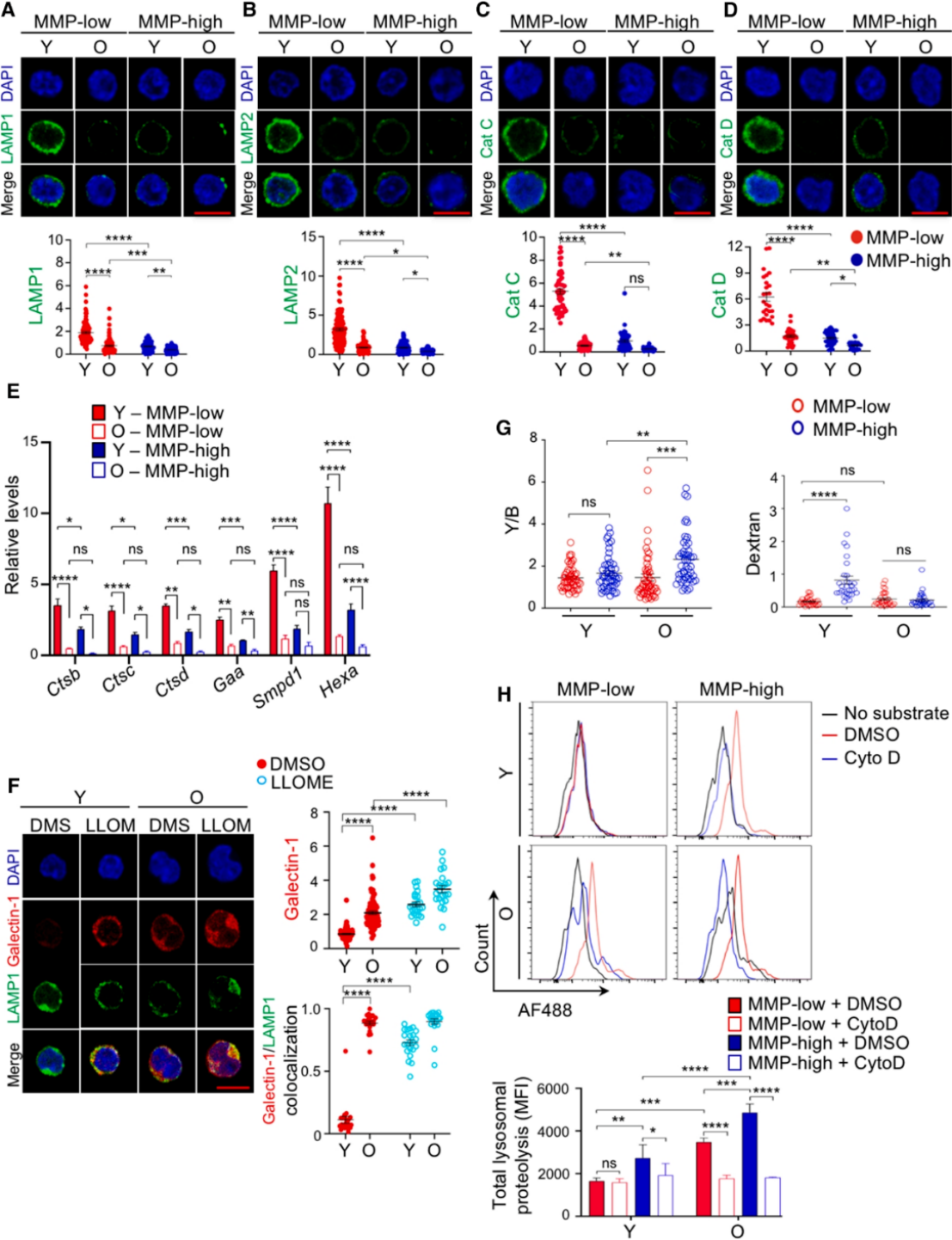
图1.在老年造血干细胞以及来自年轻(Y)和老年(O)小鼠的低基质金属蛋白酶(MMP)水平和高基质金属蛋白酶(MMP)水平的造血干细胞中,溶酶体数量减少、受损且过度活跃
(二)v-ATP酶抑制剂修复溶酶体功能的效应
ConA作为v-ATPase的特异性抑制剂,可通过抑制v-ATPase活性发挥多重修复作用:
1. 降低溶酶体酸性及蛋白水解活性,恢复溶酶体正常形态与体积;
2. 上调组织蛋白酶表达水平,改善溶酶体降解功能稳态;
3. 抑制mTOR通路过度激活,减轻细胞代谢紊乱;
4. 降低DNA损伤水平(如γH2AX表达下调),提升基因组稳定性;
5. 恢复衰老HSCs的表观遗传特性,使H4K16ac、H3K27ac等组蛋白修饰水平趋近年轻状态。
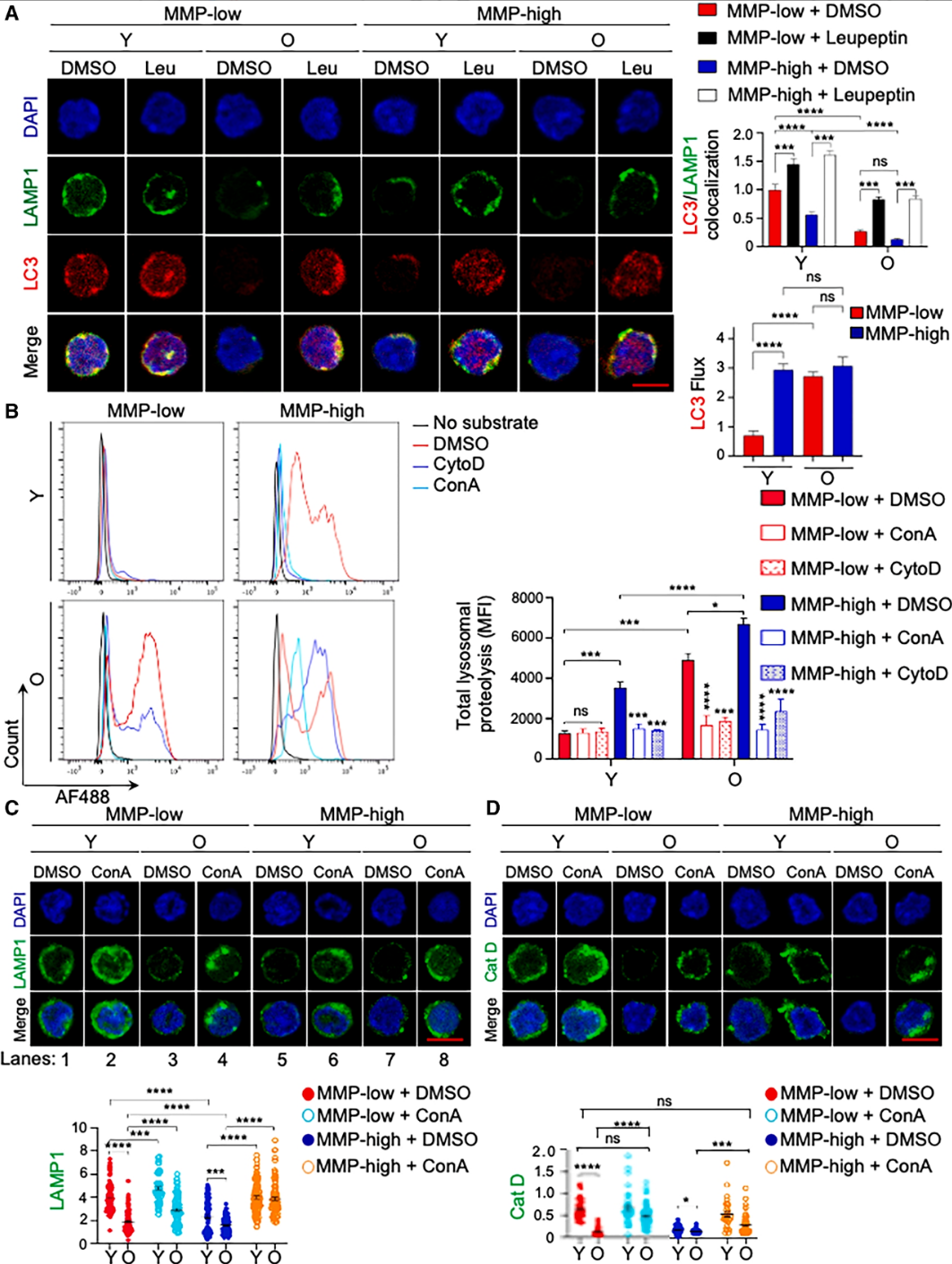
图2.抑制溶酶体活性可改善衰老HSCs的溶酶体特性
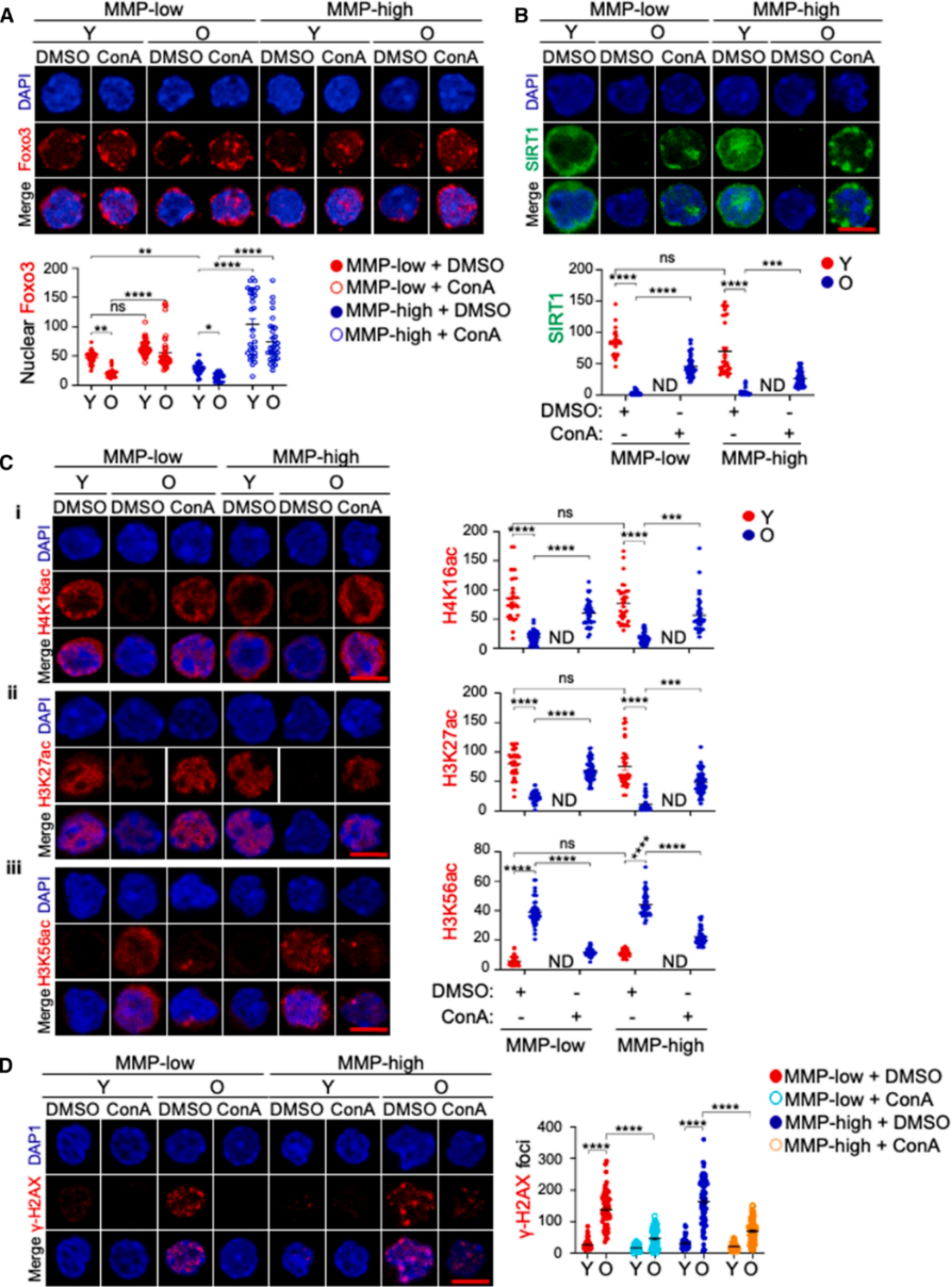
图3 .溶酶体活性的抑制可改善固有转录和表观遗传特性,并减少衰老HSCs的DNA损伤
(三)衰老 HSCs 功能的逆转效应
体内外功能实验证实,ConA 处理可显著改善衰老 HSCs 的生物学功能:
1. 体外培养条件下,老年 HSCs 的增殖能力显著增强,细胞数量明显增加;
2. 竞争性移植实验中,处理后的老年 HSCs 在受体小鼠体内的植入效率和造血重建能力显著提升,自我更新能力得到恢复;
3. 分化平衡得到改善,老年 HSCs 原本倾向于产生更多髓系细胞,处理后淋巴细胞比例显著增加,分化模式更接近年轻 HSCs。
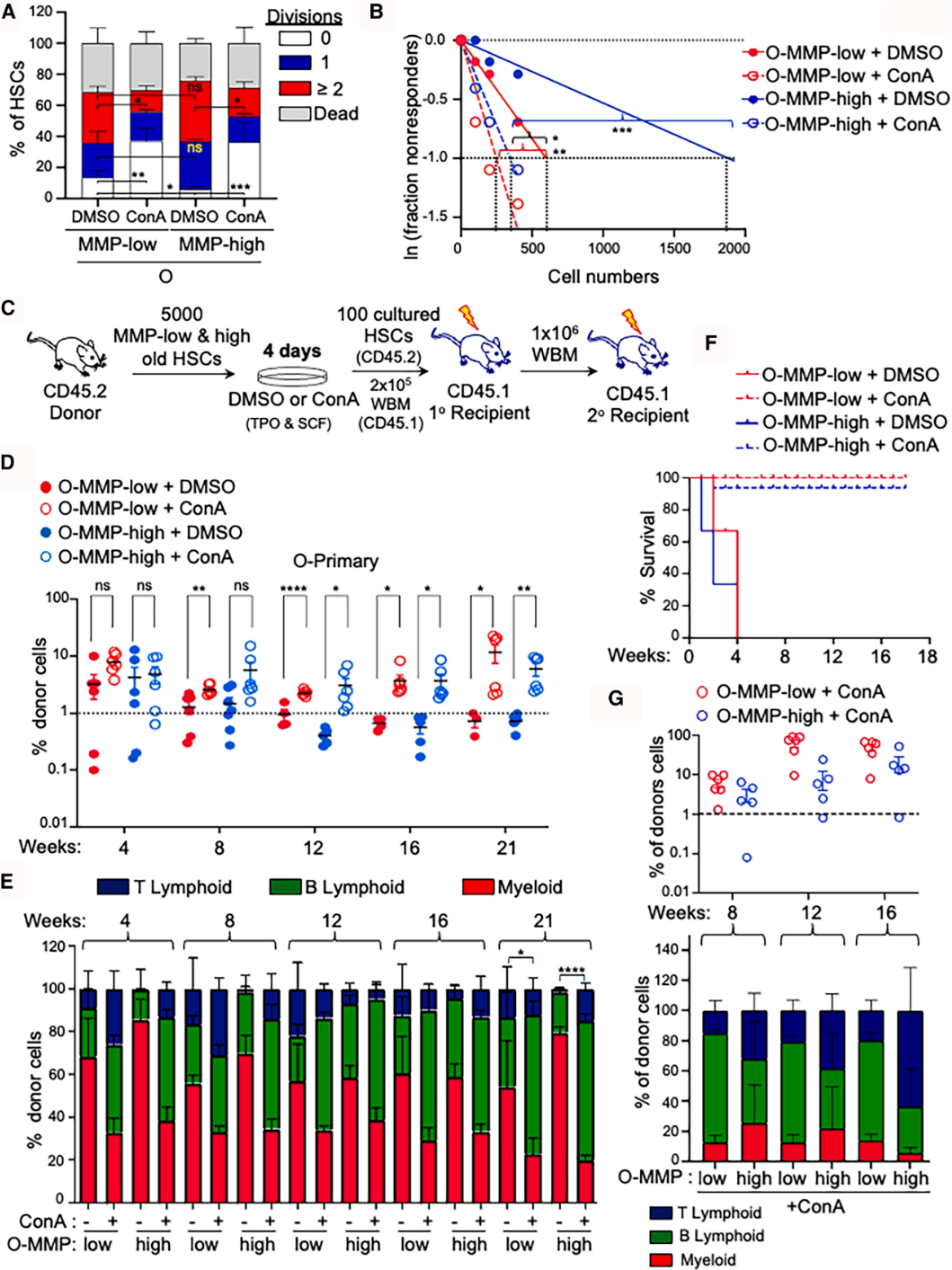
图4. 抑制溶酶体活性可提高衰老造血干细胞在体内的竞争性再增殖和自我更新能力
(四)"mtDNA逃逸-炎症激活"介导的衰老机制
深入机制研究发现,衰老HSCs中线粒体DNA(mtDNA)稳态失衡,mtDNA从线粒体泄漏至胞质中,进而激活cGAS-STING信号通路,引发TBK1-IRF3级联反应,最终导致干扰素(IFNs)及相关炎症基因高表达,诱发内在炎症反应。ConA或ddC处理可显著减少胞质游离mtDNA含量,抑制TBK1-IRF3信号通路激活,降低炎症因子表达水平。单细胞RNA测序结果证实,ConA或ddC处理可使衰老HSCs的基因表达谱趋近年轻状态,下调干扰素应答、氧化磷酸化和细胞周期相关通路,稳定干细胞稳态。
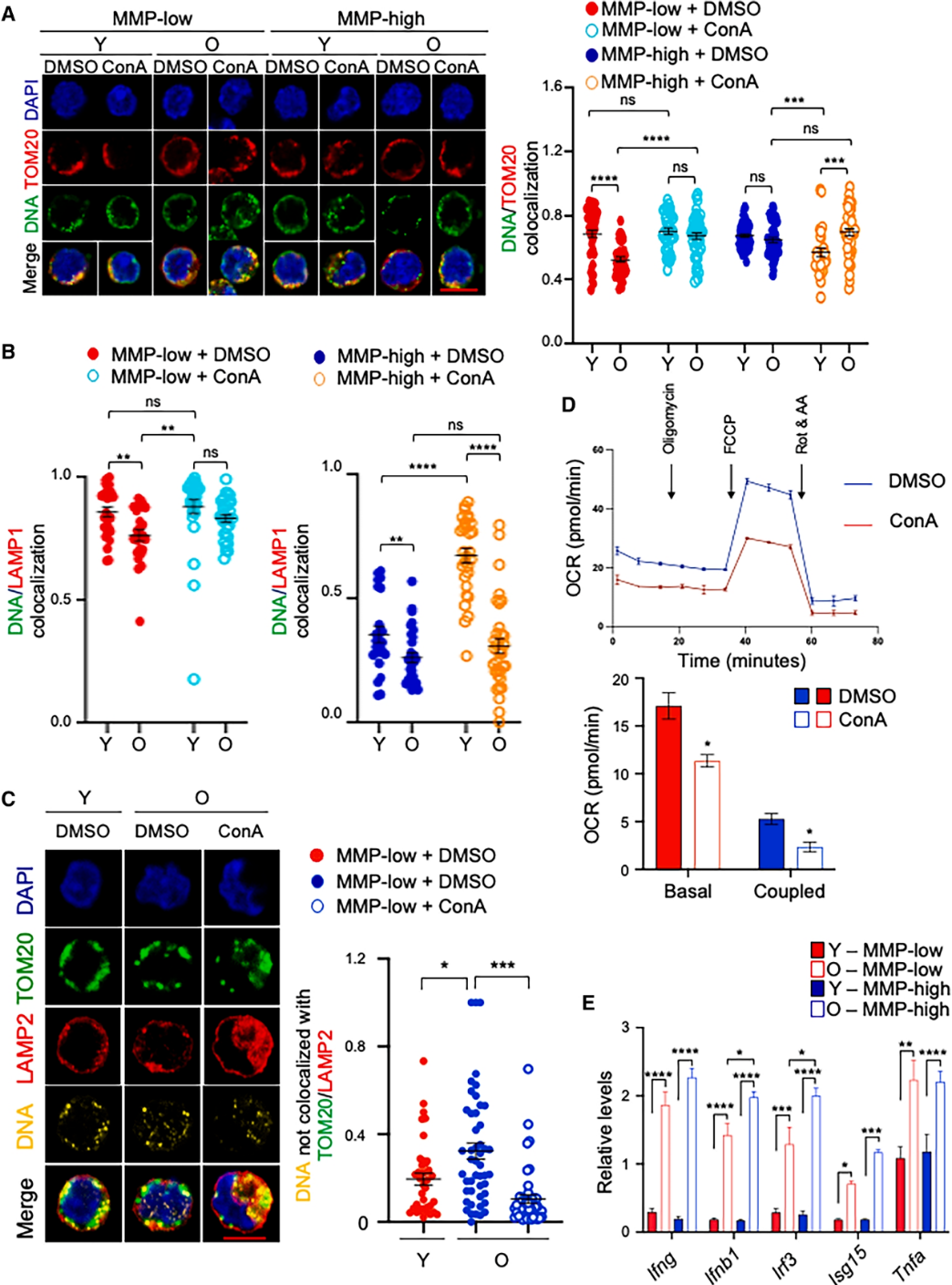
图5. 抑制溶酶体活性改善衰老HSCs中线粒体DNA的亚细胞定位
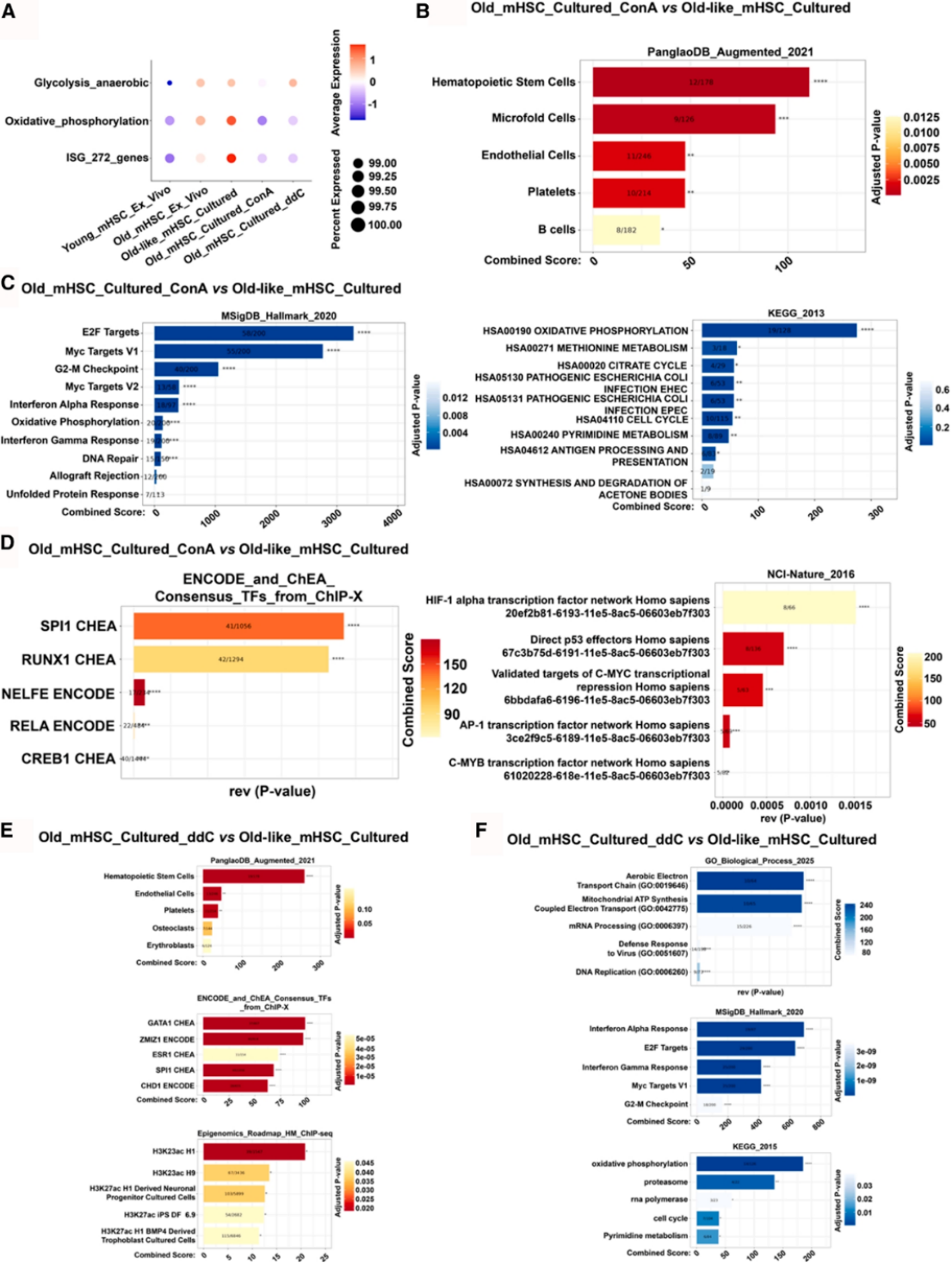
图6 . ConA 和ddC治疗在单细胞水平上对老年mHSC与年轻mHSC的影响
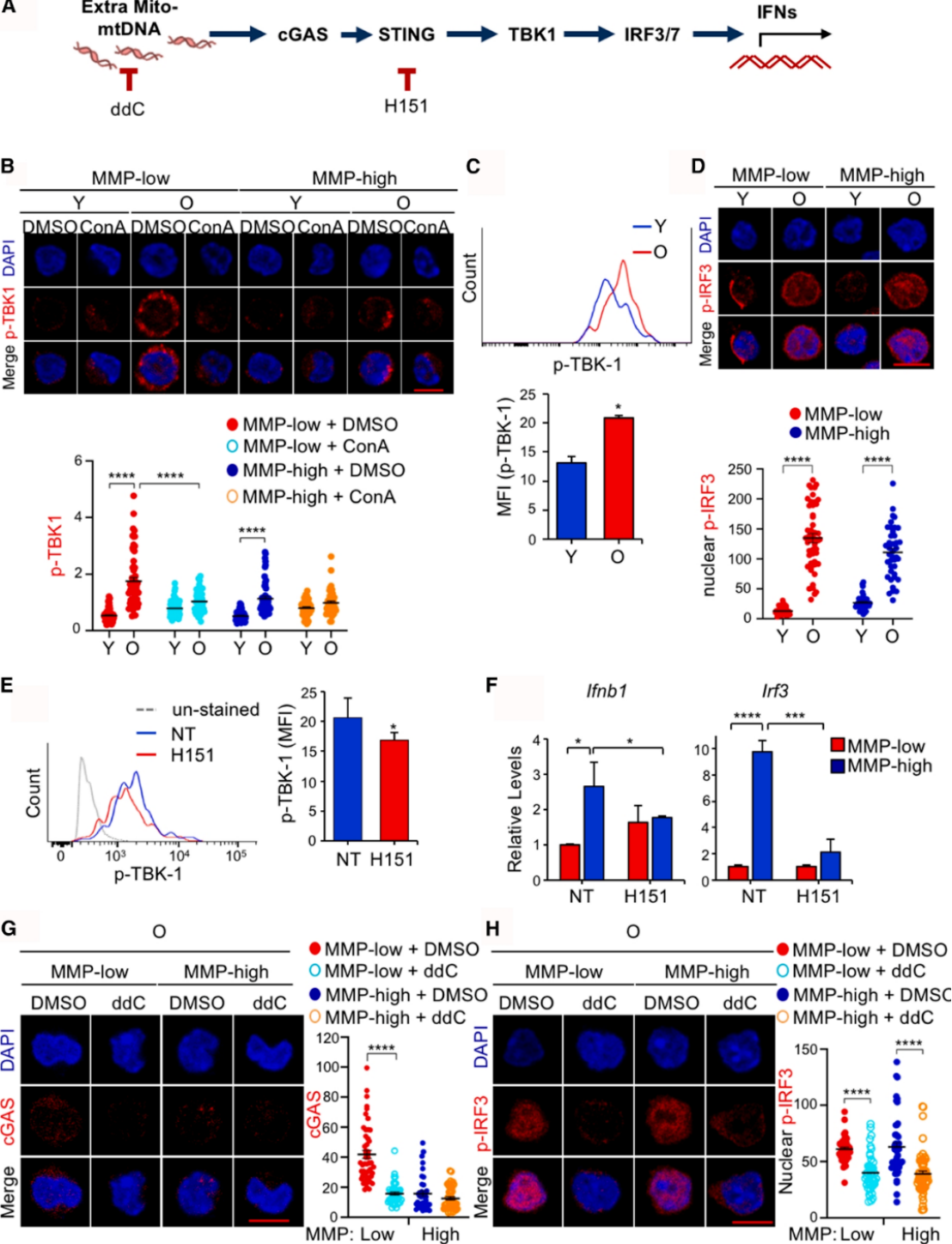
图7. 抑制溶酶体活性可减少衰老造血干细胞中的炎症反应及干扰素信号传导
三、讨论与展望
本研究首次明确溶酶体功能异常是造血干细胞(HSCs)衰老的核心驱动因素,深入揭示了“mtDNA逃逸-cGAS-STING-炎症激活”分子调控轴在HSCs衰老进程中的关键介导作用。衰老HSCs中溶酶体呈现的过度酸化、结构损伤及活性异常特征,可能通过加剧线粒体损伤诱发mtDNA泄漏,进而激活下游炎症信号通路,形成“溶酶体异常-线粒体损伤-炎症激活”的恶性循环,最终导致HSCs增殖能力下降、分化失衡及功能衰退。v-ATPase作为调控溶酶体酸化的核心分子,成为逆转HSCs衰老的关键潜在靶点,而伴胞霉素A(ConA)通过特异性抑制v-ATPase活性,成功打破上述恶性循环,实现了溶酶体功能修复、线粒体稳态重建、炎症反应抑制及干细胞干性恢复的多重效应。这一发现不仅丰富了干细胞衰老的分子机制理论体系,更为抗衰老干预策略的开发提供了明确的作用靶点,尤其ConA处理可恢复衰老HSCs的分化平衡,减少髓系细胞过度生成,对降低髓系恶性肿瘤发病风险具有重要的临床意义,且该干预模式通过修复干细胞内在功能发挥作用,有效规避了传统策略可能引发的副作用,具备良好的转化应用前景。
本研究为造血系统衰老相关疾病(如老年性贫血、免疫衰退)及血液系统恶性肿瘤的治疗提供了全新思路,而LabEx成熟的多技术平台体系可为后续研究的深入推进提供全方位技术支撑。未来研究可依托LabEx的单细胞测序平台,进一步解析v-ATPase抑制剂干预后HSCs异质性群体的基因表达动态变化,精准定位关键应答亚群;借助空间多组学技术,在组织水平可视化溶酶体-线粒体功能互作的修复过程;利用蛋白芯片、MSD电化学发光等多因子检测平台,系统筛选干预前后炎症因子、造血调控因子的表达谱差异,完善“溶酶体修复-信号通路调控”的分子网络;同时可通过LabEx的流式检测、免疫组化等技术,优化ConA的给药方式与剂量,提升体内靶向性与安全性。此外,还可基于LabEx的多组学整合分析能力,探索“v-ATPase抑制+线粒体功能调节”的联合干预策略,最大化抗衰老效应;并依托其成熟的临床样本检测服务体系,将研究拓展至人类造血干细胞及临床样本层面,通过PCR Array、ELISA等技术验证该策略的临床转化价值。通过上述研究与技术的深度结合,有望开发出针对造血系统衰老相关疾病的新型治疗方案,为白血病等血液系统恶性肿瘤的预防与治疗开辟新的干预路径。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


