一、研究背景
慢性萎缩性胃炎以胃黏膜腺体萎缩和慢性炎症为主要特征,是消化系统常见疾病,也是胃癌演进的重要癌前病变。除幽门螺杆菌感染这一主要致病因素外,化学暴露、氧化应激及免疫功能紊乱等均参与CAG的发病过程。白细胞介素作为重要的免疫调控分子,在胃黏膜炎症反应和稳态维持中扮演关键角色。IL-33作为IL-1家族的新型成员,可通过其受体ST2介导上皮细胞与免疫细胞间的相互作用,参与多种炎症性疾病的发生发展,但目前其在CAG中的具体作用及调控机制仍不清楚。 细胞自噬是维持细胞内环境稳态的重要生物学过程,通过降解受损细胞器和异常蛋白参与细胞存活调控。近年来研究表明,自噬异常与胃黏膜病变密切相关,但自噬在CAG发生发展中的功能及调控网络尚未完全阐明。胃黏膜保护蛋白GKN1主要表达于胃上皮细胞,具有维持胃黏膜屏障完整性、抑制炎症反应等功能,其表达下调与胃黏膜损伤及癌变密切相关。本研究旨在明确IL-33在CAG中的表达特征、调控机制及其与自噬、GKN1的相互作用,为解析CAG的发病机制提供新视角。

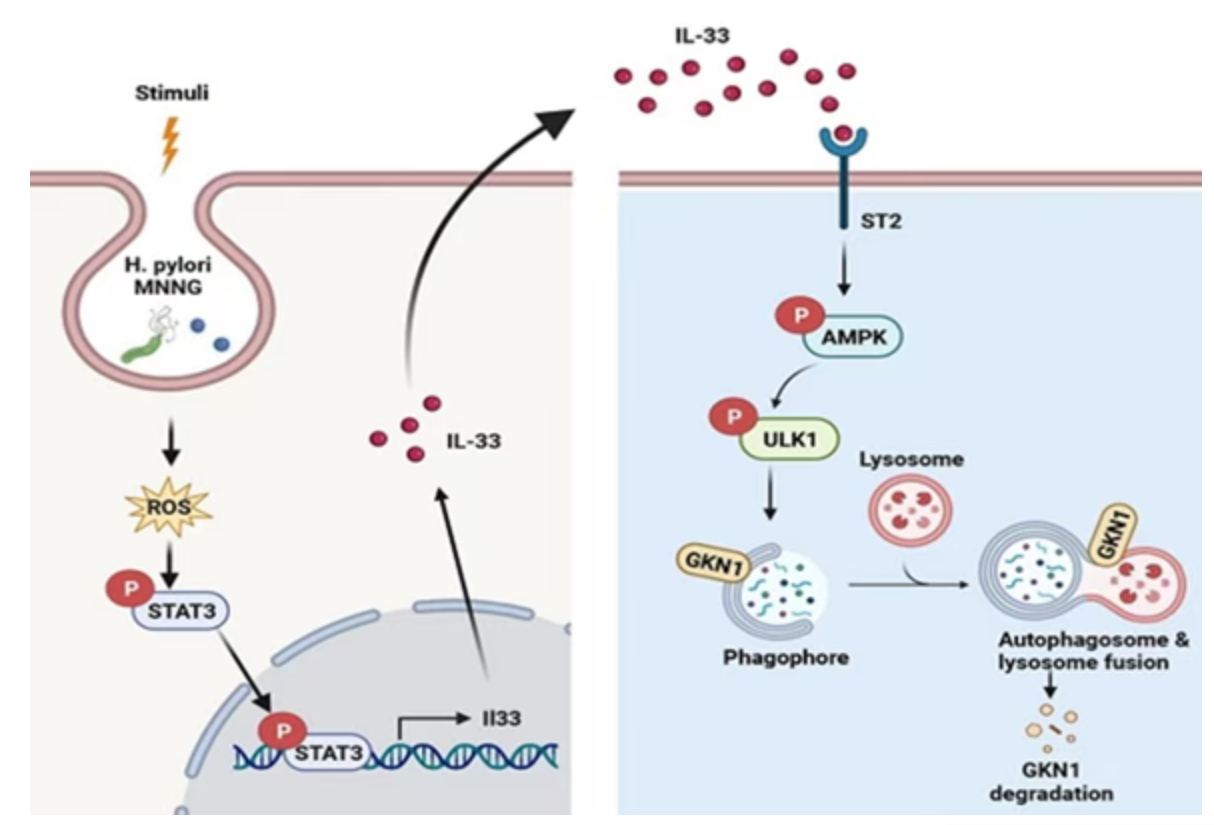
Liu K, Huang H, et al. IL-33 Accelerates Chronic Atrophic Gastritis through AMPK-ULK1 Axis Mediated Autolysosomal Degradation of GKN1. Int J Biol Sci. 2024 Apr 8;20(6):2323-2338.
二、材料与方法
(一)实验动物与模型构建
构建CAG小鼠模型,分为野生型小鼠和IL-33基因敲除小鼠。通过原位注射靶向ST2的腺相关病毒构建ST2敲低小鼠模型。部分小鼠在建模期间给予自噬抑制剂3-甲基腺嘌呤(3-MA)口服、自噬诱导剂雷帕霉素处理或ROS清除剂NAC干预。向小鼠腹腔注射重组IL-33蛋白模拟CAG样病变。
(二)细胞实验
采用人胃上皮细胞系GES-1,分别用幽门螺杆菌、化学致癌物MNNG刺激,部分细胞预处理ROS清除剂NAC或STAT3抑制剂。通过敲低AMPK、ULK1或STAT3基因,观察其对IL-33表达及自噬的影响。
(三)检测方法
采用转录组测序分析CAG小鼠胃组织中白细胞介素家族表达谱;通过Western blot、免疫荧光染色检测IL-33、ST2、AMPK、ULK1、GKN1、自噬标志物(LC3B、p62)等蛋白的表达水平及定位;利用实时荧光定量PCR检测相关基因的mRNA表达;通过血清学检测分析胃蛋白酶原A(PGA)、胃蛋白酶原C(PGC)水平;采用磷酸化蛋白质组学分析IL-33刺激后胃上皮细胞的磷酸化蛋白变化。
三、研究结果
(一)IL-33在CAG中特异性高表达
转录组测序结果显示,在CAG小鼠胃组织中,IL-33是白细胞介素家族中表达上调最为显著的成员。Western blot和免疫荧光结果证实,CAG小鼠血清及胃组织中IL-33的蛋白水平显著升高,且主要定位于胃黏膜上皮细胞。而其受体ST2的表达在正常小鼠与CAG小鼠间无显著差异,提示IL-33在CAG中存在特异性高表达特征。
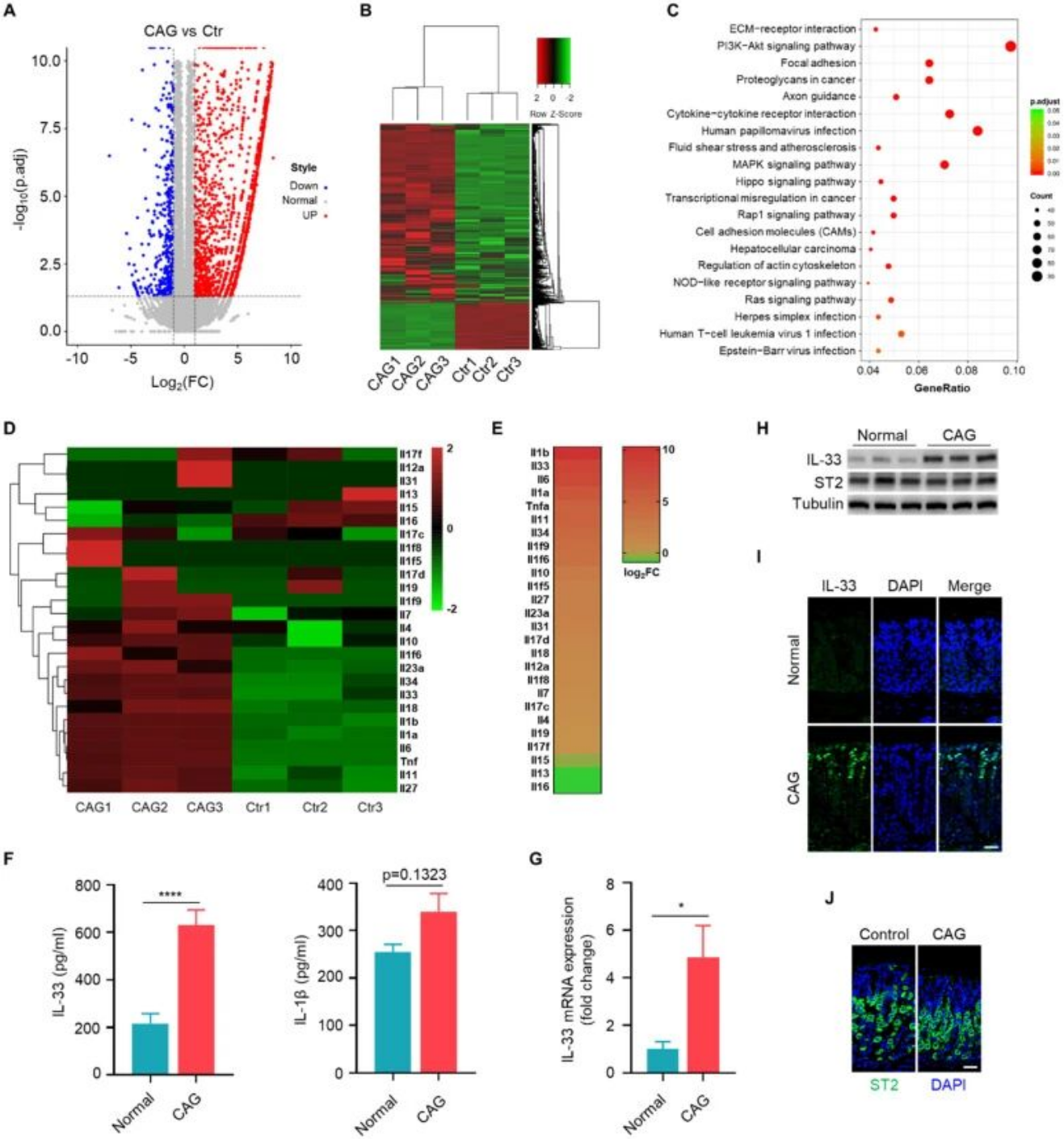
图1. IL-33是慢性萎缩性胃炎中表达最显著的白细胞介素
Liu K, Huang H, et al. IL-33 Accelerates Chronic Atrophic Gastritis through AMPK-ULK1 Axis Mediated Autolysosomal Degradation of GKN1. Int J Biol Sci. 2024 Apr 8;20(6):2323-2338.
(二)幽门螺杆菌/MNNG通过ROS-STAT3信号通路上调IL-33表达
幽门螺杆菌和MNNG刺激均可显著诱导GES-1细胞中IL-33的mRNA和蛋白表达,同时导致细胞内活性氧(ROS)水平升高。ROS清除剂NAC可有效抑制幽门螺杆菌或MNNG诱导的IL-33表达及其启动子活性。转录因子筛选实验表明,STAT3是介导这一过程的关键分子,幽门螺杆菌和MNNG可激活STAT3的磷酸化及其核转位,敲低或抑制STAT3则显著降低IL-33的转录与蛋白水平,证实幽门螺杆菌/MNNG通过ROS-STAT3信号通路调控IL-33表达。
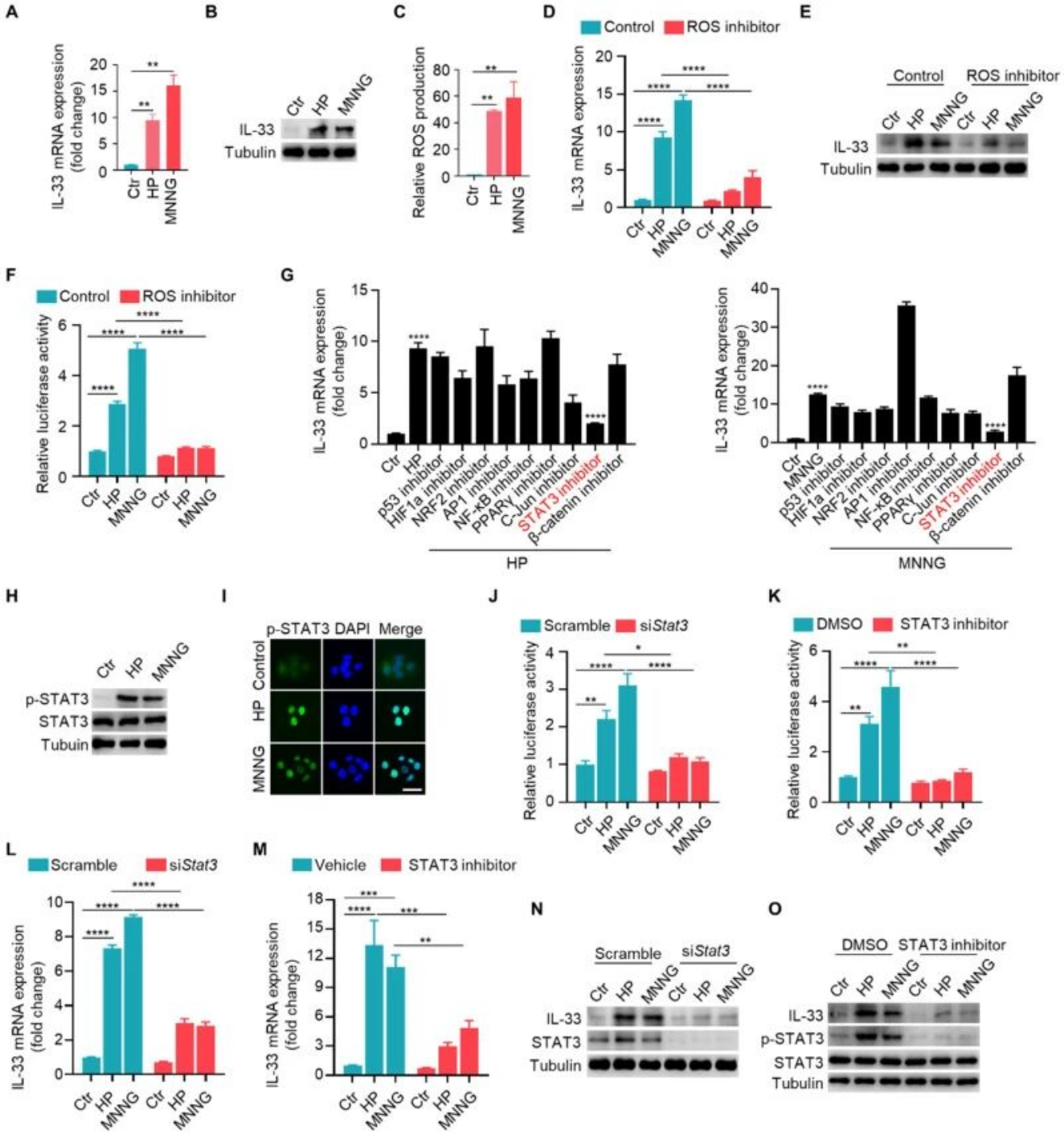
图2. 幽门螺杆菌/MNNG通过ROS-STAT3信号通路诱导IL-33表达
Liu K, Huang H, et al. IL-33 Accelerates Chronic Atrophic Gastritis through AMPK-ULK1 Axis Mediated Autolysosomal Degradation of GKN1. Int J Biol Sci. 2024 Apr 8;20(6):2323-2338.
(三)IL-33/ST2信号轴促进CAG的发生发展
与野生型CAG小鼠相比,IL-33基因敲除小鼠胃黏膜的炎性细胞浸润减少,壁细胞丢失减轻,壁细胞标志物ATP4B表达升高;促炎因子TNF-α和IL-6表达下降,组胺H2受体水平恢复,血清PGA、PGC水平及其比值趋于正常。原位注射靶向ST2的腺相关病毒敲低ST2表达后,获得了与IL-33敲除一致的表型改善,表明IL-33通过其受体ST2介导CAG的病理进展。
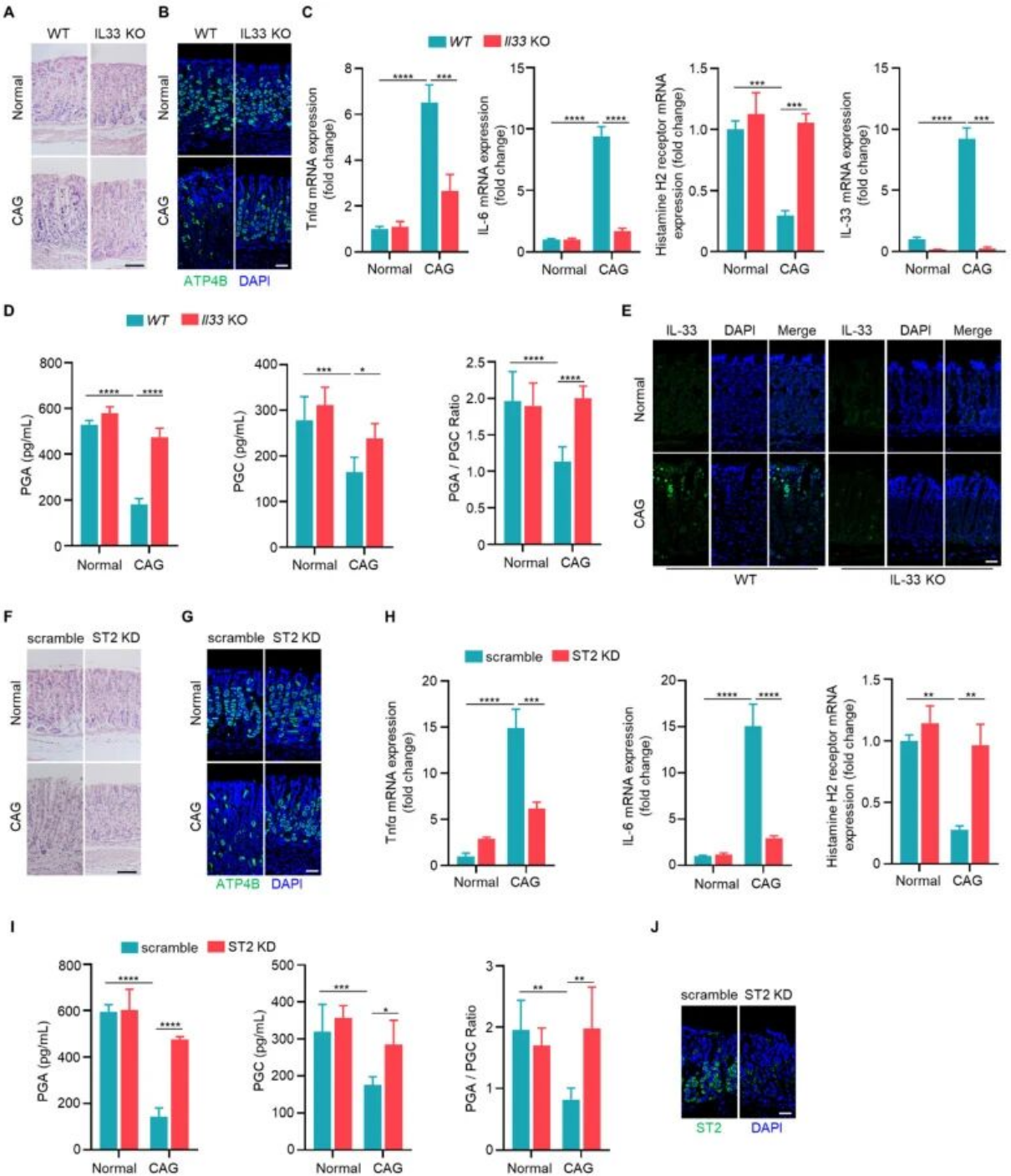
图3. IL-33/ST2参与慢性萎缩性胃炎的发病机制
Liu K, Huang H, et al. IL-33 Accelerates Chronic Atrophic Gastritis through AMPK-ULK1 Axis Mediated Autolysosomal Degradation of GKN1. Int J Biol Sci. 2024 Apr 8;20(6):2323-2338.
(四)IL-33以AMPK-ULK1轴依赖的方式增强胃上皮细胞自噬
磷酸化蛋白质组学分析显示,IL-33刺激后胃上皮细胞中AMPK信号通路和自噬通路被显著激活。验证实验证实,IL-33可时间依赖性诱导AMPK和ULK1的磷酸化,同时增加自噬标志物LC3-II/I比值,促进p62蛋白降解和GFP-LC3斑点形成,表明IL-33可诱导胃上皮细胞自噬。该自噬过程不依赖新蛋白质合成,敲低或抑制AMPK、ULK1均可抑制IL-33诱导的自噬。体内实验显示,IL-33敲除或ST2敲低的CAG小鼠胃组织中,p-AMPK、p-ULK1及LC3B水平均显著降低。
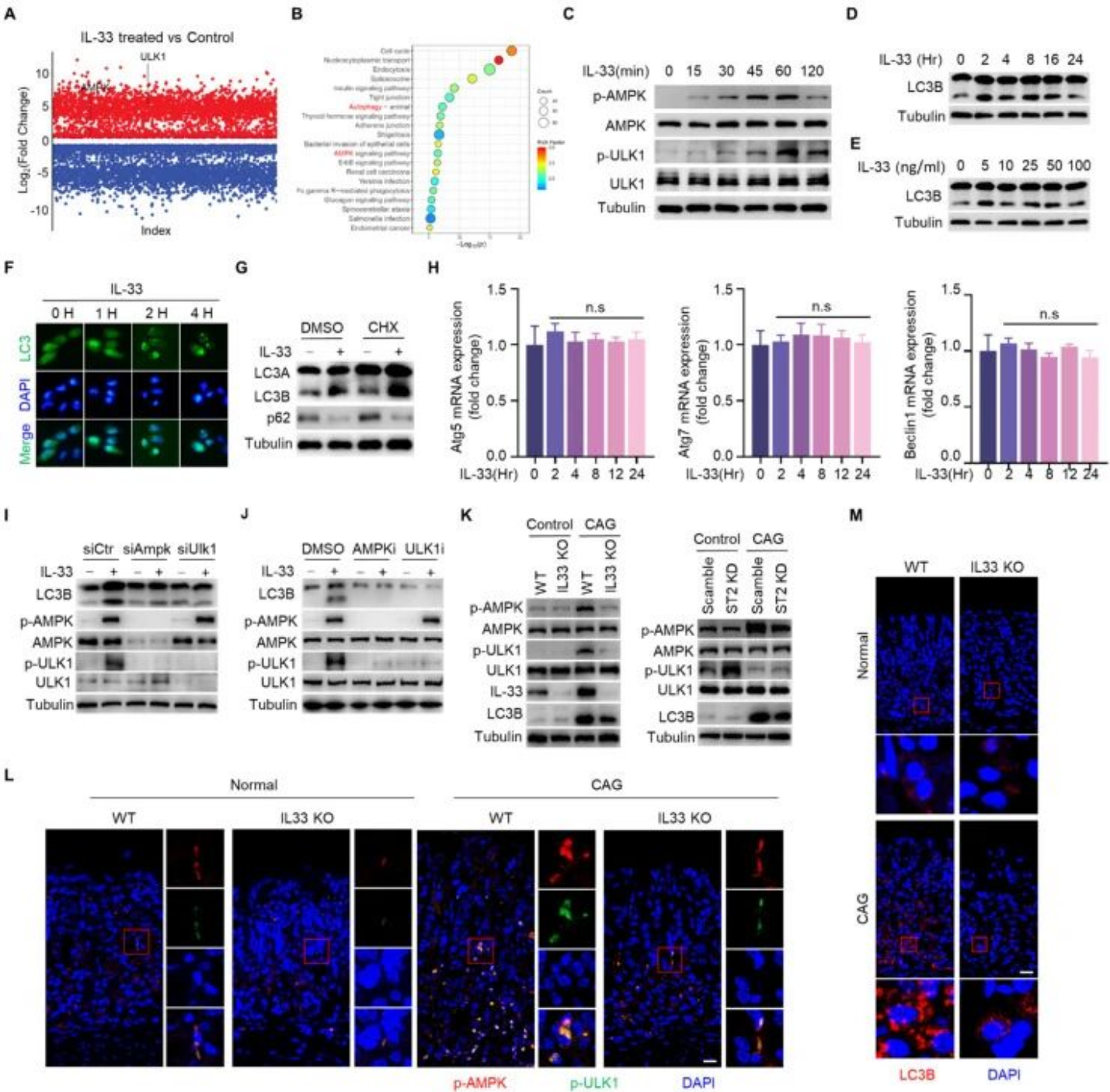
图4. IL-33以AMPK-ULK1轴依赖的方式增强胃上皮细胞自噬
Liu K, Huang H, et al. IL-33 Accelerates Chronic Atrophic Gastritis through AMPK-ULK1 Axis Mediated Autolysosomal Degradation of GKN1. Int J Biol Sci. 2024 Apr 8;20(6):2323-2338.
(五)自噬促进CAG的病理进展
CAG模型小鼠口服自噬抑制剂3-MA后,黏膜炎症细胞浸润显著减轻,壁细胞数量增加,促炎因子表达下调,组胺H2受体上调,血清PGA、PGC水平及其比值恢复正常,且3-MA不影响AMPK和ULK1的磷酸化。相反,自噬诱导剂雷帕霉素可单独诱导壁细胞丢失,并在CAG模型中加剧炎症反应、降低血清胃蛋白酶原水平、增强LC3B表达,证实自噬在CAG中具有促病作用。
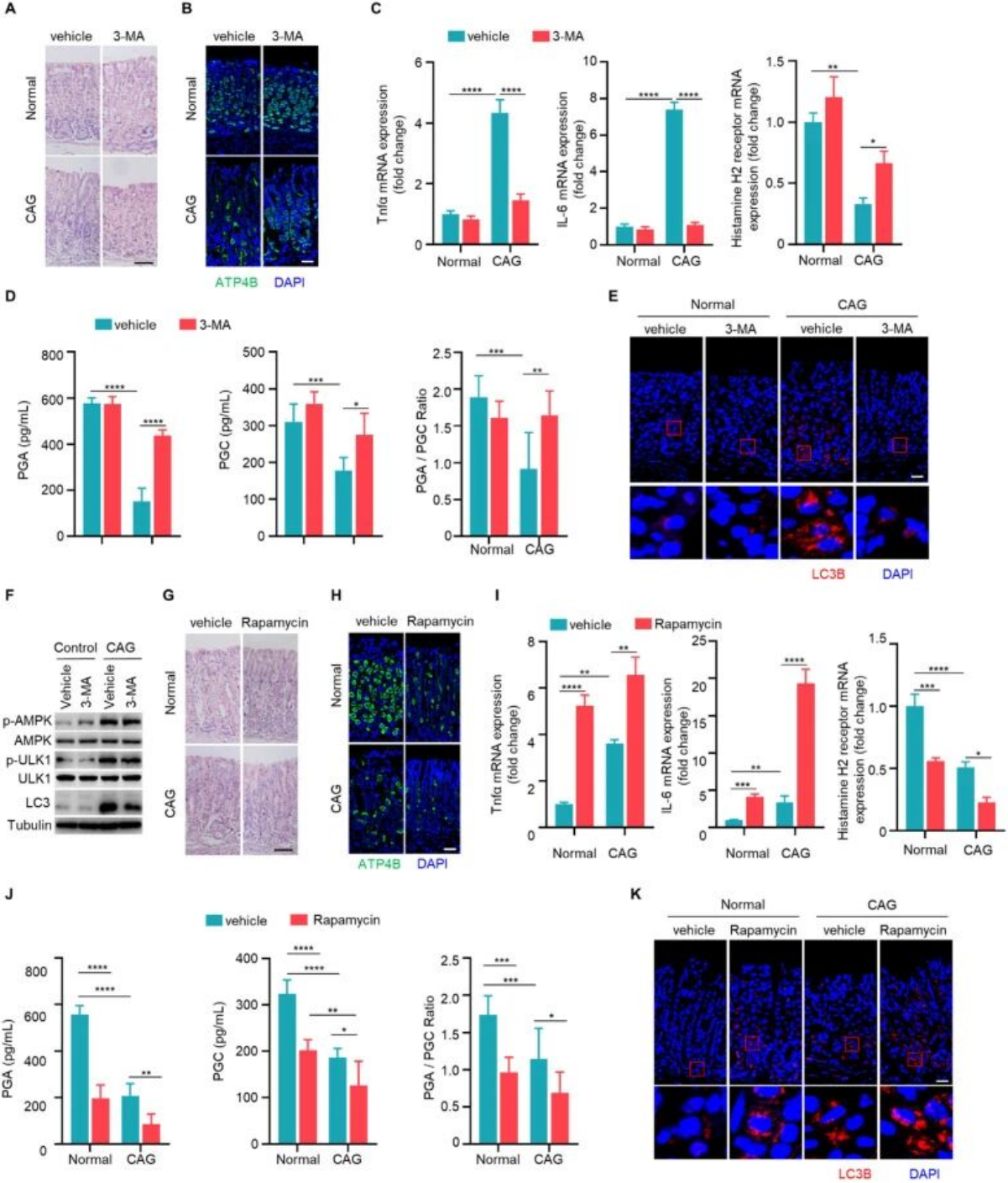
图5. 自噬促进慢性萎缩性胃炎的发展
Liu K, Huang H, et al. IL-33 Accelerates Chronic Atrophic Gastritis through AMPK-ULK1 Axis Mediated Autolysosomal Degradation of GKN1. Int J Biol Sci. 2024 Apr 8;20(6):2323-2338.
(六)IL-33通过自噬促进CAG发生
腹腔注射重组IL-33蛋白可诱导小鼠出现CAG样病变,包括炎性浸润增加、壁细胞减少、促炎因子升高、保护性受体下调及血清胃蛋白酶原水平降低。同时给予自噬抑制剂3-MA可显著缓解上述病变,并抑制IL-33引起的LC3B增加,但不影响AMPK和ULK1的磷酸化,表明IL-33的致病作用依赖于自噬激活。
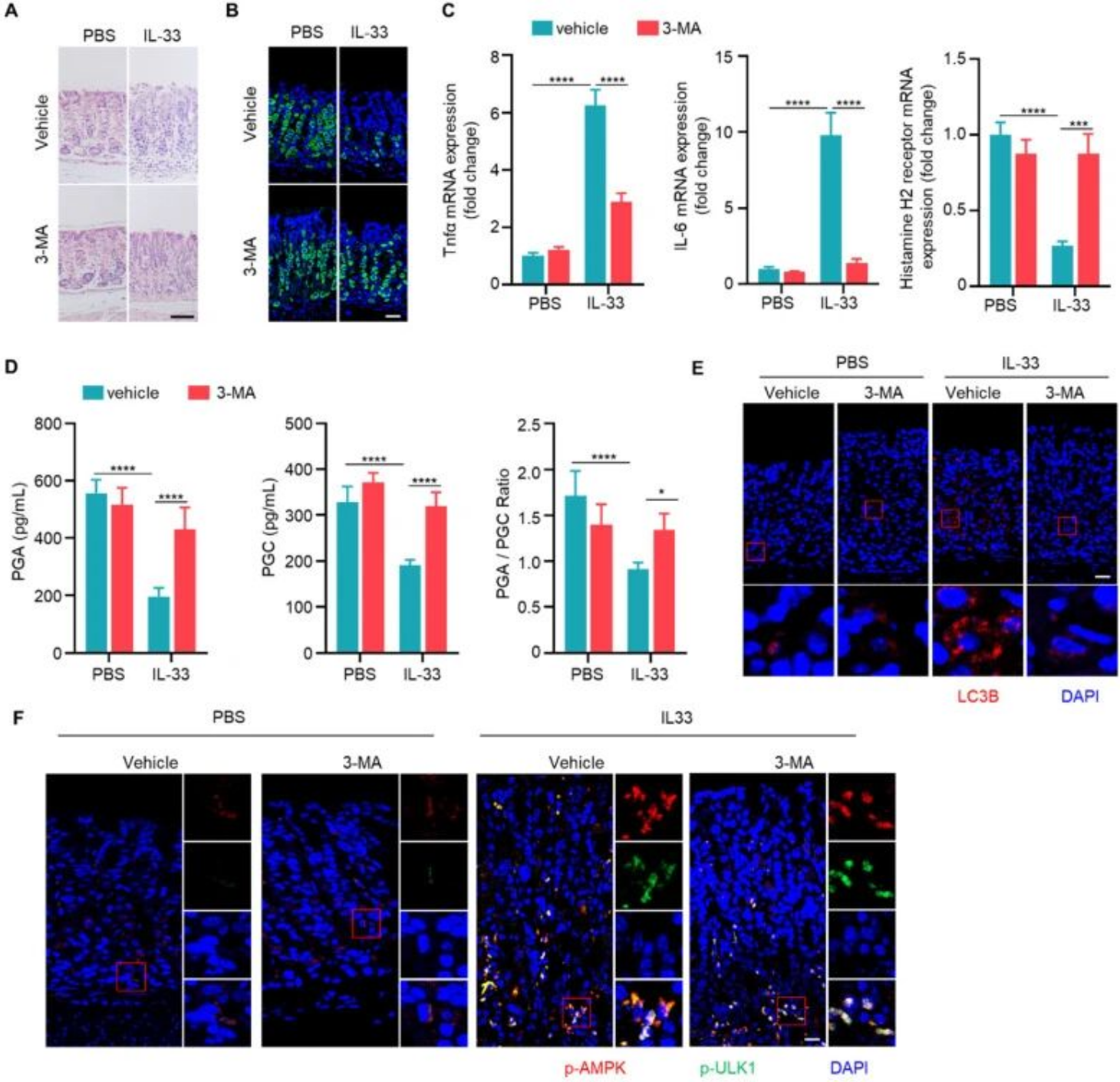
图6. IL-33通过自噬促进慢性萎缩性胃炎
Liu K, Huang H, et al. IL-33 Accelerates Chronic Atrophic Gastritis through AMPK-ULK1 Axis Mediated Autolysosomal Degradation of GKN1. Int J Biol Sci. 2024 Apr 8;20(6):2323-2338.
(七)IL-33通过自噬-溶酶体途径特异性降解GKN1
IL-33可时间和剂量依赖性降低胃上皮细胞中GKN1的蛋白水平,但对GKN2、GKN3的蛋白水平及GKNs家族的mRNA表达无显著影响。进一步研究发现,IL-33可显著缩短GKN1蛋白的半衰期,溶酶体抑制剂巴弗洛霉素A1(BAF-A1)可阻断IL-33引起的GKN1降解,而蛋白酶体制剂MG132无此作用。免疫荧光共定位显示,IL-33刺激后GKN1与溶酶体标志物LAMP2的共定位增加。临床样本分析显示,CAG患者胃组织中IL-33蛋白表达升高,而GKN1表达降低,血清中也呈现IL-33升高、GKN1下降的趋势。
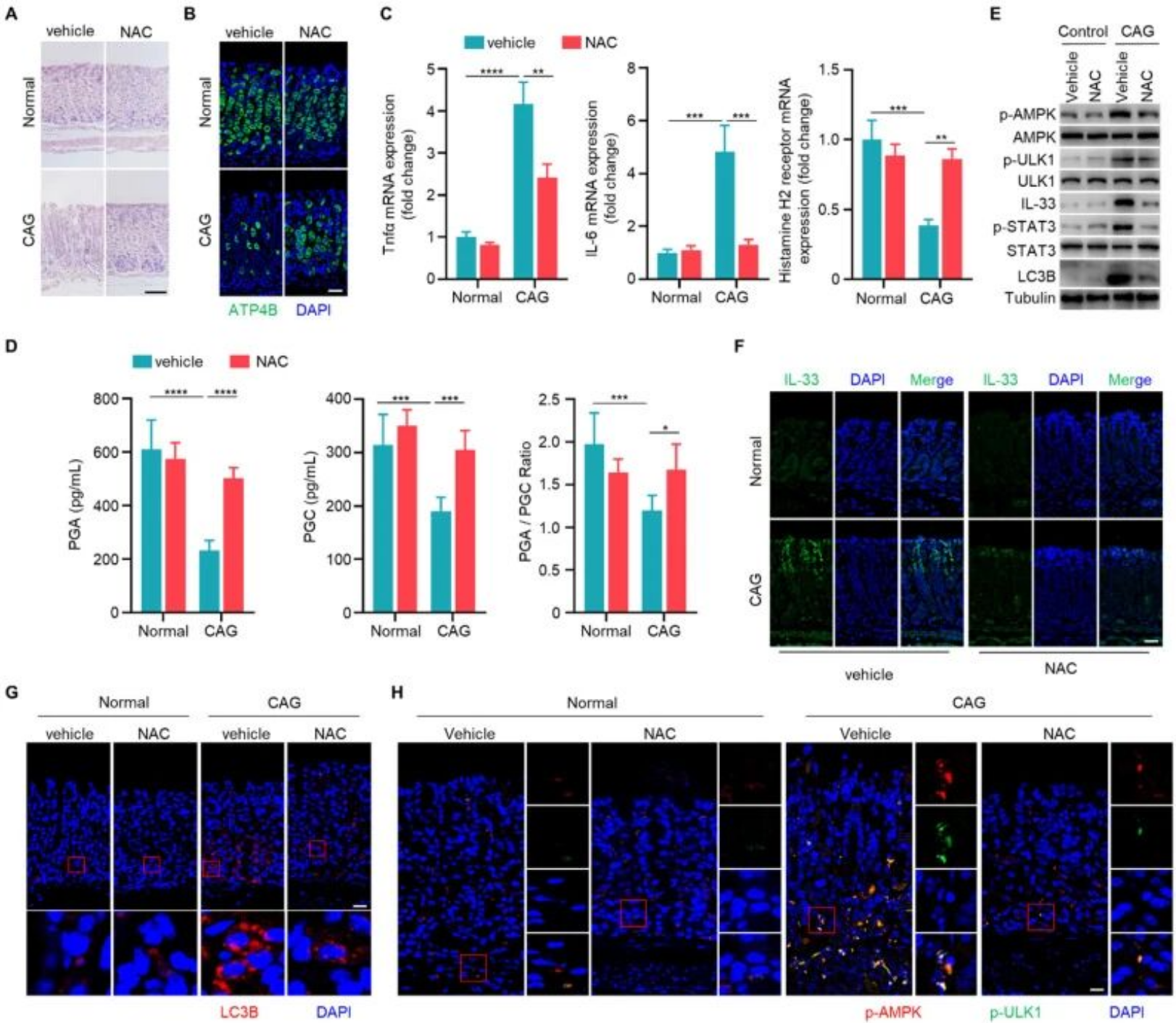
图7. 清除ROS通过降低IL-33表达和抑制自噬改善慢性萎缩性胃炎
Liu K, Huang H, et al. IL-33 Accelerates Chronic Atrophic Gastritis through AMPK-ULK1 Axis Mediated Autolysosomal Degradation of GKN1. Int J Biol Sci. 2024 Apr 8;20(6):2323-2338.
(八)清除ROS可通过降低IL-33表达及抑制自噬改善CAG
CAG模型小鼠使用ROS清除剂NAC后,壁细胞数量增加,炎症浸润减少,炎症因子谱改善,血清胃蛋白酶原水平恢复正常。机制上,NAC处理可抑制STAT3的活化,降低IL-33的表达,同时减弱AMPK-ULK1磷酸化和自噬标志物LC3B的形成,表明清除ROS可通过抑制IL-33表达及其下游自噬通路缓解CAG。
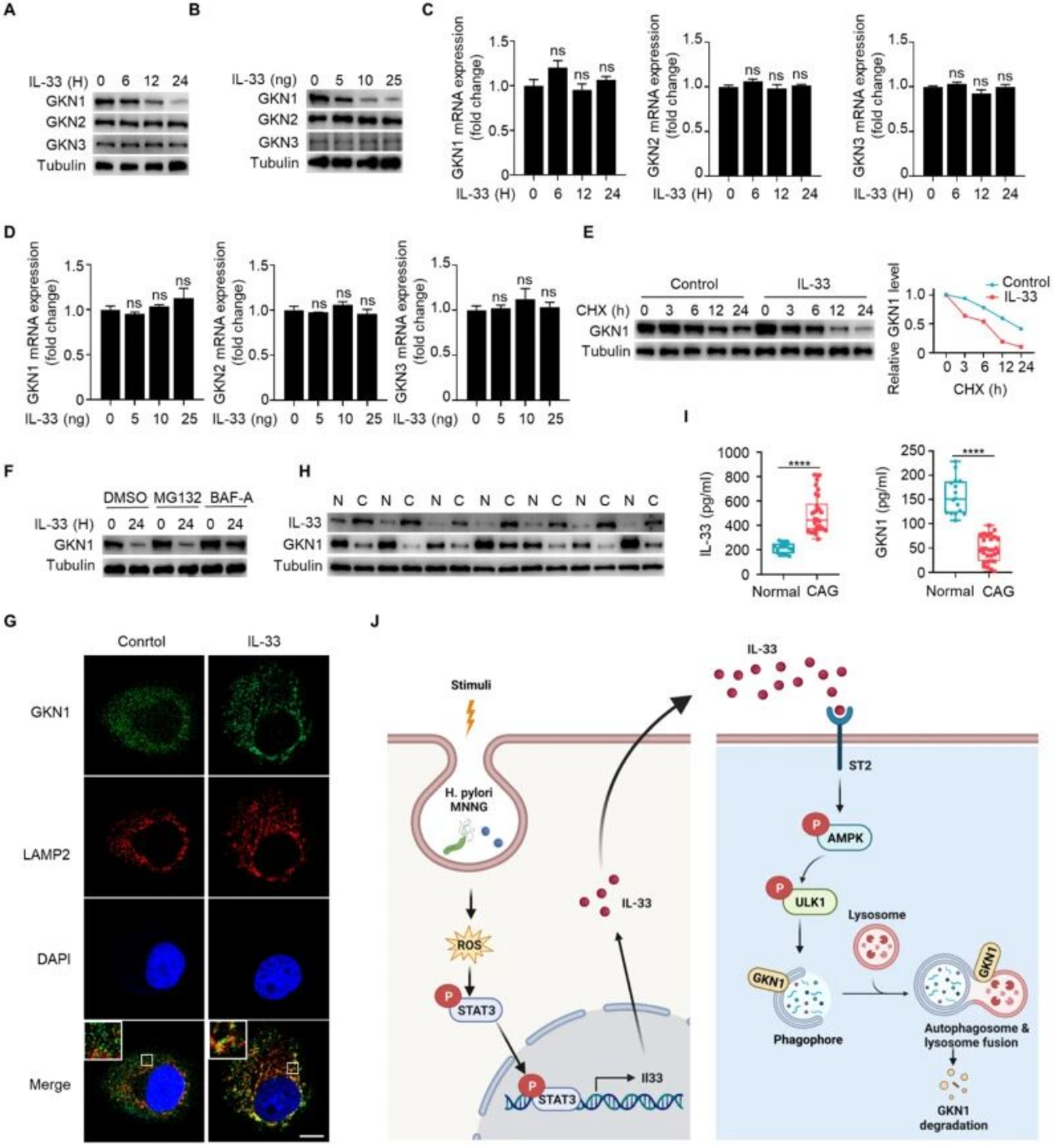
图8. IL-33通过自噬溶酶体途径促进GKN1降解
Liu K, Huang H, et al. IL-33 Accelerates Chronic Atrophic Gastritis through AMPK-ULK1 Axis Mediated Autolysosomal Degradation of GKN1. Int J Biol Sci. 2024 Apr 8;20(6):2323-2338.
四、炎症因子检测服务哪个公司有?
本研究通过系统的体内外实验,成功阐明了IL-33在慢性萎缩性胃炎(CAG)发生发展中的核心致病机制,构建了“ROS-STAT3→IL-33→AMPK-ULK1→自噬→GKN1降解→黏膜萎缩”的完整信号调控轴,为CAG的病理机制解析提供了全新视角。研究首次证实,IL-33是CAG组织中表达上调最为显著的白细胞介素,其表达受幽门螺杆菌和化学致癌物MNNG的诱导,且这一调控过程依赖ROS-STAT3信号通路的激活。后续机制研究进一步揭示,IL-33通过其受体ST2启动下游信号,特异性激活AMPK-ULK1轴介导的细胞自噬,进而通过自噬-溶酶体途径靶向降解胃黏膜保护蛋白GKN1,导致胃黏膜屏障功能受损,最终加速炎症浸润和腺体萎缩进程,形成了从上游诱导信号到下游病理效应的完整逻辑闭环。 在机制创新层面,本研究突破了以往对IL-33在胃部炎症中作用的认知局限,首次明确其在胃上皮细胞中通过AMPK-ULK1轴调控自噬的独特模式,并鉴定GKN1为该自噬过程的特异性降解靶点,建立了炎症信号、自噬调控与黏膜保护蛋白代谢之间的关键分子联系,为理解CAG中“炎症-自噬-组织损伤”的级联反应提供了核心理论支撑。而在转化应用价值上,临床样本分析显示CAG患者血清中IL-33与GKN1水平呈显著负相关,这一特征为CAG的早期诊断提供了潜在的联合检测标志物;同时,动物实验证实清除ROS(NAC干预)或抑制自噬(3-MA干预)可有效缓解CAG病理表型,明确了ROS、IL-33及自噬通路作为CAG靶向治疗的关键靶点,为后续治疗药物研发提供了重要方向。 值得注意的是,本研究中多个核心结论的验证依赖于对IL-33、TNF-α、IL-6等炎症因子,以及GKN1等功能蛋白的精准定量检测,而这类多指标同步检测的需求恰与LabEx多因子检测服务的技术优势高度契合。
LabEx可提供包括Luminex、MSD、ELISA等多种技术平台的多因子检测方案,能够实现对血清、组织匀浆等多种样本中IL-33、STAT3通路相关分子、自噬标志物及GKN1家族蛋白等的同步定量分析,其高灵敏度、高特异性的检测特性可精准捕捉样本中目标分子的表达差异,为机制研究中“信号通路上下游分子关联性验证”“临床样本标志物筛选”等关键环节提供可靠的数据支持。
综上所述,本研究揭示的IL-33-AMPK-ULK1-自噬-GKN1轴为CAG的机制研究与转化应用开辟了新路径,而LabEx多因子检测服务作为高效的技术支撑工具,可在炎症因子谱分析、通路分子验证、临床标志物筛选等方面为相关研究提供精准、高效的检测解决方案,助力加速CAG及其他消化系统炎症性疾病的机制解析与转化医学研究进程。
LabEx多款现货Panel支持炎症相关因子检测,欢迎咨询~
| 乐备实官网货号 | 中文名称 | 技术平台 | 检测指标 |
| LXMH10-1 | 人炎症10因子Panel | MSD | IFN-γ,IL-1β,IL-2,IL-4,IL-6,IL-8,IL-10,IL-12p70,IL-13,TNF-α |
| LXLBH10-1 | 人炎症10因子Panel | Luminex | IL-1 β/IL-1F2,IL-2,IL-4,IL-6 ,IL-8/CXCL8,IL-10,IL-12 p70,IL-13,TNF-α,IFN-γ |
| LXMM10-1 | 小鼠炎症10因子Panel | MSD | IFN-γ,IL-1β,IL-2,IL-4,IL-5,IL-6,IL-10,IL-12p70,KC/GRO,TNF-α |
| LXLBM10-1 | 小鼠炎症10因子Panel | Luminex | IL-1 β/IL-1F2,IL-2,IL-4,IL-5,IL-6 ,IL-10,IL-12p70,CXCL1/GRO/α/KC/CINC-1,IFN-γ,TNF-α |
| LXLBR10-1 | 大鼠炎症10因子Panel | Luminex | IL-1 β/IL-1F2,IL-2,IL-4,IL-5,IL-6 ,IL-10,IL-12p70,CXCL1/GRO/α/KC/CINC-1,IFN-γ,TNF-α |
| LXLBM23-1 | 小鼠细胞因子-23因子Panel | Luminex | Eotaxin/CCL11,G-CSF,GM-CSF,IFN-γ,IL-10,IL-12(p40),IL-12(p70),IL-13,IL-17A,IL-1α,IL-1β,IL-2,IL-3,IL-4,IL-5,IL-6,IL-9,GRO-α (Gro-a/KC/CXCL1),MCP-1/CCL2,MIP-1α/CCL3,MIP-1β,RANTES,TNF-α |
| LXLBR23-1 | 大鼠细胞因子-23因子Panel | Luminex | G-CSF,GM-CSF,GRO/KC,IFN-γ,IL-1α,IL-1β,IL-2,IL-4,IL-5,IL-6,IL-7,IL-10,IL-12 (p70),IL-13,IL-17A,IL-18,M-CSF,MCP-1,MIP-1α,MIP-3α,RANTES,TNF-α,VEGF |












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


