一、技术概述
逆转录聚合酶链式反应,通常称为RT-PCR,是一项核心的分子生物学技术。该技术以核糖核酸(RNA)为起始模板,首先在逆转录酶的催化下合成互补DNA(cDNA),随后以该cDNA为模板,利用热稳定性DNA聚合酶进行定量的或定性的PCR扩增。整个流程包含逆转录与PCR扩增两个关键阶段,因其极高的灵敏度与特异性,能够实现对极低丰度RNA分子的有效检测与定量。目前,RT-PCR技术已广泛应用于基因表达分析、病原体检测、疾病机制研究及功能基因组学验证等多个重要领域。
二、实验方法分类:一步法与两步法
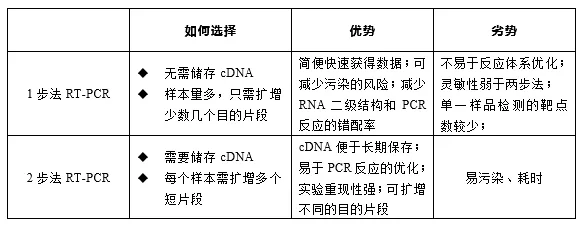
根据逆转录与PCR扩增步骤的整合方式,RT-PCR主要分为一步法和两步法两种操作模式。
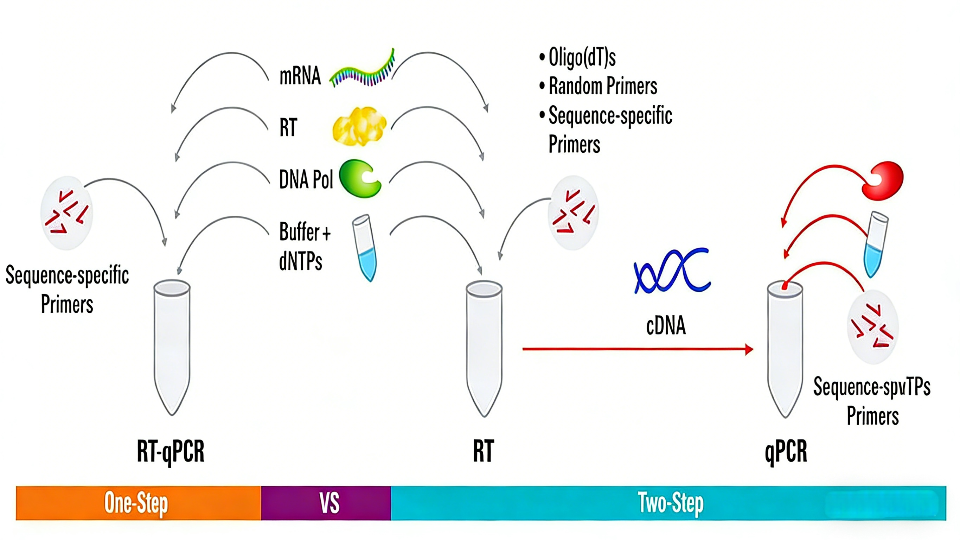
一步法将cDNA合成与后续PCR扩增整合在同一反应体系与反应管内连续完成。该方法操作简便,能最大程度减少样品处理步骤与交叉污染风险,适用于高通量检测。
两步法则将上述两个过程明确分离为独立的反应阶段。首先在专用体系中完成RNA到cDNA的逆转录,随后取部分cDNA产物作为模板,在新的反应体系中进行PCR扩增。该方法灵活性高,允许对两个反应步骤分别进行条件优化,尤其适合需要对同一份cDNA样本进行多基因靶标分析的研究。
三、模板选择原则
实验起始模板可选择总RNA或经过纯化的信使RNA(mRNA)。虽然使用mRNA可能在理论上提供略高的灵敏度,但在绝大多数研究应用中,采用总RNA作为模板具有更明显的综合优势。
首先,总RNA的制备流程更为简单直接,避免了mRNA分离所需的额外纯化步骤,这不仅有利于提高模板回收率,减少样本降解,也更便于将最终定量数据标准化至初始的细胞或组织量,从而提升数据的可比性。
其次,省略mRNA富集步骤,可以规避不同mRNA分子在纯化过程中因回收效率差异而引入的系统误差,从而保证基因表达相对定量结果的准确性。因此,在以可靠性与重复性为首要目标的实验中,总RNA通常是更为适用和稳妥的选择。
四、反转录酶的选择依据
反转录酶是催化由RNA合成cDNA的关键酶。其选择需考虑几个重要特性。部分反转录酶具有内源性RNase H活性,可降解逆转录产物中的RNA链,有利于后续扩增;若无此活性,常需外源添加RNase H以提升效率。不同来源的酶(如鼠白血病病毒或禽成髓细胞瘤病毒来源)在热稳定性、最适温度与持续合成能力上存在差异。
优先选用具有高热稳定性的反转录酶具有显著优势。较高的反应温度有助于降低RNA模板二级结构的稳定性,从而促进全长cDNA的合成,并能确保酶在整个反应过程中保持活性,最终获得产量更高、质量更优的cDNA,为后续精确分析奠定基础。
五、引物的选择与设计
逆转录步骤的引物主要有三类:Oligo(dT)引物、随机引物和基因特异性引物。Oligo(dT)引物通过结合真核mRNA的poly(A)尾起始合成,适用于完整mRNA。随机引物可在RNA模板多位点起始,适用于无poly(A)尾或结构复杂的RNA。基因特异性引物针对目标序列设计,能最大程度提高逆转录的特异性与效率。
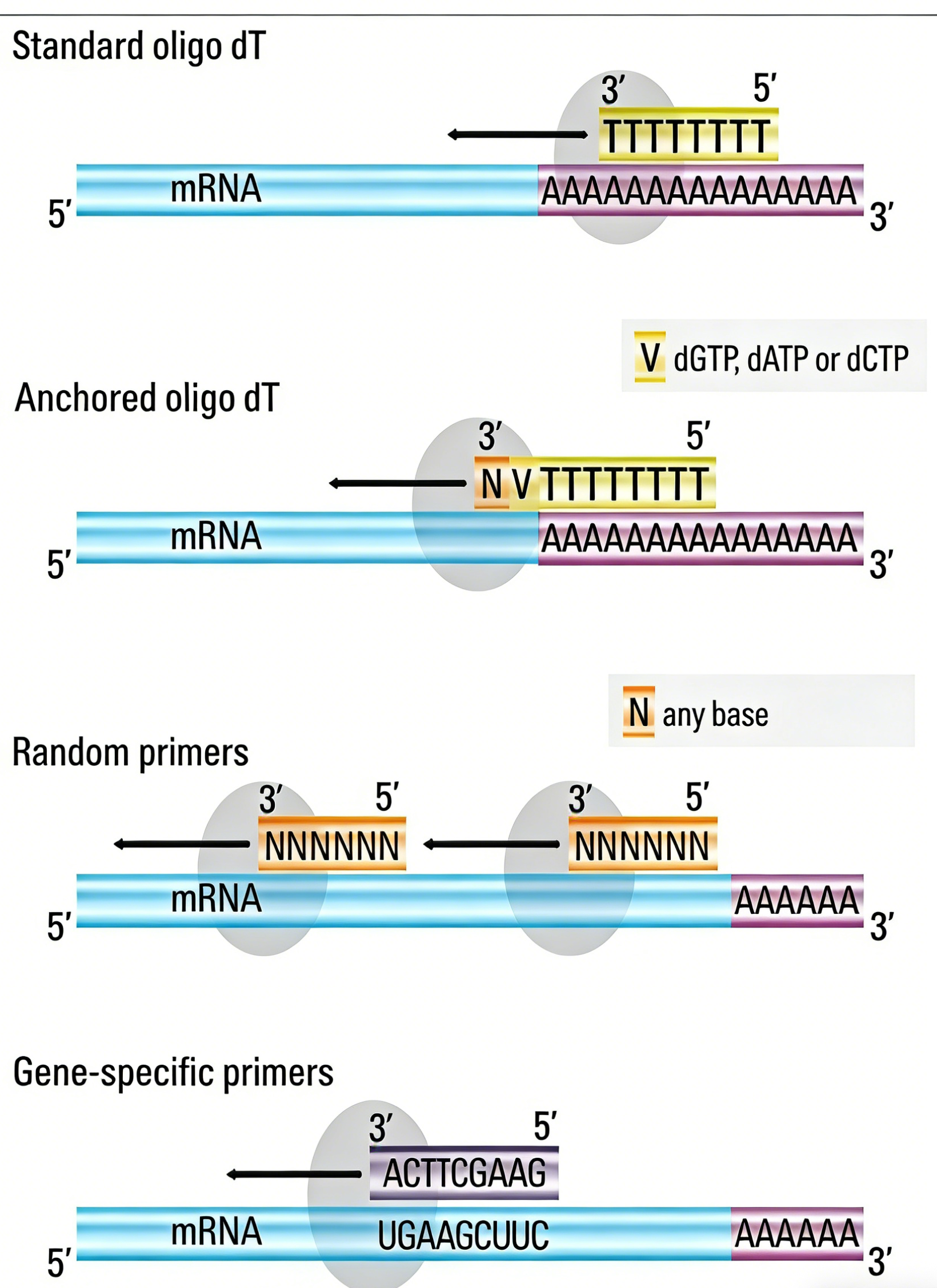
为确保后续PCR扩增的特异性与效率,引物设计需遵循核心原则:
1、序列保守性与特异性:引物应针对目标基因的保守区域设计,扩增子长度建议在100-200碱基对之间。为有效区分并排除可能污染的基因组DNA,引物设计应使其扩增区域跨越至少一个内含子,从而避免基因组DNA被扩增而产生假阳性信号。
2、物理化学参数:引物长度通常为18-25个核苷酸,熔解温度(Tm值)宜在50-65℃之间,鸟嘌呤(G)与胞嘧啶(C)的碱基含量控制在40%-60%为佳。设计时应避免出现连续四个或以上的G碱基,以防止形成不利于扩增的二级结构。
六、阴性对照的设置
严谨的实验设计必须包含适当的阴性对照,其中反转录阴性对照对于监控DNA污染至关重要。
该对照的设置方法为:在制备反应体系时,不加入反转录酶,其余组分与实验组完全相同。经过完整的逆转录与PCR扩增流程后,若在此对照中仍能检测到明显的扩增信号,则强烈提示原始RNA样本中可能存在基因组DNA或既往PCR产物的污染。通过此对照,可有效识别并排除由非cDNA模板引起的假阳性结果,从而确保实验数据解释的准确性。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


