非酒精性脂肪性肝炎(NASH)作为非酒精性脂肪性肝病(NAFLD)的进行性亚型,其特征为肝细胞脂肪变性、炎症反应及不同程度的肝纤维化,并显著增加肝硬化与肝细胞癌风险。其发病机制复杂,涉及脂质代谢紊乱、胰岛素抵抗、氧化应激、炎症信号通路异常激活及细胞凋亡等多个相互关联的病理生理环节。鉴于单一靶点药物的临床疗效有限,近年来,针对NASH的多靶点协同干预策略已成为基础研究与药物开发的核心方向,旨在通过整合性调控多个关键病理环节,实现更有效的疾病缓解与组织学改善。
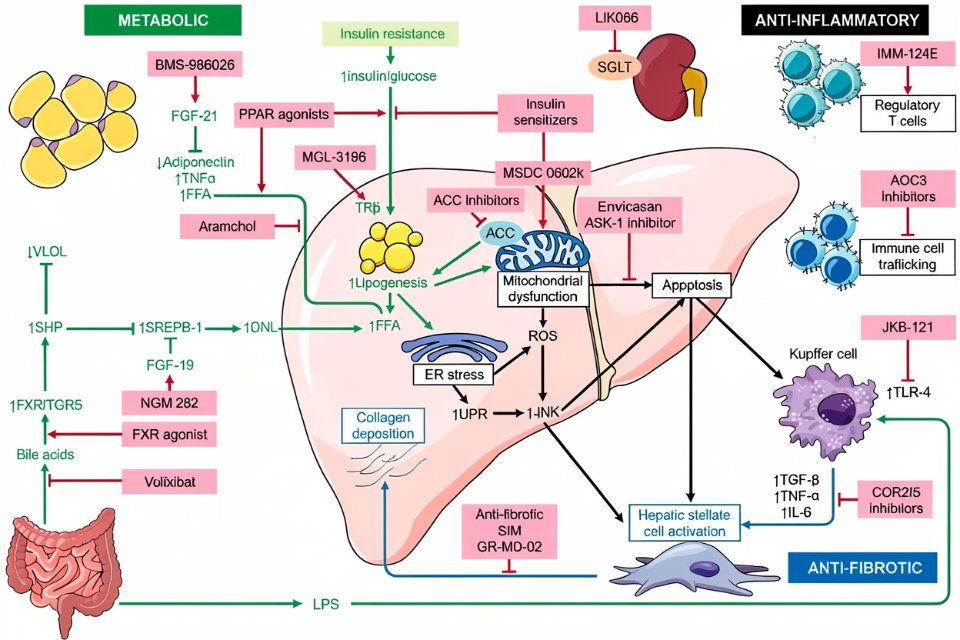
一、多靶点干预的理论基础与核心路径
NASH的疾病进程并非由单一因素驱动,而是“多重打击”或“平行打击”综合作用的结果。这为多靶点干预提供了坚实的病理生理学基础。核心干预路径主要聚焦于以下几个方面:
1. 代谢紊乱的协同调控: 肝脏脂质过度积累与全身胰岛素抵抗是NASH的始动与核心因素。干预策略不仅需促进肝脏脂肪酸氧化、抑制新生脂肪生成以减少脂质输入,还需改善外周组织(如肌肉、脂肪)的胰岛素敏感性,减少游离脂肪酸向肝脏的输送。同时,调节胆汁酸代谢、改善线粒体功能也是纠正代谢失衡的重要方面。
2. 炎症与细胞应激的综合管理: 脂毒性引发肝细胞应激(如内质网应激、氧化应激),进而激活以Kupffer细胞为主的固有免疫系统,释放大量促炎细胞因子(如TNF-α, IL-1β, IL-6),形成慢性低度炎症状态。多靶点干预需同时减轻细胞应激损伤,并抑制关键炎症信号通路(如NF-κB, JNK通路)的过度活化。
3. 抗纤维化与修复机制的联合激活: 持续的炎症与损伤会激活肝星状细胞,导致细胞外基质过度沉积,是NASH向肝硬化发展的关键步骤。有效的干预需整合抑制HSC活化、促进基质降解以及保护/修复肝细胞功能等多重手段,以阻断或逆转纤维化进程。
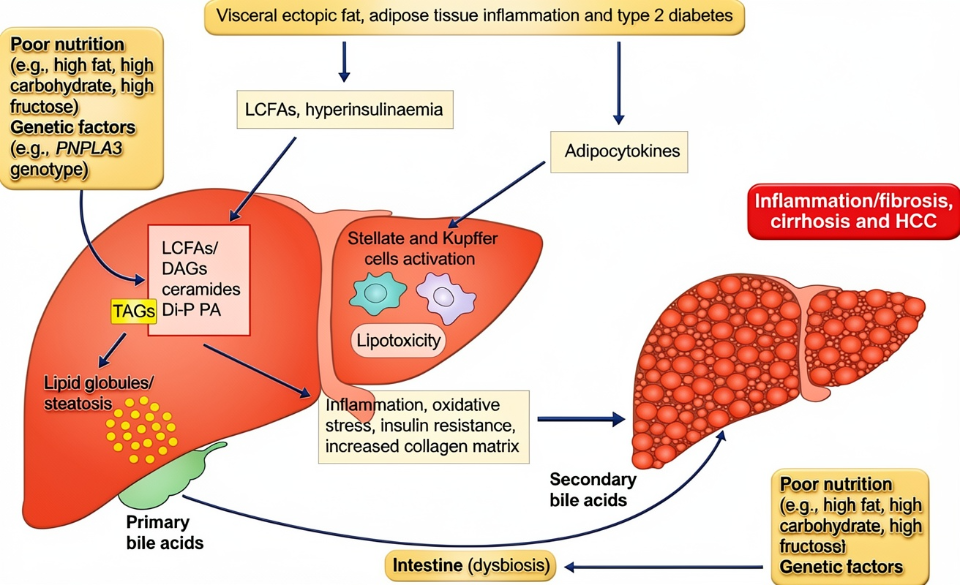
二、多靶点干预的主要策略模式
基于上述路径,目前的策略模式主要分为单一分子多靶点作用与多成分/多药物联合应用两大类。
1、单分子多靶点药物设计: 通过合理药物设计,开发能够同时作用于两个或多个关键靶点的单一化合物。例如,同时作为过氧化物酶体增殖物激活受体(PPAR)α/δ或α/γ/δ的泛激动剂,可协同调节脂代谢、葡萄糖稳定并发挥抗炎作用;双重或多重激动剂设计,如同时靶向法尼醇X受体(FXR)与GPBAR1(TGR5),可兼顾胆汁酸代谢调节与抗炎、能量消耗促进。此类策略旨在获得协同增效、减少不良反应的优化药理谱。
2、多组分/多机制联合疗法: 将两种或多种具有不同作用机制的药物进行联合应用,是目前临床研究最活跃的领域。典型的组合模式包括:
👉代谢调节剂与抗炎/抗纤维化剂联用: 如将一种胰岛素增敏剂或脂代谢调节剂与一种针对炎症通路或抗纤维化的药物联合。
👉双重代谢通路抑制联用: 同时针对脂肪酸摄取合成与胆固醇代谢通路。
👉基础代谢改善与靶向递送联用: 在生活方式干预或基础代谢病治疗基础上,联合针对肝脏特异病理过程的靶向药物。
三、面临的挑战与未来展望
尽管多靶点干预前景广阔,但仍面临一系列科学与临床挑战。首先,疾病的高度异质性要求识别更精准的生物标志物以区分不同疾病亚型,从而指导个体化的靶点组合选择。其次,药物间复杂的药代动力学相互作用及潜在叠加的毒性风险需要通过严谨的临床前与临床研究进行系统性评估。再者,如何设计合理的临床试验终点,以科学评估多靶点疗法在肝脏组织学、代谢参数、长期硬终点等方面的综合获益,仍需学界达成共识。
未来研究方向应侧重于:利用系统生物学与人工智能方法,深度解析NASH的复杂网络,识别最优的协同靶点对或靶点群;开发更先进的药物递送系统,实现药物在肝脏的特异性分布与控释,提高疗效并降低全身暴露风险;开展设计严谨的适应性临床试验,高效筛选和验证有前景的多靶点组合方案。
四、结论
NASH的多靶点干预策略代表了应对这一复杂代谢炎症性疾病的前沿方向。其核心在于超越单一环节的局限,通过对脂质代谢、炎症反应及纤维化生成等多个相互关联的核心病理环节进行系统性、协同性调控。尽管在靶点选择、组合优化及临床验证方面仍存在诸多挑战,但随着对疾病机制认识的不断深入以及药物开发技术的进步,基于多靶点的整合治疗策略有望为NASH患者提供更有效、更安全的治疗选择,最终改变该疾病的自然病程。未来的成功将依赖于跨学科合作的深化,以及从基础研究到临床转化全链条的创新。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


