一、细胞转染在真核细胞基因功能研究中的应用
细胞转染是将外源核酸(包括DNA和RNA)导入真核细胞的核心技术手段。由于外源核酸分子本身难以直接穿透细胞膜,其高效进入靶细胞通常依赖于特定转染试剂的介导与包装。通过这一过程,外源遗传元件得以在细胞内稳定或瞬时表达,从而实现对细胞功能的定向干预与观察。
该技术在生命科学研究中具有广泛的应用场景,涵盖基因功能解析、基因表达调控机制研究、肿瘤生物学机制探讨、疾病模型构建以及重组蛋白表达系统建立等多个重要领域。凭借其操作的灵活性与适用范围的广泛性,细胞转染已成为现代分子生物学与细胞生物学研究中不可或缺的基础实验体系。
二、细胞转染试剂的选择依据与性能评估
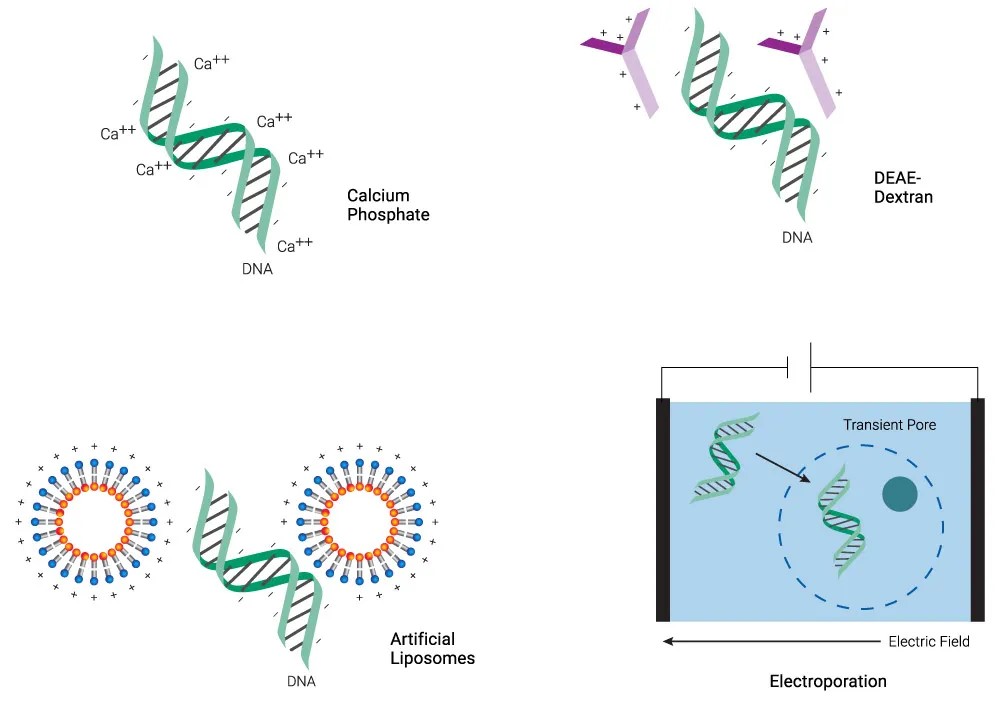
细胞转染试剂是实现外源核酸或蛋白质高效导入真核细胞的必要工具。依据转导原理及适用场景的不同,转染试剂主要可分为化学介导转染、物理转染(如电穿孔)及病毒介导转染等类型。各类试剂在作用机制、操作流程及应用范围方面存在显著差异,因此在实际使用中需依据实验体系与目标进行合理选择。
在选择转染试剂时,应从以下几个核心维度进行系统评估:
1、转染效率
不同试剂的转染效率差异显著,直接影响外源基因的表达水平。选择时需权衡目标基因表达强度与转染效率之间的适配性,避免为追求高效率而牺牲其他实验参数。
2、细胞毒性
部分转染试剂可能引发细胞应激反应、凋亡或生理功能受损。应优先选择细胞相容性高、毒性较低的试剂,以维持细胞活性和实验结果的可靠性。
3、试剂稳定性与保存条件
不同试剂对保存环境的敏感性不同。部分试剂需严格低温保存以维持活性,稳定性较差者更易受操作环境影响。选择时应结合实验室条件,确保试剂性能的可持续性。
4、适用细胞类型
各类细胞对转染试剂的兼容性差异明显。某些试剂仅对特定细胞系有效,而另一些则具备广谱适用性。实验前应确认目标细胞与所选试剂的匹配程度。
5、转染目的与表达模式
根据转染目的不同,表达模式可分为瞬时转染与稳定转染。化学试剂多适用于瞬时表达研究,而病毒系统更适合需长期稳定表达基因的实验设计。
6、实验成本与资源匹配
试剂价格差异较大,需在满足实验性能要求的前提下,结合研究预算进行合理选择,避免资源浪费或性能妥协。
7、技术支持与供应链可靠性
试剂供应商的技术支持能力、产品质量稳定性和交付保障是实验顺利进行的重要保障,应作为综合评估的组成部分。
综上所述,细胞转染试剂的合理选择需在多维度指标之间进行系统权衡。唯有结合实验目的、细胞模型、表达需求与实验室条件,方可确定最适合的实验方案。
三、转染试剂的稳定性要求与保存规范
转染试剂的稳定性及其储存条件直接影响试剂的活性、功能完整性及实验结果的可靠性。合理的保存与操作规范是维持试剂性能、保障实验可重复性的关键前提。在选择与使用转染试剂时,应从以下几个方面对其稳定性特征进行评估与维护:
👉保存温度控制
不同转染试剂对温度的耐受性存在差异。多数试剂要求在干燥、避光及低温环境中保存,但具体温度范围不尽相同:部分试剂可稳定储存于常温条件,另一些则需置于4℃、-20℃甚至更低温度环境中。使用前应严格依据试剂说明书所载明的储存条件执行,避免因温度偏离导致试剂结构破坏或活性丧失。
👉冻融管理
部分转染试剂对反复冻融高度敏感,多次经历液相-固相转换可致其活性显著下降甚至完全失活。为防止此类损伤,建议首次使用前将试剂按单次用量进行分装,并储存于相应温度条件下。每次使用时仅取用所需份量,避免整瓶试剂反复冻融。冻融过程中应确保试剂完全溶解并充分混匀,以保证组分分布均一。
👉湿度防护
转染试剂中的活性成分多具有吸湿性或易水解特性,长期暴露于高湿环境中可能发生降解或失活。因此,试剂应储存于密封性良好的容器中,并置于干燥环境。开启与分装操作应迅速完成,尽量减少试剂与空气接触时间。
👉避光保存
部分转染试剂含有光敏性组分,长时间暴露于自然光、紫外光或强人工光源下可能诱发光解反应,导致活性下降。推荐使用棕色或不透光容器储存试剂,存放位置应避免直射光照。实验操作过程中亦应尽量减少试剂在光下的暴露时长。
👉使用期限管理
转染试剂通常设有明确的有效使用期限,该期限基于稳定性考察数据制定。超出有效期的试剂,即使储存条件符合要求,其活性与转染效能亦无法得到保证。应建立试剂使用登记制度,优先使用临近效期批次,并杜绝使用过期试剂开展关键实验。
👉交叉污染防控
转染试剂的污染防控涵盖试剂间交叉污染与外源污染物进入两个方面。分装时应使用无菌、无核酸酶污染的实验耗材,不同试剂应使用独立器具进行操作。试剂瓶口与瓶盖应保持清洁,开启后及时密闭,防止外来污染物进入。
综上所述,转染试剂的稳定性维持依赖于全流程的规范操作,涵盖储存、分装、取用及效期管理等多个环节。严格遵循试剂说明书及相关技术规范,有助于最大限度保持试剂性能,为后续细胞转染实验的稳定开展提供基础保障。
四、转染试剂用量优化原则
转染试剂用量是决定外源核酸导入效率与细胞存活率的关键参数之一。试剂用量不足将导致核酸包裹不完全、细胞摄取效率低下;而用量过高则可能引发膜损伤、代谢应激甚至细胞死亡。因此,在实验体系中建立合理的用量梯度并开展系统优化,是实现高效转染与可重复结果的技术前提。
试剂最佳用量并非固定数值,而是受多重因素协同影响。首先,不同细胞类型对试剂的耐受阈值存在显著差异,贴壁细胞与悬浮细胞、原代细胞与传代细胞系之间往往需调整剂量。其次,转染体系中核酸用量与试剂用量需保持适当比例,过高或过低的配比均会干扰核酸-试剂复合物的形成及其表面电荷特性,进而影响细胞对复合物的内吞效率。此外,培养容器底面积、培养基体积及细胞融合度亦应纳入用量计算考量,以维持单位细胞所受转染压力的一致性。
实践中,推荐采用剂量梯度实验确定特定实验体系下的最优试剂用量。可在固定核酸浓度的前提下设置若干试剂剂量梯度,同步监测转染效率与细胞活力,以两者交集区间作为后续实验的工作浓度。该优化过程应针对每一细胞模型分别开展,避免跨细胞类型直接套用已有参数。
建立规范化的转染试剂用量计算与验证流程,不仅有助于提升外源基因表达水平,亦可有效降低实验变异度,为基因功能研究及蛋白质表达系统构建提供稳定的实验基础。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


